大黄素-香豆素噻唑类衍生物的合成及其抗哈氏弧菌活性
2023-09-22吴玉宇梁馨文苏子钦高田田胡继亮张建龙刘玮炜
吴玉宇, 梁馨文, 苏子钦, 陈 超, 高田田, 邱 敏, 胡继亮, 刘 强, 张建龙, 刘玮炜,2,3*
(1. 江苏海洋大学 药学院 江苏省海洋药物活性分子筛选重点实验室,江苏 连云港 222005;2. 江苏海洋大学 海洋科学与水产学院 江苏海洋生物技术重点实验室,江苏 连云港 222005;3. 江苏海洋大学 海洋科学与水产学院 江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005)
近年来,我国的海水养殖业发展迅猛,渔业产量大幅增长,稳居世界前列。但随着养殖规模和集约化程度的不断提高,养殖环境日益恶化,各类水产致病菌引发的病害频发,严重阻碍了海水鱼类的养殖和发展,给海水养殖业带来了巨大损失[1-2]。我国的海水养殖疾病已多达100余种,细菌性疾病是其中一类最常见的、多发性的和危害最大的病害,已知的病原菌达数10种,而哈氏弧菌(Vibrioharveyi)是其中一种主要的条件致病菌[3-4]。
当前对于海水养殖过程中的细菌性疾病多采用化学药物防治的方法,主要包括抗生素类药物青霉素,喹诺酮类药物诺氟沙星,磺胺类药物新诺明,呋喃类药物痢特灵以及抗菌增效剂甲氧苄胺嘧啶等。但长期单一使用一种药物会产生抗性,出现耐药性菌株[5]。因此,水产养殖生产对安全有效的新型抗菌药的需求日益加剧,寻找新的先导化合物或化合物骨架修饰、简化并开发出新型水产抗菌药已成为当前水产病害防控研究的热点。
天然产物来源广泛,生物活性丰富,是发现药物或先导化合物的重要来源。随着分析仪器、分析化学和实验手段的迅速发展,天然产物中的活性成分得到了鉴定及分离纯化。研究表明,抑菌、杀菌的有效成分主要包括含氮含硫化合物、生物碱、酰胺、香豆素及醌类化合物等[6-7]。将其中具有开发前景的化合物作为活性先导,再进行结构修饰和简化,寻找活性更高、更为安全有效的候选药物,具有很好的研究价值与研究意义。
大黄素(图1)普遍存在于蓼科植物大黄、虎杖和芦荟等中药材中,也能从海洋真菌和海绵体伴生真菌中分离得到,是分布最广泛的一种天然三羟基蒽醌类化合物[8-11]。大黄素作为一种重要的天然活性成分,其生物活性广泛,包括保护肝脏[13-14]、导泻[15]、抗菌[16-17]、抗炎[18]、抗癌[19-20]、抗病毒[21-22]、抗氧化[23]及降糖降脂[24-25]等。
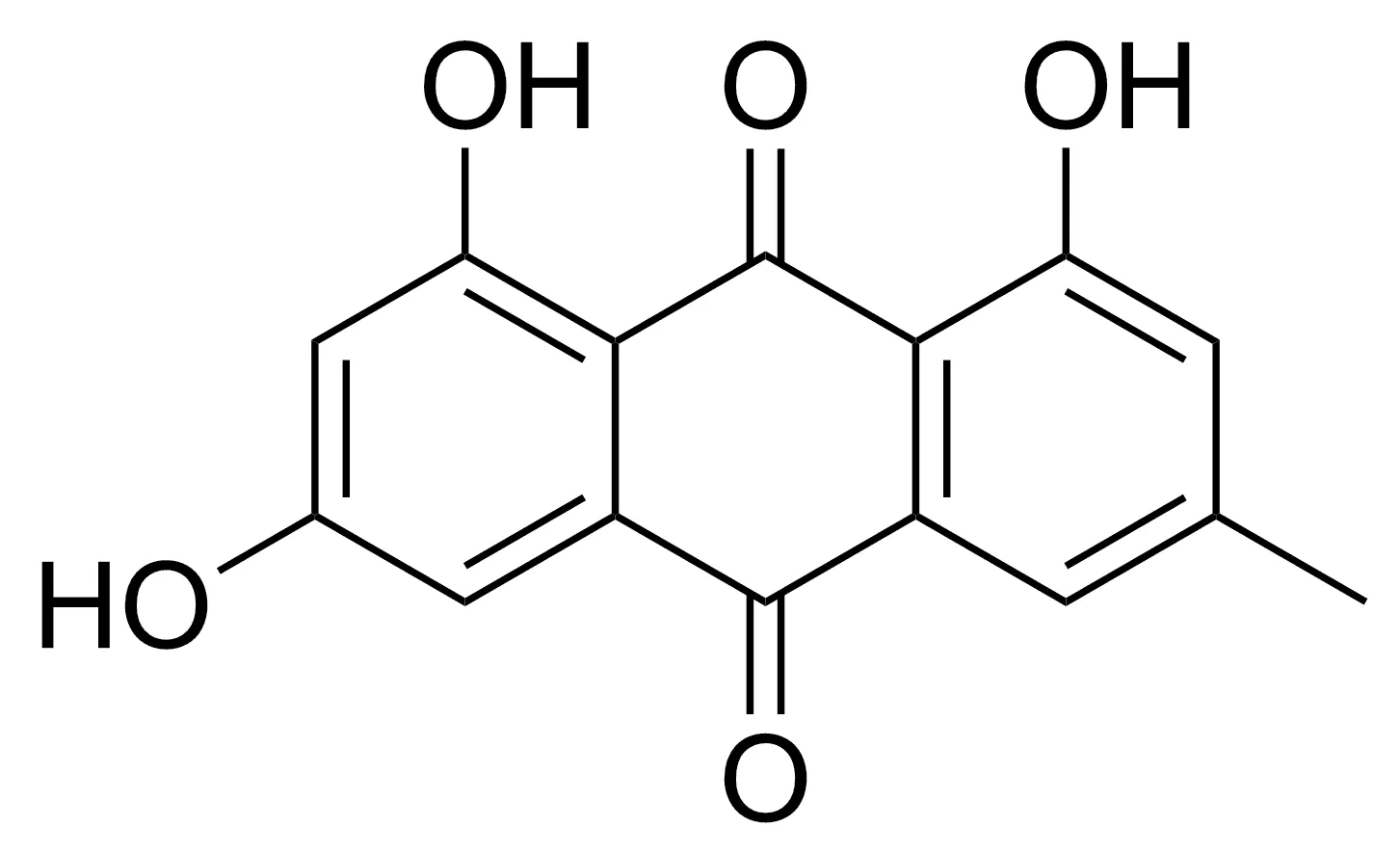
图1 大黄素的结构
目前,化学修饰大黄素主要集中在6-位甲基,通常是利用甲基或乙酰基保护1-、 3-和8-位的3个羟基,然后再由化学修饰甲基位,最后选择性地将保护基脱除。其中,FALK课题组[26]的研究很有代表性,该课题组对大黄素6-位甲基分别进行了卤代、甲酰化及氨基化修饰。甲基保护羟基后,对6-位的甲基进行溴代,经一系列反应后制得核碱基为胞嘧啶腺嘌呤和胸腺嘧啶的ω,ω-二取代金丝桃素衍生物。另外,研究表明,带有氨基的蒽醌类化合物拥有较强的细胞毒活性[27]。因此,FALK课题组[28]利用Curtius重排,在大黄素甲基位引入氨基,使其成为一个更好的反应中间体(图2)。在大黄素上增加一个环可以使大黄素的平面结构增大,从而使其紫外吸收波长红移达到医学需求。FALK课题组[29]将大黄素甲酰化,并将其作为关键中间体与杂环类化合物反应,在大黄素甲基位上引入一个五元杂环。研究发现:这类大黄素衍生物最大吸收波长均在600 nm左右,另外还具有一定的生物活性(图3)。

图2 大黄素胺的合成

图3 大黄素杂环衍生物的结构
STEFANO等[30]将四芳基叶琳类化合物引入大黄素的甲基位,发现该类化合物作为光敏试剂具有良好的效果,同时测定此化合物对人结肠腺癌细胞的抑制活性,结果表明,此类衍生物的IC50值均小于2 μM,活性远高于母体大黄素(图4)。

图4 大黄素四芳基叶琳类衍生物
香豆素类化合物具有抗菌[31-32]、抗癌[33-34]、抗氧化[35]、抗凝血[36]和调节植物生长[37]等多种生物活性,是现代药物研发的热点。噻唑环是众多活性化合物的核心骨架结构,也是新药研制过程中一个良好的药效基团。目前,临床上使用的广谱抗生素如氨曲南(Ⅰ)、磺胺噻唑(Ⅱ)和头孢地尼(Ⅲ)等都含有氨基噻唑结构(图5)。鉴于此,本研究通过酰胺键将具有良好抑菌活性的香豆素噻唑与大黄素连接到同一个分子中,设计并合成了一系列含香豆素噻唑的大黄素酰胺类衍生物(图6~7)。

图5 含氨基噻唑结构的药物分子

图6 含香豆素噻唑的大黄素酰胺类衍生物的结构
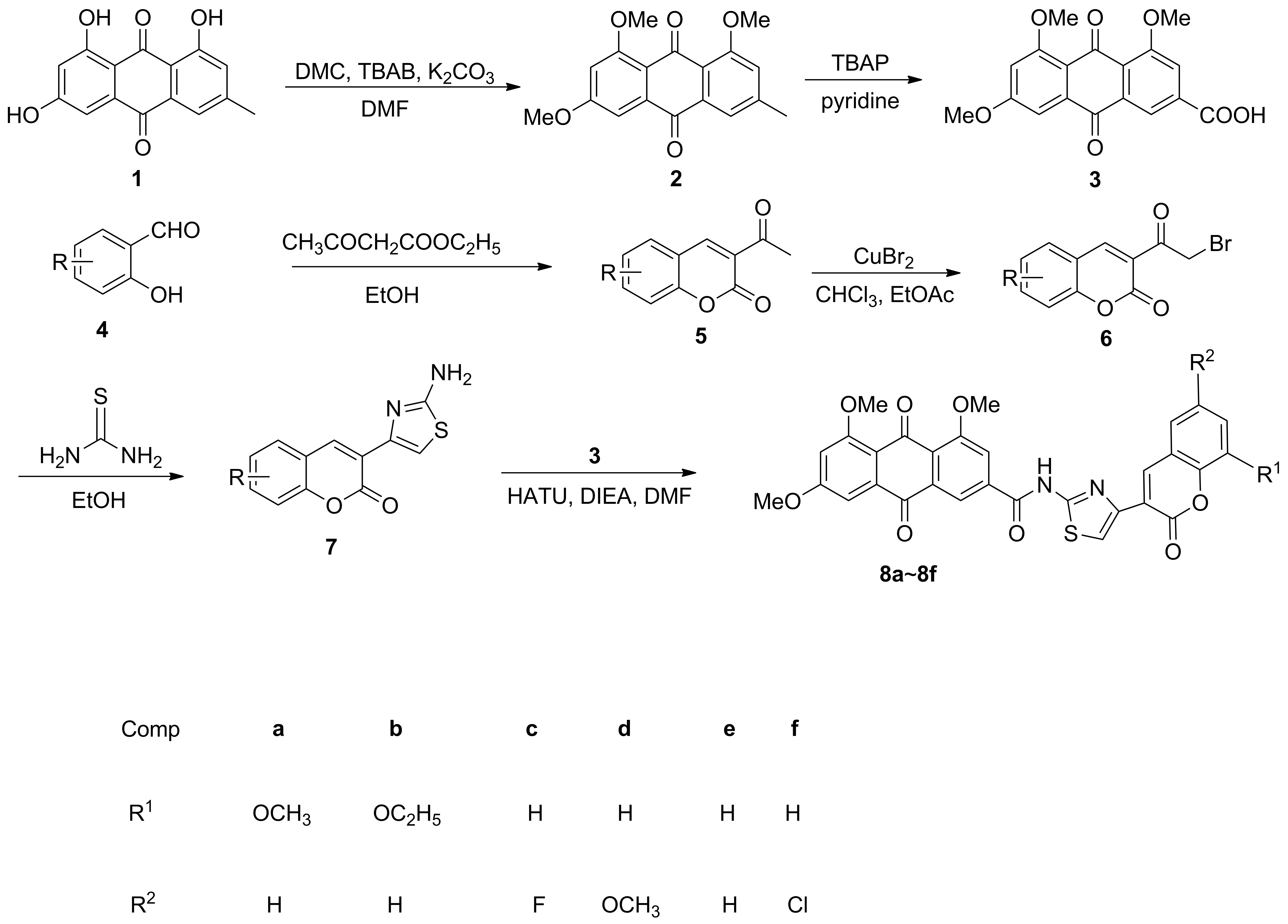
图7 含香豆素噻唑的大黄素酰胺类衍生物的合成路线
1 实验部分
1.1 仪器与试剂
X-4B型数字显微熔点仪;WFH-204B型紫外分析仪;AVANCE型核磁共振氢谱仪(DMSO-d6为溶剂,TMS为内标);WFH-203型红外光谱仪(KBr压片);Agilent 6230型液质联用仪。
大黄素(80%,武汉远成共创科技有限公司);氨水(25%,天津市永大化学试剂有限公司)。其余试剂均为分析纯。
1.2 合成
(1) 化合物2的合成
在250.00 mL圆底烧瓶中,依次加入大黄素1(2.70 g, 10.00 mmol),四丁基溴化铵(1.94 g, 6.00 mmol),无水碳酸钾(2.10 g, 15.00 mmol), 30.00 mL碳酸二甲酯(DMC)和40.00 mL已干燥的N,N-二甲基甲酰胺(DMF),体系加热至110 ℃,磁力搅拌过夜。反应结束后,将反应液倒入盛有400 mL蒸馏水的大烧杯中,加入12 mol/L的浓盐酸调至pH=1,搅拌析出大量固体,减压抽滤,滤饼为得到的粗产品。经柱层析(洗脱剂:二氯甲烷)得黄色固体化合物2,产率73.4%。
(2) 化合物3的合成
首先制备实验中所用的四丁基高锰酸铵(TBAP)。称取高锰酸钾(1.52 g, 9.60 mmol)溶于20.00 mL蒸馏水,搅拌条件下,缓慢滴加溶于10.00 mL蒸馏水的四丁基溴化铵(3.10 g, 9.60 mmol),滴加完毕,室温继续搅拌1 h,大量紫色固体析出,抽滤,水洗3次,用乙醚-丙酮混合溶剂重结晶得到TBAP。然后,称取自制的TBAP(3.00 g, 8.30 mmol)和化合物2(0.50 g, 1.60 mmol)置于圆底烧瓶中,加入60.00 mL吡啶,于80 ℃条件下搅拌反应2.5 h,反应完毕,冷却,移至冰水浴,加入焦亚硫酸钠(5.00 g, 26.30 mmol),继续搅拌0.5 h后,将反应液倒入装有500.00 mL蒸馏水的烧杯中,用浓盐酸调至pH=1,溶液由紫色变为黄色,大量固体析出,抽滤,滤饼水洗3次,得黄色固体30.40 g,产率83.0%。
(3) 化合物5的合成
50.00 mL圆底烧瓶中依次加入水杨醛类化合物4(6.40 mmol),乙酰乙酸乙酯(1.00 mL, 7.70 mmol),再加入20.00 mL乙醇使其溶解,室温搅拌反应5 min后,加入6.00 μL哌啶,继续搅拌,TLC监测反应,反应完毕,析出固体,经抽滤得化合物5。
(4) 化合物6的合成
50.00 mL圆底烧瓶中依次加入溴化铜(1.00 g, 4.50 mmol)以及10.00 mL乙酸乙酯,在55 ℃条件下加热搅拌0.5 h。称取化合物5(2.30 mmol)溶于10.00 mL氯仿,并缓慢滴加至反应液中,在55 ℃条件下继续搅拌过夜,反应完毕,冷却至室温,抽滤,取滤液蒸除溶剂,加入二氯甲烷,水洗3次,分液,取有机相蒸除溶剂得粗品6。
(5) 化合物7的合成
称取化合物6(1.00 mmol)以及硫脲(1.10 mmol)置于单口烧瓶中,加入20.00 mL乙醇,升温至80 ℃,搅拌反应1.5 h,反应完毕,冷却至室温,加入氨水中和,析出固体,抽滤,滤饼用乙醇洗涤,干燥得化合物7。
(6) 化合物8a~8f的合成
25.00 mL圆底烧瓶中依次加入化合物3(0.21 g, 0.60 mmol)、 2-(7-偶氮苯并三氮唑)-N,N,N′,N′-四甲基脲六氟磷酸酯(HATU)(0.34 g, 0.90 mmol)、N,N-二异丙基乙胺(DIEA)(248.00 μL, 1.50 mmol)以及12.00 mL二氯甲烷,室温搅拌反应0.5 h后,称取化合物7加入到反应液中,继续室温搅拌过夜,反应完毕,析出固体,抽滤,所得固体依次用饱和碳酸氢钠、稀盐酸以及蒸馏水洗涤数次得化合物8。
4,5,7-三甲氧基-N-(4-(8-甲氧基-2-氧代-2H-铬-3-基)噻唑-2-基)-9,10-二氧基-9,10-二氢蒽-2-甲酰胺(8a): 黄色固体,收率62.0%, m.p.>310 ℃;1H NMR(500 MHz, CDCl3)δ: 9.92(s, 1H, NH), 8.57(s, 1H), 8.30(s, 1H), 8.25(s, 1H, Ar-H), 8.03(s, 1H, Ar-H), 7.36(d,J=2.0 Hz, 1H, Ar-H), 7.24(s, 1H, Ar-H), 7.20(d,J=7.7 Hz, 1H, Ar-H), 7.10(d,J=7.9 Hz, 1H, Ar-H), 6.81(d,J=1.8 Hz, 1H, Ar-H), 4.11(s, 3H, OCH3), 4.00(s, 3H, OCH3), 3.98(d,J=1.7 Hz, 6H, OCH3);IR(KBr): 3421, 2848, 1727, 1662, 1599, 1466, 1317, 1276, 1072, 1009, 876 cm-1; HR-MS(ESI)m/z: calcd for C31H23N2O9S{[M+H]+}599.11188, Found 599.11121。
4,5,7-三甲氧基-N-(4-(8-乙氧基-2-氧代-2H-铬-3-基)噻唑-2-基)-9,10-二氧基-9,10-二氢蒽-2-甲酰胺(8b): 黄色固体,收率61.0%, m.p.280~282 ℃;1H NMR(500 MHz, CDCl3)δ: 10.51(s, 1H, NH), 8.56(s, 1H), 8.37(d,J=0.9 Hz, 1H), 8.27(s, 1H, Ar-H), 8.07(s, 1H, Ar-H), 7.36(d,J=2.3 Hz, 1H, Ar-H), 7.25(t,J=7.8 Hz, 1H, Ar-H), 7.20(d,J=7.2 Hz, 1H, Ar-H), 7.11(d,J=7.8 Hz, 1H, Ar-H), 6.81(d,J=2.2 Hz, 1H, Ar-H), 4.24(q,J=7.0 Hz, 2H, CH2), 4.14(s, 3H, OCH3), 4.00(s, 3H, OCH3), 3.99(s, 3H, OCH3), 1.28(t,J=3.2 Hz, 3H, CH3). IR(KBr) : 3426, 2970, 2782, 1727, 1664, 1600, 1463, 1316, 1278, 1068, 1019, 883 cm-1; HR-MS(ESI)m/z: calcd for C32H25N2O9S{[M+H]+}613.12753, found 613.12746。
4,5,7-三甲氧基-N-(4-(6-氟-2-氧代-2H-铬-3-基)噻唑-2-基)-9,10-二氧-9,10-二氢蒽-2-甲酰胺(8c): 黄色固体,收率68.0%, m.p.>310 ℃;1H NMR(500 MHz, CDCl3)δ: 9.90(s, 1H, NH), 8.57(s, 1H), 8.32(s, 1H), 8.29(s, 1H, Ar-H), 8.06(s, 1H, Ar-H), 7.39(s, 2H, Ar-H), 7.32(d,J=7.5 Hz, 2H, Ar-H), 6.84(s, 1H, Ar-H), 4.13(s, 3H, OCH3), 4.02(s, 6H, OCH3); IR(KBr) : 3408, 2974, 2779, 1728, 1676, 1600, 1465, 1316, 1254, 1072, 1024, 881 cm-1; HR-MS(ESI)m/z: calcd for C30H20FN2O8S{[M+H]+}587.09189, found 587.09124。
4,5,7-三甲氧基-N-(4-(6-甲氧基-2-氧代-2H-铬-3-基)噻唑-2-基)-9,10-二氧基-9,10-二氢蒽-2-甲酰胺(8d): 黄色固体,收率61.0%, m.p.268~270 ℃;1H NMR(500 MHz, CDCl3)δ: 8.61(s, 1H), 8.37(s, 1H), 8.27(s, 1H, Ar-H), 8.07(s, 1H, Ar-H), 7.37(d,J=2.3 Hz, 1H, Ar-H), 7.33(s, 1H, Ar-H, Ar-H), 7.16(dd,J=9.0 Hz, 2.9 Hz, 1H, Ar-H), 7.09(d,J=2.7 Hz, 1H, Ar-H), 6.83(d,J=2.3 Hz, 1H, Ar-H), 4.14(s, 3H, OCH3), 4.02(s, 3H, OCH3), 4.00(s, 3H, OCH3), 3.90(s, 3H, OCH3); IR(KBr) : 3422, 2843, 2778, 1715, 1667, 1599, 1466, 1319, 1259, 1026, 881 cm-1; HR-MS(ESI)m/z: calcd for C31H23N2O9S{[M+H]+}599.11188, found 599.11126。
4,5,7-三甲氧基-N-(4-(2-氧代-2H-铬-3-基)噻唑-2-基)-9,10-二氧代-9,10-二氢蒽-2-甲酰胺(8e): 黄色固体,收率64.0%, m.p.294~295 ℃;1H NMR(500 MHz, CDCl3)δ: 8.53(s, 1H), 8.32(d,J=6.4 Hz, 1H), 8.07(s, 1H, Ar-H), 7.92(s, 1H, Ar-H), 7.74(s, 1H, Ar-H), 7.49(s, 1H, Ar-H), 7.39(s, 2H, Ar-H), 7.07(s, 1H, Ar-H), 6.85(s, 1H, Ar-H), 4.14(s, 3H, OCH3), 4.03(s, 6H, OCH3); IR(KBr): 3420, 2970, 1719, 1648, 1598, 1455, 1318, 1252, 1070, 1028, 878 cm-1; HR-MS(ESI)m/z: calcd for C30H21N2O8S:{[M+H]+}569.10131, found 569.10143。
4,5,7-Trimethoxy-N-(4-(6-chloro-2-oxo-2H-chromen-3-yl)thiazol-2-yl)-9,10-dioxo-9,10-dihydroanthracene-2-carboxamide(8f): 黄色固体,收率65.0%, m.p.>310 ℃;1H NMR(500 MHz, CDCl3)δ: 8.46(s, 1H), 8.39(s, 1H), 8.24(s, 1H, Ar-H), 8.05(s, 1H, Ar-H), 7.58(d,J=2.0 Hz, 1H, Ar-H), 7.50(dd,J=8.7 Hz, 2.3 Hz, 1H, Ar-H), 7.34(d,J=8.7 Hz, 2H, Ar-H), 6.81(d,J=2.3 Hz, 1H, Ar-H), 4.13(s, 3H, OCH3), 4.00(s, 3H, OCH3), 3.99(s, 3H, OCH3); IR(KBr): 3404, 2976, 2901, 1734, 1632, 1598, 1454, 1250, 1087, 1050, 881 cm-1; HR-MS(ESI)m/z: calcd for C30H20ClN2O8S{[M+H]+}603.06234, found 603.06228。
1.3 哈氏弧菌活性测试
无菌环境下,向平板中倒入约20 mL已灭菌的牛肉膏蛋白胨琼脂培养基,凝固后,加入200 μL的菌悬液,涂布棒涂布均匀,静置10 min。将牛津杯垂直均匀放置于培养基上,在杯中加入200 μL的待测样品,每个样品进行3次平行实验,移至37 ℃恒温培养箱培养18 h后,用电子数显卡尺测定抑菌圈直径,取3次测量结果的平均值。
2 结果与讨论
2.1 抗哈氏弧菌活性测试
化合物8a~8f的抗菌实验结果如表1所示。从表1可以看出,合成的6个含香豆素噻唑的大黄素酰胺类衍生物在浓度为0.25 mg/mL时对哈氏弧菌基本无抑制活性,然而只有化合物8b、8c和8f表现出较弱的哈氏弧菌抑制活性,MIC均为0.25 mg/mL。

表 1 化合物8a~8f体外抑制哈氏弧菌活性测试
本研究以取代水杨醛为原料,通过Knoevengel法制得3-乙酰基香豆素,经溴化铜溴化后与硫脲反应,采用经典的Hantzsch法关环得到香豆素噻唑类衍生物。最后,在HATU的缩合作用下,中间体大黄素羧酸与3-(2-氨基噻唑-4-基)香豆素类化合物反应,得到6个新型含香豆素噻唑的大黄素酰胺类衍生物。此外,对6个新化合物进行哈氏弧菌活性测试,发现化合物8b、8c和8f表现出较弱的哈氏弧菌抑制活性,MIC均为0.25 mg/mL,表明该化合物对哈氏弧菌的活性具有一定影响。在今后研究中,有望改善和提高该类衍生物的抗菌活性,为找到更高活性的抗哈氏弧菌化合物作为新型水产抗菌药提供参考。
