外源糖对‘媚丽’葡萄酒发酵品质的影响
2023-09-21谢琦何媛王婉妮房玉林鞠延仑
谢琦,何媛,王婉妮,房玉林,2,鞠延仑*
(1. 西北农林科技大学葡萄酒学院,陕西杨凌 712100;2. 西北农林科技大学合阳葡萄试验示范站,陕西合阳 715300)
糖作为酒精产生的物质基础,与葡萄酒的感官品质及其风味有着密切关系[1],添加不同种类和含量的外源发酵糖对葡萄酒的感官品质和风味有着不同程度的影响[2-3]。有研究表明,糖类的添加有助于乳酸菌进行同型乳酸发酵,以降低制品的pH,增加乳酸产量[4]。糖类还具有一定的护色作用,有利于促进红色的生成,并降低亚硝酸盐的残余量,促使制品形成良好风味[4]。不同种类糖用作培养基的发酵试验说明,葡萄糖和果糖在进行发酵时能产生更多的挥发性物质,从而产生更多风味[5]。在葡萄酒发酵过程中葡萄糖的添加可改善植物香和果香,果糖和蔗糖的添加可改善青草香、花香、甜香和果香[6]。
葡萄果实中含有葡萄糖、果糖和少量的其他糖类物质[7],其中葡萄糖与果糖比值接近1∶1[8]。在葡萄酒发酵过程中,葡萄糖不仅作为酿酒酵母的碳源,也是酵母生长代谢的重要调节因子。在酒精发酵过程中,酵母细胞优先利用葡萄糖,导致葡萄糖含量快速减少,葡萄糖/果糖的比值急剧下降,发酵结束时果糖含量远高于葡萄糖。有研究表明,当葡萄糖与果糖比值低于0.1时,发酵进程缓慢甚至终止[9]。
近年来,国内外对于葡萄酒发酵中糖利用的研究多与提高酵母菌对果糖的利用率和添加不同外源糖对葡萄酒品质影响有关,但是关于不同外源糖添加比例对酒体影响的研究未见报道。因此,本研究以西北农林科技大学自育葡萄品种‘媚丽’为对象,于同一外界条件和酿造工艺下,在酒精发酵期间添加不同比例的葡萄糖和果糖,探究不同比例外源糖处理对葡萄酒品质的影响。根据其理化指标对不同处理组葡萄酒进行对比分析,优选利于葡萄酒品质的外源糖添加比例,为后续外源发酵糖的添加研究奠定理论基础和提供数据支撑。
1 材料与方法
1.1 材料与试剂
原料为‘媚丽’葡萄,2020年9月5日采摘于陕西省杨凌区曹新庄葡萄试验园内,总糖含量为199.5 g·L-1。
葡萄糖(D-Glucose 分析纯)、蔗糖(食品级)购自天津市科密欧化学试剂有限公司;果糖(D-Fructose)购自北京索莱宝科技有限公司;CVE-7葡萄酒活性干酵母购自安琪酵母股份有限公司;氢氧化钠、盐酸、乙酸乙酯、酒石酸钾钠、邻苯二甲酸氢钾等均为分析纯,购自天津天力化学试剂有限公司。
1.2 仪器与设备
气相色谱仪为Agilent 7890 GC,质谱仪选用Agilent 5975C Inert MSD(Agilent, Santa Clara, CA,USA);Agilent 1100高效液相色谱仪(HPLC),美国安捷伦公司;UPLC I-Class仪、AP-9901S真空抽滤器,美国Autoscience公司;AS3120B超声波脱气机,天津奥特赛恩斯仪器有限公司;R206旋转蒸发仪,上海申生科技有限公司;5804R低温冷冻离心机,北京酶阿查生物控股有限公司。
1.3 原酒发酵
原料进行分选与除梗破碎后,等量均匀地加入6个10 L的试验用发酵罐中。补充43.5 g·L-1蔗糖调整原料至目标酒度13.5%(Vol )。按表1所示在发酵启动后向各罐分别添加相应的葡萄糖与果糖,其余所需糖量用蔗糖补齐,保持各罐总外源糖量为40 g (以葡萄糖计)。酒样6作为对照组(CK)除蔗糖外不再加其他可发酵糖。分别向各罐内添加SO260 mg·L-1,果胶酶40 mg·L-1。取部分葡萄汁加入活性干酵母在35 ℃活化后按200 mg·L-1接入发酵罐中。控制温度在22~25 ℃进行浸渍发酵,每天进行温度比重测量并压帽3次。待比重稳定至0.999以下时进行皮渣分离,自发启动苹果酸-乳酸发酵,待比重稳定至0.994~0.996,还原糖降至4 g·L-1以下结束发酵,倒罐清除酒泥,添加60 mg·L-1SO2抑制有害菌的滋生,满罐密封至冷库进行储存。
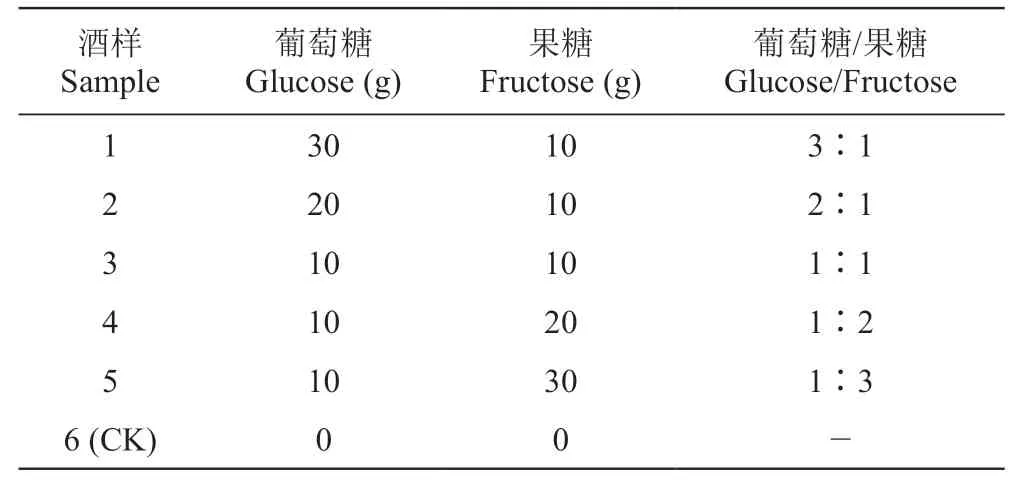
表1 酒样品添加葡萄糖果糖量及比例Table 1 Proportion of added sugars in wine samples
1.4 理化指标测定
酒精发酵期间,进行温度、比重的测量,直至发酵终止。发酵启动后的0、12、24、48、72 h五个时间节点取样,参考《葡萄酒分析检验》[10]斐林试剂热滴定法测量还原糖含量,酒精计法测量酒度。发酵结束后,按照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中所描述的测定葡萄酒中酒精度、残糖量、挥发酸(以醋酸计)、游离SO2等基本理化指标。
1.5 单体酚测定
单体酚的测定参照前人的研究方法[11-14]并略作修改。吸取2 mL酒样于离心管中,加入2 mL乙酸乙酯(分析纯),漩涡振荡30 s,4 ℃ 3500 r·min-1离心10 min,取上清液,重复萃取3次,合并上清液并于离心浓缩仪中蒸干后用2 mL甲醇溶解残渣。0.22 μm过滤膜处理后置于-20 ℃的环境下保存,留作色谱分析。使用Agilent 1100高效液相色谱仪(HPLC)对样品进行测定,每处理组取两次平行,以去离子水做空白对照,分别精准配制不同浓度梯度的14种单体酚混合标样,建立标准曲线,计算样品含量。
色谱柱条件如下:每次取样量10 μL;Agilent 1100高效液相色谱仪(HPLC)色谱柱(2.1 mm×50 mm,1.7 μm);二极管阵列检测器检测波长280 nm;流速0.2 mL·min-1;柱温30 ℃;波长为210~400 nm;流动相中A相为1%乙酸(1∶99,Vol)水溶液,B相为乙腈;梯度洗脱程序:0~3 min,3%~6%B;3~7 min,6%~15%B;7~11 min,15%~30%B;11~13 min,30%B;13~15 min,30%~3%B。
1.6 花色苷测定
单体花色苷的测定参考前人的研究方法[15-16]并稍作修改。滤径为0.22 μm的有机微孔滤膜对待测葡萄酒样进行过滤,在高效液相色谱仪中直接进样并检测。精准配制不同浓度梯度的8种单体花色苷标样,建立标准曲线,计算样品含量。单体花色苷的含量以二甲花翠素-3-葡萄糖苷计。
色谱条件:色谱柱采用BEH C18反相色谱柱(50 mm×2.1 mm,7 μm),柱温为30 ℃。A流动相的体积比为甲酸∶水=10∶90;B流动相的体积比为乙腈∶甲酸=90∶10。洗脱程序:3%B,0~1 min;3%~15%B,1~12 min;15%~25%B,12~14 min;25%~30%B,24~28 min;30%~4%B,28~32 min;4%B,32~40 min;流速:1.0 mL·min-1;检测波长520 nm。
1.7 香气物质的测定
参考赵婷等[17]的研究方法,并稍作修改。准确称取1.00 g NaCl,加入5 mL待测酒样品于15 mL 的样品瓶中,加入磁力搅拌子(1 cm),室温条件下萃取。之后加入10 μL内标物质4-甲基-2-戊醇(4M2P,1.0083 g·L-1),迅速用隔热盖子拧紧,每个酒样两次重复。将样品瓶放在磁力加热搅拌台上,40 ℃的平衡振动30 min(转速1100 r·min-1),再将已经活化好的萃取头插入样品的顶空部分,在40 ℃的条件下萃取30 min,然后去除萃取头插入GC进样口,在进样口解析8 min,按照中国农业大学葡萄与葡萄酒研究中心建立的葡萄酒香气检测方法进行检测,每样品两个技术重复。
定性定量:未知化合物与NIST2014数据库进行检索匹配定性,用内标物质4-甲基-2-戊醇半定量计算各化合物含量。
1.8 数据处理
使用Excel 2019对所得数据进行整理,用SPSS 26.0进行方差分析及多重比较(P≤0.05),使用Graphpad 8.0.2 进行绘图,并使用Origin 2021进行PCA分析。
2 结果与分析
2.1 不同外源糖比例对发酵过程的影响
酒样发酵周期为5 d,图1为发酵启动后5 d内不同酒样温度、比重、还原糖、酒度变化情况。各酒样在发酵期间均保持在22~27 ℃。在发酵中期(2~4 d),酒样4、5温度变化最为明显,酒样1、2温度变化相对较小。发酵末期温度变化顺序为酒样3>酒样4>酒样5。在启酵后的12 h内,还原糖下降速率基本持平。在所有酒样中,下降速率由快到慢为:酒样1(酒样4)>酒样2(酒样5)>酒样3(CK),各酒样还原糖均在48 h降为0。
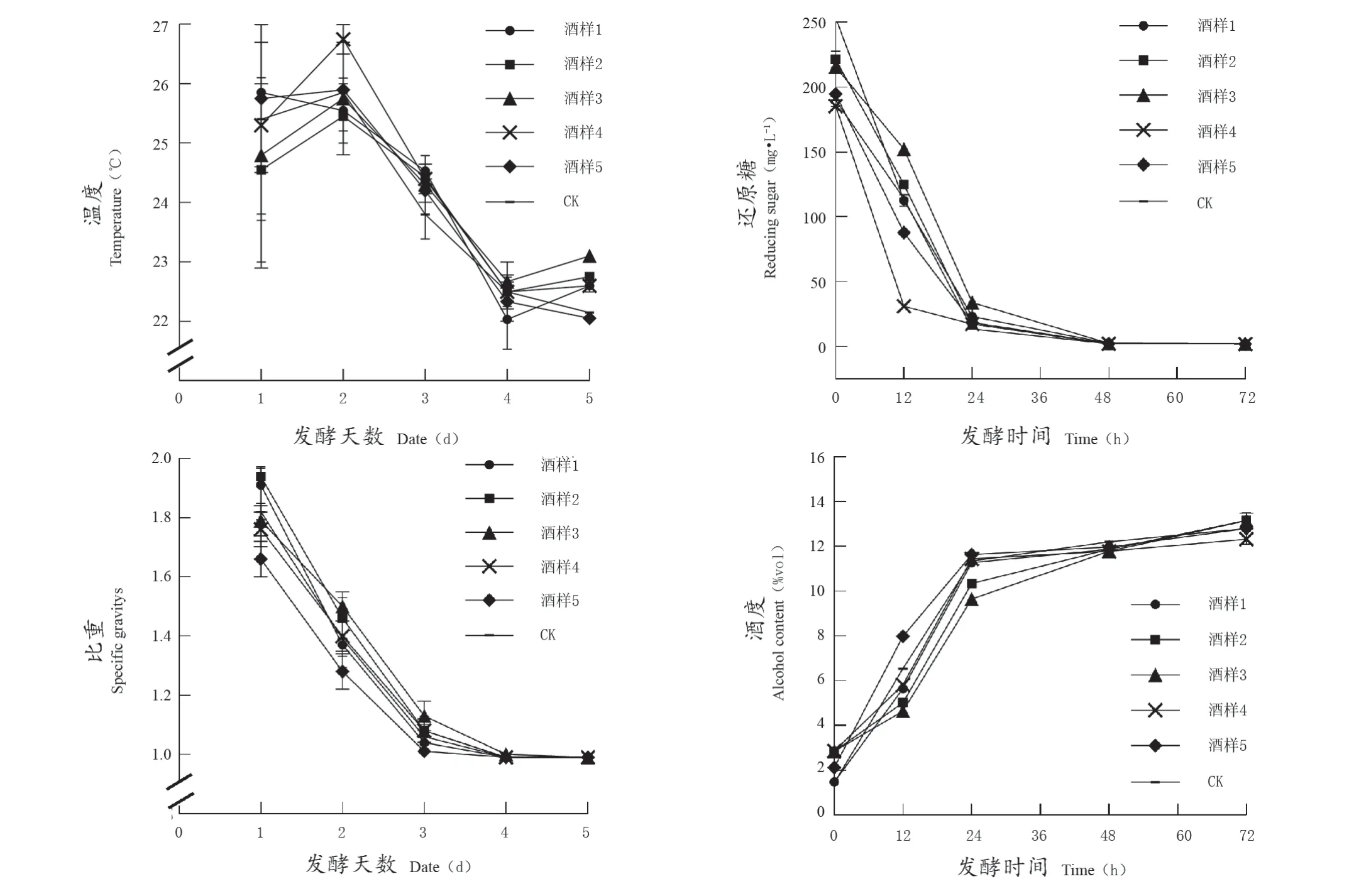
图1 不同外源糖酒样发酵期间的温度、比重、还原糖、酒度变化Figure 1 Changes of temperature, specific gravity, reducing sugar and alcohol content during fermentation of different exogenous sugar wine samples
比重变化可反应发酵进程。所有酒样均在在启酵后1~3 d内比重变化最明显,呈大幅度下降趋势。在各酒样中,在发酵前中期(1~4 d)酒样1比重下降最快,酒样5比重下降最慢,表明酒样1中酒精生成速率最快,反之酒样5酒精生成速率最慢。比重下降速率酒样3>酒样4>酒样5,即在同等条件下,果糖比例越高发酵速率越慢。酒度变化规律与比重变化规律一致,即比重下降越快,酒度升高越快。综上所述,葡萄糖含量越高则酒精发酵速率越快;果糖含量越高则对酵母菌抑制越大,从而导致酒精发酵速率减缓。
2.2 不同外源糖比例对葡萄酒理化指标的影响
表2可知,酒样1中还原糖显著高于其他酒样;随着酒样中葡萄糖/果糖比例不断降低,挥发酸含量则随之升高,酒样5中挥发酸含量显著高于其他酒样;外源添加葡萄糖大于等于果糖的酒样1~3最终酒度高于其他组。酒样2和酒样6中的游离硫显著低于其他组,酒样5中的总硫显著高于其他组。造成此结果的原因可能与酵母菌对葡萄糖和果糖的利用率不同和酒样中发酵糖的浓度有关。
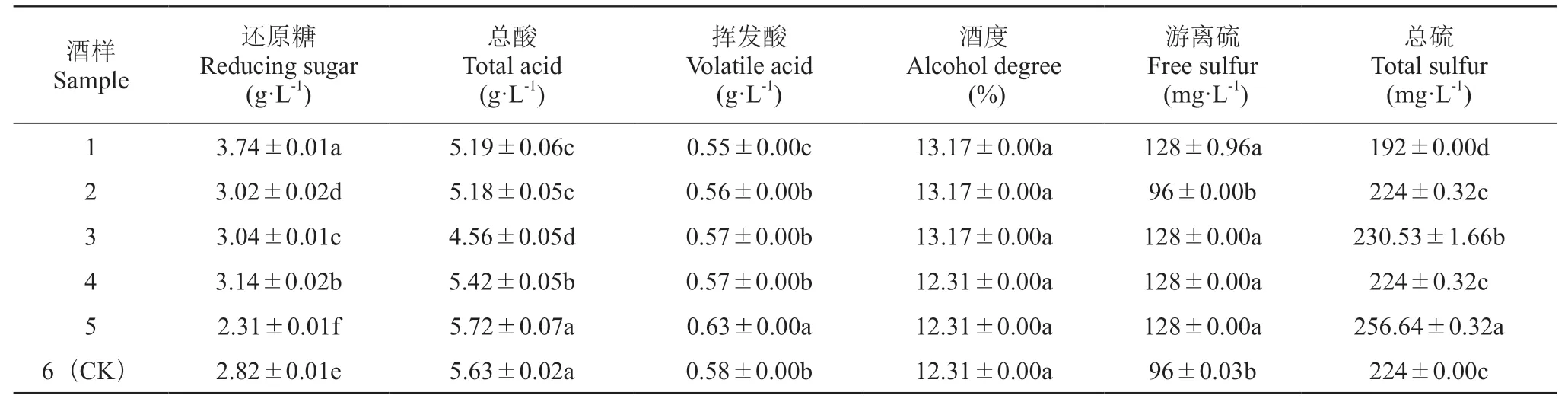
表2 酒样理化指标Table 2 Physical and chemical indexes of wine samples
2.3 不同外源糖比例对酒中单体酚含量的影响
表3显示,所有酒样共检测出黄烷-3-醇4种,酚酸6种,黄酮醇2种。在6组酒样中,原花青素B1是主要的黄烷-3-醇物质,显著高于其他3种物质,且以酒样4含量最高,酒样3含量最低;所有酒样中的原花青素B2、儿茶素和表儿茶素含量的差异均不显著。在黄烷-3-醇总含量中,酒样4高于其他酒样,酒样3低于其他酒样。
在所有酚酸物质中,含量最高的分别是龙胆酸和没食子酸。酒样2酚酸总含量最高,酒样5酚酸总含量最低。在酒样1、2、4、5 和 CK中,酚酸物质含量最高的均为没食子酸,其中酒样2没食子酸含量最高,酒样3没食子酸含量最低;酒样3中含有最多的酚酸物质为龙胆酸。酒样5中咖啡酸、原儿茶酸含量均为最低。酒样4中咖啡酸、没食子酸、原儿茶酸、绿原酸、反式阿魏酸均不同程度地高于CK,而龙胆酸含量略低于CK。
酒样1与3、酒样2与5中黄酮醇总含量无较大差距;酒样3黄酮醇总含量最低,CK总含量最高。两种黄酮醇物质中,酒样4中槲皮素含量最高,酒样3中槲皮素含量最低。酒样1、5和CK槲皮素含量无较大差距。CK芦丁含量最高,酒样1芦丁含量最低,相比对照组下降69%。经添加不同葡萄糖与果糖处理,各酒样芦丁含量以及黄酮醇总含量均较CK有所减少。
2.4 不同外源糖比例对葡萄酒花色苷含量的影响
6个酒样中主要检测出8种花色苷,分别为二甲花翠素-3-葡萄糖苷、花青素-3-葡萄糖苷、甲基花翠素-3-葡萄糖苷、甲基花青素-3-葡萄糖苷、甲基花青素-3-(6-乙酰)-葡萄糖苷、二甲花翠素-3-(6-乙酰)-葡萄糖苷、甲基花青素-3-(6-反式对香豆酰)-葡萄糖苷、二甲花翠素-3-(6-反式对香豆酰)-葡萄糖苷。由图2得出,与CK相比,各处理组酒样花色苷含量均发生不同程度的上升。酒样1花色苷含量变化最显著,二甲花翠素-3-葡萄糖苷、花青素-3-葡萄糖苷、甲基花青素-3-葡萄糖苷的含量变化最为显著。其中二甲花翠素-3-葡萄糖苷和甲基花青素-3-葡萄糖苷的含量增幅最大,分别为75.79%和92.89%。
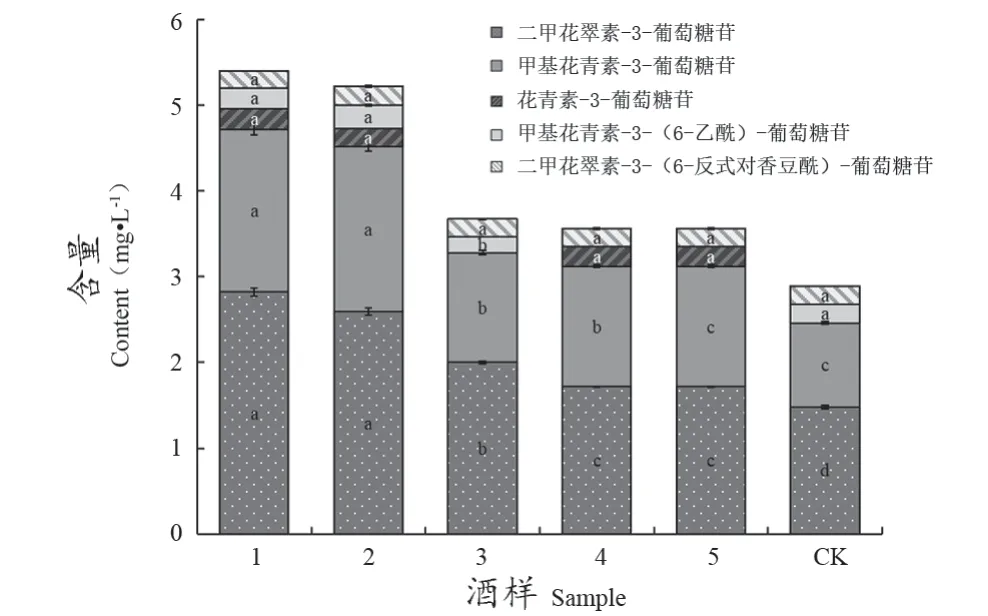
图2 不同葡萄糖/果糖比例影响下花色苷含量变化Figure 2 Anthocyanin content under different glucose/fructose ratio
本试验表明,添加不同比例的葡萄糖/果糖对同一工艺下的葡萄酒中花色苷的含量产生影响。随着葡萄糖含量的逐渐降低,酒样1、2、3中花色苷总含量逐渐下降,由此表明葡萄糖对葡萄酒花色苷形成具有一定影响,葡萄糖含量越高,花色苷总含量越多。
2.5 不同外源糖比例对葡萄酒香气物质的影响
如表4中数据显示,随着原酒中果糖含量的逐渐增加,酒样3~5中酯类物质含量逐渐增加。酒样2、3的醇类物质含量显著低于CK,即前两者香气复杂性小于CK[18]。在酒样1~3中,随着外源添加葡萄糖比例逐渐降低,所产生的醇类、烯类、醛类和酮类物质总含量逐渐降低。在所有酒样中,酒样5中酯类、酸类、醛类和酮类物质含量均明显高于其他酒样。酒样5中的果糖含量最为丰富,说明果糖含量有利于葡萄酒中酯类、酸类、醛类、酮类物质的生成。据香气物质检出种类数可知,酒样5各类香气物质种类数(64种)明显多于CK(55种)与其他酒样,更高的果糖比例可使葡萄酒含有更多种类呈香物质,香气更加丰富。
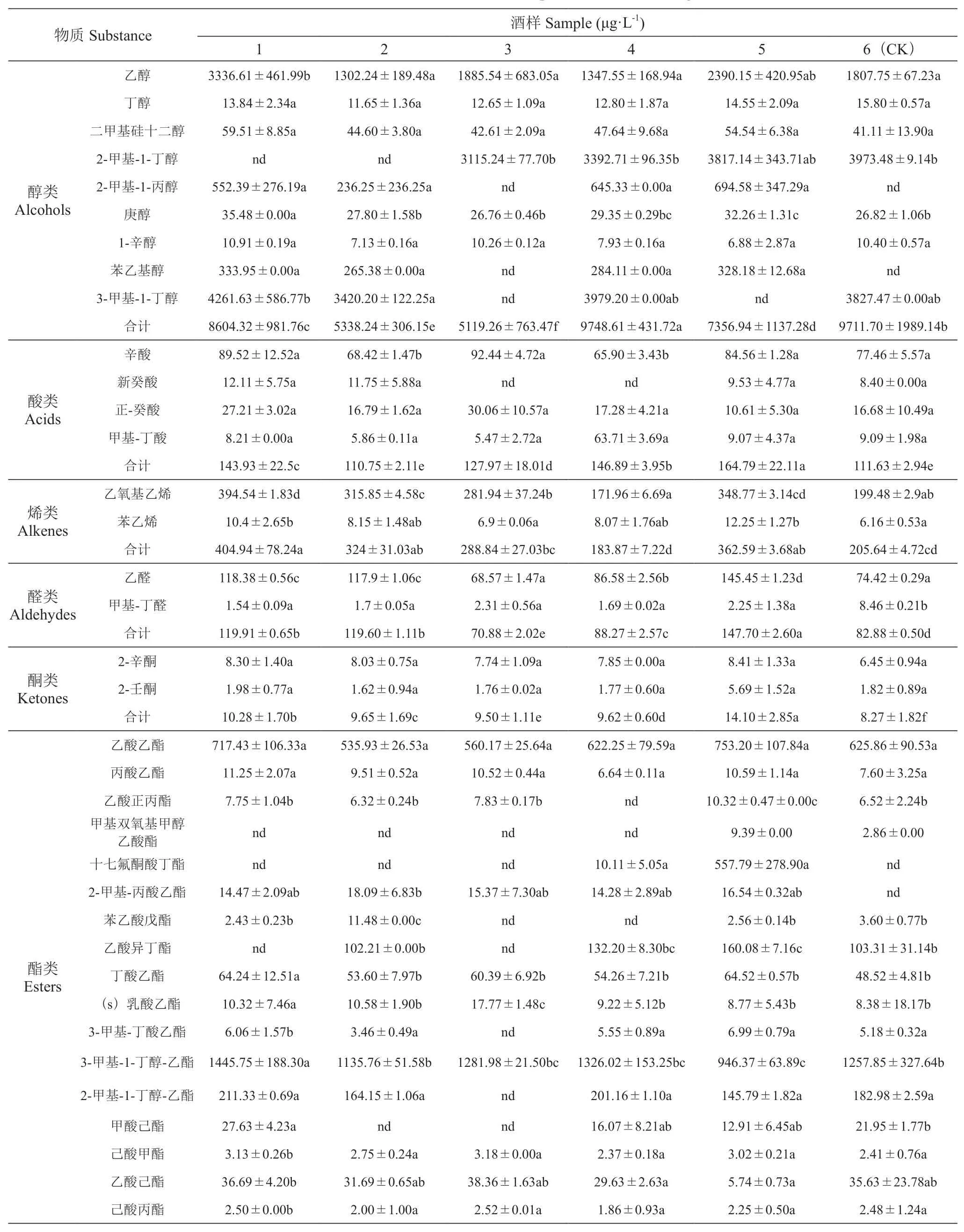
表4 不同葡萄糖/果糖处理下不同酒样香气物质含量Table 4 The content of aroma substances in different wine samples under different glucose/fructose treatments
2.6 不同外源糖比例对葡萄酒影响的主成分分析
为了进一步描述添加不同葡萄糖与果糖比例对葡萄酒的影响,选取基本理化指标、单体酚、花色苷和香气物质进行主成分分析(PCA),结果如图3和图4。主成分分析所得的前两个主成分分别解释了整体方差的32.1%(PCA1)和19.8%(PCA2),共描述了数据51.9%的差异性。不同组别较为分散,其中PCA2较好的区分外源糖添加比例,说明外源糖添加比例对于葡萄酒的影响具有显著性。同一组别较为集中,实验重复性良好。综合PCA成分载荷图和结果图发现,与其他酒样相比,酒样5有机酸含量更加丰富,酒样6(CK) 中芦丁含量更加丰富,酒样2含有更多的儿茶素和没食子酸 。
3 讨论
通过对发酵罐中酒样的温度、比重、还原糖和酒度的检测发现,在葡萄糖与果糖含量呈规律性变化的同时,其发酵进程和酒度生成情况也呈现一定规律。发酵末期温度随果糖比例增高而下降,可能为果糖和葡萄糖共用一套膜运输和酶催化体系所致[19],但果糖对膜运输和酶的亲和力均小于葡萄糖,因而酵母往往偏向利用葡萄糖[20-21],对果糖的利用更为困难,故果糖比例越高,酵母细胞在发酵后期越不活跃。通过发酵监测发现,在葡萄糖和果糖含量呈规律性变化的同时,酒样的发酵进程和酒度生成也表现出一定的规律性。添加葡萄糖最多的酒样糖度消耗最快,温度上升速度及比重下降均为最快;反之,添加果糖最多的酒样糖度消耗、温度变化以及比重变化情况最慢。这是由于酵母菌利用葡萄糖的能力大于果糖,当酒样中葡萄糖浓度较高时,酵母菌活性增强,对糖度消耗速率加大,自身产能加快,因此发酵罐内的温度便会在短时间内快速上升,酒精生成速率也随之加快;由于酵母菌自身摄取果糖困难,在高果糖浓度的环境下,酵母菌摄食能力受到抑制,胁迫因素被放大,因此酵母菌产能效率急速下降。
酚类物质是葡萄酒中最重要成分之一,其含量多少对葡萄酒的品质有很大影响,其中黄烷-3-醇、酚酸和黄酮醇是酚类物质的重要构成成分,对葡萄酒的品质起决定性作用。添加不同比例的葡萄糖/果糖对葡萄酒样中黄烷-3-醇、酚酸和黄酮醇的含量存在一定影响。在葡萄酒味觉感官中,苦味主要来源于黄烷-3-醇[22],本试验中酒样4的黄烷-3-醇含量明显高于其他酒样。已有研究表明,酚类物质含量与葡萄酒的干涩强度呈正相关,其包括原花青素和儿茶素[23],因此推测试验酒样3和酒样5的干涩口感相对较弱。添加不同比例的葡萄糖-果糖的酒样,黄烷-3-醇、酚酸和黄酮醇含量均发生不同程度的变化,酒样4中酚类物质的总含量、黄烷-3-醇含量最高,酒样2中酚酸和没食子酸含量最高,而对照酒样中黄酮醇含量最高。葡萄酒中黄酮醇是花青素的辅色素,与苯乙烯酸以及黄烷醇均具有抗氧化、稳定葡萄酒颜色的作用[24],因此不加外源糖的酒样较其他酒样有更好的颜色稳定性。
通过GC-MS对添加不同比例发酵糖的酒样挥发性香气物质进行检测,共检测出64种挥发性物质,其中包括酯类物质45种,醇类物质9种,酸类物质4种,萜烯类物质2种,醛类和酮类物质各2种。分析表明,添加果糖量越多的酒样中所产生的挥发性化合物种类越多,且酯类、酸类、化合物种类均多于对照组。果糖含量越多,越有利于酯类、酸类、烯类、醛类、酮类物质的形成。在所有酒样中,酒样5的果糖含量最高,产生的挥发性化合物种类最多,多达62种。其中酯类、酸类、醛类、酮类物质的含量均高于其他试验组。表明添加不同比例葡萄糖与果糖对葡萄酒中香气物质的形成有很大影响,果糖含量越高,产生的风味越复杂。果糖的存在能促进葡萄酒形成更加浓郁的风味,这与赵旭[25]的研究相符合。
主成分分析基本理化指标、单体酚、花色苷和香气物质发现,不同的外源糖添加比例对于葡萄酒的影响具有显著性。其中有机酸、芦丁、儿茶素和没食子酸含量对不同酒样的区分贡献较大,说明葡萄糖果糖添加比例对其有很大影响。
4 结论
本试验结果表明,葡萄酒中葡萄糖和果糖含量直接影响启酵时间和发酵速度,较高的葡萄糖含量会加快酵母菌的代谢,而较高的果糖含量则会抑制酵母菌的生长活性。葡萄酒中的葡萄糖与果糖含量会影响葡萄酒中挥发性物质及非挥发性物质的产生,添加不同比例的葡萄糖与果糖对葡萄酒中黄烷-3-醇、酚酸和黄酮醇的含量存在一定影响。葡萄糖含量越高,花色苷总含量越高。果糖含量与葡萄酒中风味物质的形成有密切联系,果糖含量越高,产生的风味物质种类及含量越丰富。当添加葡萄糖与果糖比例为1∶3时,在降低葡萄酒苦涩口感的同时能提高花色苷含量,并产生更加复杂的香气,对葡萄酒整体品质的提高具有显著作用。
