枸杞刺梨复合饮料的工艺优化及其降血糖性能
2023-09-19石玉璞牛思思韩璐瑶李莞颖余君伟武冰辉徐波张艳萍曹艳乔长晟
石玉璞,牛思思,韩璐瑶,李莞颖,余君伟,武冰辉,徐波,张艳萍,曹艳,乔长晟*
(1.天津科技大学 生物工程学院,天津 300457;2.天津市工业微生物重点实验室,工业发酵微生物教育部重点实验室,天津 300457;3.天津北洋百川生物技术有限公司,天津 300457;4.宁夏中宁枸杞产业创新研究院有限公司,宁夏 中卫 755100;5. 杞源堂(宁夏)生物科技有限公司,宁夏 中卫 755100;6. 宁夏中农艾森检测有限公司,宁夏 中卫 755100;7.国家合成生物技术创新中心,天津 300308)
枸杞是茄科枸杞属植物果实,枸杞植株是多年生、多分枝、多棘刺落叶灌木[1],在我国具有源远流长的历史。枸杞广泛生长于中国西北干旱和半干旱地区[2]。枸杞富含枸杞多糖、枸杞酸、类胡萝卜素和其他小分子,如类黄酮、生物碱[3]、萜类化合物、固醇类、有机酸、花青素和药效氨基酸[4]等。枸杞具有解热止渴、调节机体免疫力、降血压、降血脂、抗炎、抗肿瘤的作用,而且能够对机体产生一定的肝保护、神经保护和辐射保护作用[5]。
刺梨别名茨梨、刺蘑等,系蔷薇科落叶灌木植物[6],广泛分布于中国亚热带地区。刺梨具有极高的营养价值和药用价值,刺梨中含有大量维生素C、有机酸[7]、刺梨多糖、黄酮、多酚、氨基酸以及数十种对人体有益的微量元素[8],具有抗氧化、抗衰老、增强抵抗力、抗动脉粥样硬化、促消化、美容养颜、预防高血压、降胆固醇、降血糖、降血脂等多种作用[9]。
血糖是保障机体有序且高效运作的人体主要的供能物质,一般情况下,人体可以通过激素调节和神经调节的方式,使体内的血糖值保持动态稳定[10]。高血糖会对人的眼睛、肾、心血管造成损害[11]。近年来,随着人们对糖尿病更深入地研究,发现提高α-淀粉酶和α-葡萄糖苷酶的抑制活性可有效控制血糖[12]。买尔哈巴·艾合买提等[13]用乳明串珠菌和副干酪乳杆菌发酵驼乳,优化驼乳发酵的条件,提高了α-淀粉酶和α-葡萄糖苷酶抑制率。周笑犁等[14]发现经发酵后的番茄发酵液的α-淀粉酶的抑制率有了明显的提高。管立军等[15]发现用乳酸菌发酵刺五加叶可以提高活性成分,增强抗氧化和降血糖能力。
为了进一步研究枸杞和刺梨在功能食品饮料上开发的潜力,本研究利用前期筛选出的发酵性能良好的酿酒酵母,以α-淀粉酶抑制率为指标,将枸杞和刺梨结合起来,利用单因素试验和响应面分析优化枸杞刺梨复合液的发酵工艺,为枸杞刺梨复合饮料与其它药食同源原料的功能性复合饮料的开发提供依据。
1 材料与方法
1.1 材料与试剂
枸杞原浆(中宁品种):杞源堂(宁夏)生物科技有限公司;刺梨粉:贵州百千万电子商务有限公司。
酿酒酵母BCGQ2107:保藏在中国普通微生物菌种保藏管理中心,保藏编号为CGMCC23129。
α-淀粉酶(≥5 U/mg)、α-葡萄糖苷酶(50 U/mg)、阿卡波糖(均为分析纯):上海源叶生物科技有限公司;酵母浸粉、蛋白胨(均为分析纯):北京奥博星生物技术有限公司;葡萄糖(食品级)、磷酸二氢钾、磷酸氢二钠、氯化钠、氯化钾(均为分析纯):天津市赢达稀贵化学厂;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(化学纯):国药基团化学试剂有限公司。
YEPD 培养基:酵母粉1%、蛋白胨2%、葡萄糖2%,pH 自然。固体添加琼脂2%,于121 ℃下灭菌20 min。
1.2 仪器与设备
UV-1200 型紫外分光光度计:日本岛津公司;SKY-2102 型恒温摇床:上海苏坤实业有限公司;SPX-250型恒温生化培养箱:北京永光明医疗器械厂;HH-USB 电热恒温水浴锅:上海赫田科学仪器有限公司;YXQLS-30SII 立式压力蒸汽灭菌器:上海东亚压力容器制造有限公司;S-433D 氨基酸自动分析仪:赛卡姆(北京)科学仪器有限公司;ML204 型电子分析天平:梅特勒-托利多仪器(上海)有限公司。
1.3 试验方法
1.3.1 酿酒酵母种子液制备
在无菌条件下,用接种环从斜面上挑取一环酵母菌株转接到100 mL YEPD 培养基中,置于28 ℃摇床中,200 r/min 条件下恒温振荡培养22~24 h,将种子液稀释25 倍,测定OD600为0.50±0.05,即完成种子液制备。
1.3.2 发酵工艺流程

1.3.3 枸杞刺梨复合饮料操作要点
枸杞汁的制备:枸杞原浆与水按体积比7∶3 混合。刺梨汁的制备:刺梨粉与水按料液比1∶15(g/mL)混合。刺梨汁与枸杞汁按体积比1∶1 混合,得到枸杞刺梨复合汁。
酿酒酵母的接种:在灭过菌的枸杞刺梨复合汁中接入5%经过活化的酿酒酵母菌,纱布封口,得到待发酵液。
枸杞刺梨复合汁的发酵:将制备好的发酵液放入摇床,在28 ℃、200 r/min 条件下发酵72 h。
过滤调配与灭菌:将发酵后得到的枸杞刺梨发酵液过滤,然后添加食品添加剂进行调配,于121 ℃下进行高温高压灭菌20 min,冷却罐装,即可得到枸杞刺梨复合饮料成品。
1.3.4 枸杞刺梨复合饮料单因素试验
1.3.4.1 发酵时间的确定
在刺梨汁与枸杞汁的体积比为1∶1、酿酒酵母接种量5%、发酵温度28 ℃的条件下,考察发酵时间42、48、54、60、66 h 对α-淀粉酶抑制率的影响。
1.3.4.2 刺梨汁与枸杞汁体积比的确定
在酿酒酵母接种量5%、发酵温度28 ℃、发酵时间54 h 条件下,考察刺梨汁与枸杞汁的体积比1∶3、1∶2、1∶1、2∶1、3∶1、4∶1 对α-淀粉酶抑制率的影响。
1.3.4.3 酿酒酵母接种量的确定
在刺梨汁与枸杞汁的体积比3∶1、发酵温度28 ℃、发酵时间54 h 条件下,考察酿酒酵母接种量1%、2%、3%、4%、5%对α-淀粉酶抑制率的影响。
1.3.4.4 发酵温度的确定
在刺梨汁与枸杞汁的体积比3∶1、酿酒酵母接种量5%,发酵时间54 h 条件下,考察发酵温度为22、25、28、31、34、37 ℃对α-淀粉酶抑制率的影响。
1.3.5 枸杞刺梨复合饮料发酵工艺优化响应面试验设计
在单因素试验的基础上,采用Design Expert 8.0.5软件,根据Box-Behnken 试验设计,选择响应值影响较大的发酵时间A、酿酒酵母接种量B、刺梨汁与枸杞汁体积比C 为响应变量,以α-淀粉酶抑制率为响应值进行三因素三水平响应面优化试验。Box-Behnken因素设计水平见表1。

表1 Box-Behnken 因素设计水平Table 1 Factors and levels of Box-Behnken design
1.3.6 指标测定
1.3.6.1 α-淀粉酶抑制率的测定
参考文献[16]的方法,略作改动,在试管中依次加入0.3 mL 样品溶液和0.3 mL α-淀粉酶溶液(1 mg/mL),混匀后在37 ℃下预热5 min;加入0.3 mL 37 ℃的可溶性淀粉溶液(1 g/100 mL),混匀后反应15 min;立即加入0.5 mL DNS 试剂显色,并终止反应,置于沸水中煮沸5 min,随后冷却至室温,加入4 mL 磷酸缓冲盐(phosphate buffer saline,PBS)溶液(pH6.8)。用等体积PBS 溶液作为空白对照,用不同浓度的阿卡波糖作阳性对照。测定样液在540 nm 处的吸光度,每个样品做3 次平行试验,取其平均值。α-淀粉酶抑制率(X,%)计算公式如下。
式中:Aa为PBS 代替样品测得的吸光度;A 为样品溶液吸光度。
1.3.6.2 α-葡萄糖苷酶抑制率测定
参考文献[17]的方法,测定α-葡萄糖苷酶抑制率。α-葡萄糖苷酶抑制率(W,%)计算公式如下。
式中:A1为样品与酶反应后的吸光度;A2为样品的吸光度;A3为酶的吸光度。
1.3.6.3 功能成分的测定
参考GB 5009.86—2016《食品安全国家标准食品中抗坏血酸的测定》测定VC含量。总多酚含量的测定采用福林酚法[18],在波长765 nm 处测定吸光度,以没食子酸含量(x)为横坐标,吸光度(y)为纵坐标,绘制没食子酸标准曲线,回归方程:y=62.221x+0.095 2(相关系数R2=0.993 2)。总黄酮含量的测定采用硝酸铝显色法[19],在波长510 nm 处测定吸光度,以芦丁含量(x)为横坐标,吸光度(y)为纵坐标,绘制芦丁标准曲线,回归方程:y=0.885 4x-0.002 8(相关系数R2=0.999 6),参考文献[20]测定类胡萝卜素含量。参考文献[21]测定多糖含量,在波长490 nm 处测定吸光度,以葡萄糖含量(x)为横坐标,吸光度(y)为纵坐标,绘制葡萄糖标准曲线,回归方程:y=11.647x+0.200 6(相关系数R2=0.997 8)。参照GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》测定氨基酸含量。
1.3.6.4 感官评价
参照GB 7101—2022《食品安全国家标准饮料》和GB/T 31121—2014《果蔬汁类及其饮料(含第1 号修改单)》的评价标准,结合刺梨和枸杞本身的感官特性,由10 位食品专业相关人员分别从色泽、香气、口感、状态4 个方面对枸杞刺梨复合饮料进行评分,总分100。复合饮料感官评分标准见表2。

表2 复合饮料感官评分标准Table 2 Standards for sensory evaluation of compound beverage
1.3.6.5 风味评价
对枸杞刺梨复合发酵液的风味进行感官评价,风味的评价指标包括果香、酒香、焦糖香气、酸败味、异味、花香、油脂味、谷物香气、奶油香气分值从0(无察觉)到40(最强)。
1.4 数据分析
采用Design-Expert 8.0.5 软件进行Box-Behnken试验设计和响应面结果分析,用Origin pro 2021 软件进行数据处理和绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 发酵时间对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响
发酵时间对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响见图1。

图1 发酵时间对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响Fig.1 Effect of fermentation time on α-amylase inhibition rate and sensory score of Lycium barbarum and roxburgh rose compound beverage
由图1 可知,发酵时间为42~54 h 时,随着发酵时间的延长,α-淀粉酶抑制率逐渐增大。当发酵时间为54 h 时,α-淀粉酶抑制率最大,为35.45%,此后,随着发酵时间的延长,抑制率开始下降。由于发酵时间过长,导致饮料产生不良风味,感官评分在发酵60 h 后急剧下降。因此,选择发酵时间48~60 h 进行后续试验。
2.1.2 刺梨汁与枸杞汁体积比对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响
刺梨汁与枸杞汁体积比对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响见图2。
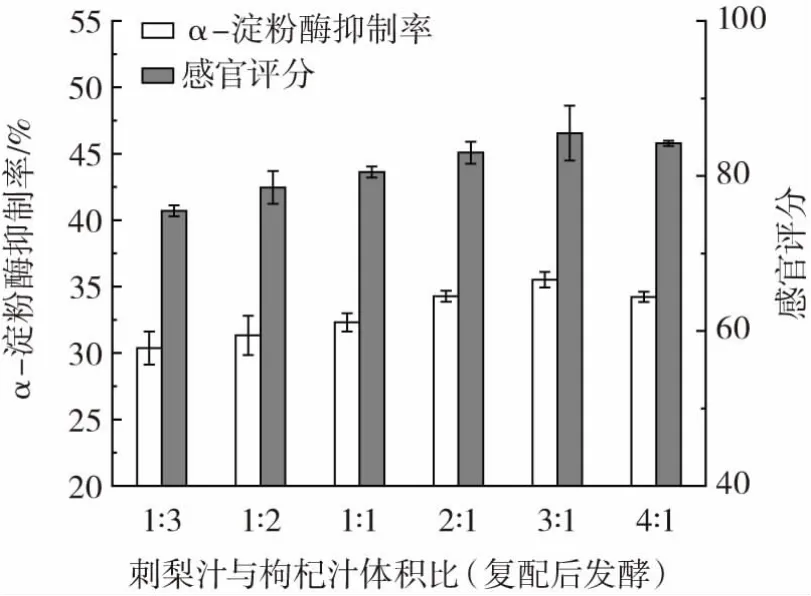
图2 刺梨汁与枸杞汁体积比对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响Fig.2 Effect of volume ratio of roxburgh rose juice to Lycium barbarum juice on α-amylase inhibition rate and sensory score of Lycium barbarum and roxburgh rose compound beverage
由图2 可知,随着刺梨汁添加量的增加,枸杞刺梨复合饮料对α-淀粉酶抑制率逐渐增加,但在体积比达到3∶1 之后,复合饮料对α-淀粉酶抑制率增加效果不显著,当刺梨汁与枸杞汁体积比为3∶1 时枸杞刺梨复合饮料对α-淀粉酶的抑制率达到最高,为35.52%。感官评分也随刺梨汁添加量的增加而升高,当刺梨汁与枸杞汁体积比大于3∶1 时感官评分开始下降,刺梨汁的加入是复合饮料获得香味的主要来源,枸杞汁和刺梨汁均匀混合,得到果香醇厚的产品,随着刺梨汁添加量过多,使发酵液口感偏酸感官评分下降。因此,选择刺梨汁与枸杞汁体积比为2∶1~4∶1 进行后续验。
2.1.3 酿酒酵母接种量对枸杞刺梨复合饮料α-淀粉抑制率和感官评分的影响
酿酒酵母接种量对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响见图3。

图3 酿酒酵母接种量对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响Fig.3 Effect of Saccharomyces cerevisiae inoculation amount on α-amylase inhibition rate and sensory score of Lycium barbarum and roxburgh rose compound beverage
由图3 可知,当酿酒酵母接种量为1%~4%时,α-淀粉酶抑制率和感官评分均随接种量的增加而升高;当接种量大于4%时,α-淀粉酶抑制率和感官评分随接种量的增加而降低。其原因可能是接种量过低时发酵能力差,接种量过多时发酵液中的养分有限,经过较短时间的生长繁殖后,菌种迅速进入衰亡期,造成大量菌种死亡,导致α-淀粉酶的抑制率和感官评分降低。因此,选择酿酒酵母接种量为3%~5%进行后续试验。
2.1.4 发酵温度对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响
发酵温度对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响见图4。

图4 发酵温度对枸杞刺梨复合饮料α-淀粉酶抑制率和感官评分的影响Fig.4 Effect of fermentation temperature on α-amylase inhibition rate and sensory score of Lycium barbarum and roxburgh rose compound beverage
由图4 可知,当发酵温度为31 ℃时,α-淀粉酶抑制率最高,这可能是因为在温度为31 ℃时,酵母菌的发酵效率高,对α-淀粉酶的抑制率也增高。另外,当发酵温度为28 ℃时,枸杞刺梨复合饮料拥有良好的风味,与31 ℃发酵条件下相比,其α-淀粉酶抑制率相差并不大。综合考量,选定发酵温度为28 ℃。
2.2 发酵工艺优化响应面试验
2.2.1 响应面试验设计及回归模型的建立
根据单因素试验结果,发酵温度对α-淀粉酶的影响不大,确定枸杞刺梨复合饮料的发酵温度为28 ℃,选取发酵时间(A)、酿酒酵母接种量(B)和刺梨汁与枸杞汁的体积比(C)进行三因素三水平的响应面优化试验,以α-淀粉酶抑制率(Y)作为响应值,采用Design Expert 8.0.5 软件和Box-Behnken 设计原理,优化枸杞刺梨复合饮料的发酵工艺。响应面设计见表3,方差分析见表4。

表3 Box-Behnken 试验设计及结果Table 3 Experiment design and results of Box-Behnken design

表4 中心组合试验设计的方差分析Table 4 Analysis of variance(ANOVA)for the quadratic model
对表3 的数据进行拟合分析,得到的回归方程为Y=51.78-1.53A+0.18B-0.75C-0.14AB-0.11AC+0.20BC-1.38A2-2.83B2-3.11C2。
从表4 中可知,模型的P<0.001,说明该模型极显著性,其中A、A2、B2、C2有极显著影响;C 有显著影响;交互项中AB、AC、BC 对α-淀粉酶抑制率无显著影响;模型失拟项不显著(P>0.05),R2=0.967 9,说明模型具有可行性;同时模型的调整决定系数R2Adj为0.926 6,说明模型能够解释试验92.66%的响应值变异,表明此试验模型与实际数据拟合程度好。根据F 值的大小,各单因素对试验结果影响的程度为发酵时间(A)>刺梨汁与枸杞汁体积比(C)>酿酒酵母接种量(B)。
2.2.2 发酵工艺各因素间交互作用
发酵工艺各因素间交互作用见图5。

图5 各因素交互作用的等高线和响应面Fig.5 Contour diagrams and surface diagrams for the interaction of factors
由图5 可知,酵母接种量和刺梨汁与枸杞汁体积比交互作用最强,与表4 方差分析结果较一致。响应面优化发酵最佳条件为发酵时间50.40 h、接种量4.04%、刺梨汁与枸杞汁体积比2.89∶1。在此条件下预测α-淀粉酶抑制率指数可以达到52.323 6%。为方便实际操作,取发酵时间50 h、刺梨汁与枸杞汁体积比3∶1、酵母菌接种量4%,进行验证试验。
按最佳发酵条件进行3 次平行验证发酵,枸杞刺梨复合发酵液对α-淀粉酶抑制率均值为(55.673±0.171)%,与预测值较为相近,因此运用响应面法优化枸杞刺梨复合汁发酵工艺的回归模型可行。
2.3 枸杞刺梨复合饮料单因素优化(发酵后复配)
按照前期得到的最佳发酵条件单独发酵枸杞汁和刺梨汁后,将刺梨汁与枸杞汁按体积比1∶3、1∶2、1∶1、2∶1、3∶1、4∶1 进行复配,检测不同体积比的枸杞刺梨复合饮料的α-淀粉酶抑制率,结果如图6 所示。

图6 发酵后复配的枸杞刺梨复合饮料对α-淀粉酶抑制率和感官评分的影响Fig.6 The α-amylase inhibition rate and sensory score in Lycium barbarum and roxburgh rose compound beverage after fermentation
由图6 可知,在刺梨汁与枸杞汁体积比为3∶1 时α-淀粉酶抑制率和感官评分最高,与发酵前复配的最佳比例一致,感官评分也没有明显的变化。但发酵后复配的枸杞刺梨复合饮料对α-淀粉酶抑制率(60.486%)要略高于发酵前复配对的枸杞刺梨复合饮料α-淀粉酶抑制率(55.673%)。
2.4 发酵前后风味变化
按照1.3.6.4 风味评价的评分标准枸杞刺梨复合发酵液的香气进行感官分析,结果见图7。

图7 枸杞刺梨复合饮料发酵前后感官雷达剖面图Fig.7 Sensory radar profile of Lycium barbarum and roxburgh rose compound beverage before and after fermentation
由图7 可知,与发酵前相比,发酵组中发酵前复配明显地提高了酒香,发酵后复配提高了花香、果香以及酒香。
2.5 枸杞刺梨复合饮料功能成分指标检测结果
枸杞刺梨复合饮料功能成分的测定见表5。

表5 枸杞刺梨复合饮料功能成分的测定Table 5 Determination of functional components in Lycium barbarum and roxburgh rose compound beverage mg/mL
由表5 可知,该枸杞刺梨复合饮料中含有丰富的功能性成分,如VC、总多酚、总黄酮、类胡萝卜素和多糖。这些成分均有助于人体的健康。
2.6 枸杞刺梨复合饮料α-葡萄糖苷酶抑制率测定
阿卡波糖对α-淀粉酶抑制率和α-葡萄糖苷酶抑制率如图8 所示。

图8 不同浓度阿卡波糖溶液对α-淀粉酶和α-葡萄糖苷酶的抑制率Fig.8 Inhibition rates of α-amylase and α-glucosaccharase in acarbose solutions with different concentrations
发酵前复配的复合饮料α-葡萄糖苷酶抑制率为(63.286±0.200)%,发酵后复配的复合饮料α-葡萄糖苷酶抑制率为(65.870±0.400)%,由图8 可知,枸杞刺梨复合饮料对α-葡萄糖苷酶的抑制率与60 μg/mL 阿卡波糖相当。
2.7 枸杞刺梨复合饮料氨基酸分析
枸杞刺梨复合饮料发酵前后游离氨基酸种类及含量变化如表6 所示。

表6 枸杞刺梨复合饮料发酵前后游离氨基酸成分变化Table 6 Changes in free amino acid components in Lycium barbarum and roxburgh rose compound beverage before and after fermentation g/100 g
从表6 可以看出,发酵前从枸杞刺梨复合饮料中检测出14 种游离氨基酸,发酵后的枸杞刺梨复合饮料检测到12 种游离氨基酸。异亮氨酸、亮氨酸、缬氨酸统称为支链氨基酸,可以通过促进胰岛素和生长激素释放这两种方式促进合成代谢[22],也是参与肝脏代谢的重要营养物质之一。在发酵前复配的饮料中,支链氨基酸由0.0148 g/100 g 增加到了0.0245 g /100 g。呈味氨基酸谷氨酸、酪氨酸含量的提高也有助于增加饮品风味,使饮品酸甜适口,口感醇厚[23]。赖氨酸为第一限制性氨基酸,经发酵后复配的复合饮料赖氨酸含量的增加,提高了枸杞刺梨复合饮料的营养价值。苏氨酸为第二限制性氨基酸,经发酵后略微有所下降但仍能保持一定的含量。
在发酵前和发酵后的复合饮料中,胱氨酸的含量均是最高的。由发酵前0.085 5 g/100 g 增加到发酵后(发酵前复配)0.126 7 g/100 g 和发酵后(发酵后复配)0.093 5 g/100 g。胱氨酸是由两分子半胱氨酸经氧化得到的氨基酸,是一种含硫基氨基酸。胱氨酸能够辅助人体胰岛素的供给,对控制血糖平衡有着关键作用[24]。
3 结论
本研究以枸杞原浆、刺梨粉为原料,通过单因素和响应面试验对刺梨汁与枸杞汁的体积比、发酵时间及酿酒酵母接种量3 个因素对枸杞刺梨复合饮料考察α-淀粉酶抑制率的影响。试验证明当刺梨粉与水的料液比为1∶15(g/mL)、枸杞原浆与水的体积比为7∶3,二者体积比为3∶1,发酵时间50 h,酿酒酵母接种量4%,发酵温度28 ℃为基础发酵条件,得到的枸杞刺梨发酵液对α-淀粉酶抑制率为55.673%,且与70 μg/mL 浓度的阿卡波糖的抑制率相当。发酵前复配的枸杞刺梨复合饮料经过酿酒酵母菌(BYBC-GQZ)发酵后香气更浓郁,色泽均匀透亮,经过发酵之后的枸杞刺梨复合饮料色泽金黄,气味浓郁,具有枸杞和刺梨的复合香味,口味纯正,酸甜爽口。
该枸杞刺梨复合饮料含有丰富的功能成分,且枸杞刺梨复合饮料的氨基酸含量检测,结果显示支链氨基酸有了明显的提高,胱氨酸也由发酵前0.085 5 g/100 g 增加到发酵后(发酵前复配)0.126 7 g/100 g 和发酵后(发酵后复配)0.093 5 g/100 g,胱氨酸能辅助人体胰岛素的供给,对控制血糖平衡有重大作用。本研究可为功能复合饮料的工业化生产提供参数,并为推动相关降血糖产品的开发提供依据,具有良好的市场开发前景。
