发酵紫苏粕制备抗氧化肽的工艺优化及抗氧化性
2023-09-19陈林林王玲郑凤鸣张海鹏郝熙辛嘉英
陈林林,王玲,郑凤鸣,张海鹏,郝熙,辛嘉英,2
(1.哈尔滨商业大学 食品工程学院,黑龙江 哈尔滨 150028;2.中国科学院 兰州化学物理研究所 羰基合成与选择氧化国家重点实验室,甘肃 兰州 730000)
抗氧化肽由动植物酶促水解、分离和提取获得,可以抑制生物聚合物的过氧化或在体内消除自由基,具有一定的抗氧化能力[1]。抗氧化肽的作用机制是能够直接作用于自由基,阻止其发生反应;还可以吸收能够产生自由基的物质,减少体内自由基的含量。机体抵抗氧化的能力越强,患相关疾病的可能性就越小。对抗氧化肽的深入研究使其在功能性产品、食品添加剂、化妆品、制药和其他行业中的应用日益广泛[2-4]。以植物蛋白作为原料制得的抗氧化肽,具有抗氧化、提高免疫力、延缓衰老、抗高血压等生理功能,如今抗氧化肽已经成为国内外研究热点。近年来,活性肽大多采用酶解法制成,通过酶解法从植物蛋白中制备的生物活性肽不仅活性高,而且无毒副作用[5-7]。杨雪等[8]将豌豆蛋白以碱性蛋白酶酶解,通过测定豌豆蛋白酶液对自由基的清除率,制备出具有强抗氧化活性的豌豆活性肽。
紫苏在我国已有近2 000 年的种植和使用历史,是一种一年生传统草本植物,可以食用或入药。紫苏饼粕是紫苏籽脱脂后的副产物,与其他油料脱脂后的饼粕相比,紫苏饼粕是一种蛋白含量丰富、杂质少,含有丰富的必需氨基酸、功效比值、净蛋白比值、消化率高的优质植物蛋白资源[9]。胡博路等[10]研究表明,紫苏叶具有很强的清除超氧阴离子自由基和羟基自由基能力。
本文以紫苏粕为原料,利用酵母菌对其发酵提高蛋白质含量,对发酵紫苏粕中的蛋白进行提取并通过单因素与响应面试验优化其发酵条件;利用蛋白酶对发酵后紫苏粕进行水解,制备紫苏粕抗氧化肽,并以1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟基自由基、2,2'-联偶氮双(3-乙基苯并噻唑啉-6-磺酸)[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid),ABTS]阳离子自由基、超氧阴离子自由基的清除率,及铁离子还原抗氧化能力(ferric reducing antioxidant power,FRAP) 等为指标,来探究酶种类和酶用量对发酵后紫苏粕抗氧化肽活性的影响。以期为紫苏加工副产品的高值利用和抗氧化肽的开发提供依据。
1 材料与方法
1.1 材料与试剂
紫苏粕:黑龙江省桦南农盛园食品有限公司;酵母菌(Saccharomyces cerevisiae)131 保存于哈尔滨商业大学食品工程学院发酵与生物催化实验室;邻苯三酚(焦性没食子酸)、抗坏血酸:天津市兴复精细化工研究所;三羟甲基氨基甲烷(trometamol,Tris)、ABTS、2,4,6-三吡啶基三嗪[2,4,6-tris (2-pyridyl)-s-triazine,TPTZ]:萨恩化学技术有限公司;DPPH:日本东京化成工业株式会社;麦芽汁培养基、碱性蛋白酶(200 U/mg)、胰蛋白酶(250 U/mg):上海源叶生物科技有限公司,所用试剂均为分析纯。
1.2 仪器与设备
UV 5100B 型紫外可见分光光度计、HZP-D 恒温振荡箱:上海元析仪器有限公司;DHG-9070A 型电热恒温鼓风干燥箱、LDZX-50KB 立式高压蒸汽灭菌箱:上海一恒科技有限公司。
1.3 方法
1.3.1 脱脂紫苏粕的发酵
1.3.1.1 紫苏粕脱脂
称取一定量的紫苏粕粉,按1∶3(g/mL)比例加入30~60 ℃沸程的石油醚搅拌浸提30 min,过滤后弃去上层油脂清液,多次重复,直至最后石油醚为无色。滤渣在80 ℃烘箱中干燥,4 ℃冰箱保存。
1.3.1.2 菌种的活化
称取13 g 麦芽汁培养基,加热溶解在100 mL 无菌水中,装于锥形瓶中,在121 ℃、1.01 kPa 的条件下灭菌15 min 后取出培养基置于无菌台,冷却后在培养基中加入0.5 g 酵母,在恒温摇床(37 ℃、120 r/min)中培养24 h 后,用无菌水冲洗,将冲洗后的孢子倒入锥形瓶中,采用无菌纱布过滤,制备成孢子悬浮液。最后用血球计数板计数后,将孢子悬浮液的浓度调整为2×106~5×106CFU/mL,置于冰箱中4 ℃保存备用。
1.3.1.3 固态发酵紫苏粕
在250 mL 锥形瓶中加入一定量的脱脂紫苏粕,加入适量无菌水混匀,密封后灭菌(121 ℃,20 min),将孢子悬浮液倒入超净工作台上的锥形瓶中混匀发酵。发酵后灭菌(121 ℃,10 min)、干燥(50 ℃,48 h),得到紫苏粕抗氧化肽粗提物。研磨后,密封并储存在4 ℃冰箱。
1.3.2 脱脂紫苏粕发酵单因素试验
1.3.2.1 pH 值对发酵紫苏粕蛋白质含量的影响
分别准确称取25 g 发酵紫苏粕置于灭菌后的锥形瓶中,按3.0∶1(mL/g)的液料比加入75 mL 无菌水,酵母菌接菌量为3.2%,调节溶液pH 值分别为2.5、3.0、3.5、4.0、4.5、5.0。将5 组样品置于恒温振荡箱在37 ℃下发酵24 h。考察不同pH 值对发酵液中蛋白质含量的影响。
1.3.2.2 接菌量对发酵紫苏粕蛋白质含量的影响
分别准确称取25 g 发酵紫苏粕置于灭菌后的锥形瓶中,按3.0∶1(mL/g)的液料比向每组加入75 mL 无菌水,调节溶液pH 值为3.0,加入酵母菌液混匀,接菌量为4%、8%、12%、16%、20%(酵母菌菌液加入量与发酵紫苏粕质量分数),将5 组样品置于恒温振荡箱在37 ℃下发酵24 h。考察不同接菌量对蛋白质含量的影响。
1.3.2.3 液料比对发酵紫苏粕蛋白质含量的影响
分别准确称取25 g 发酵紫苏粕置于灭菌后的锥形瓶中,酵母菌接菌量为3.2%,各加入25、50、75、100、125 mL 无菌水,混匀,调节溶液pH 值为3.0。将5 组样品置于恒温振荡箱在37 ℃下发酵24 h。考马斯亮蓝法测发酵液中蛋白质含量,考察不同液料比对蛋白质含量的影响。
1.3.2.4 发酵时间对发酵紫苏粕蛋白质含量的影响
分别准确称取25 g 发酵紫苏粕置于灭菌后的锥形瓶中,按3.0∶1(mL/g)的液料比向每组加入75 mL 无菌水,酵母菌接菌量为3.2%,调节溶液pH 值为3.0,将5 组样品置于恒温振荡箱在37 ℃下发酵6、12、18、24、30、36、42、48 h。考马斯亮蓝法测发酵液中蛋白质含量,考察不同发酵时间对蛋白质含量的影响。
1.3.3 脱脂紫苏粕发酵响应面试验
选取pH 值(A)、液料比(B)、接菌量(C)3 个反应条件进行单因素优化试验,每组试验进行3 次平行试验。在此基础上,确定工艺条件的优选试验范围,采用Design-Expert 8.0 响应面分析法对工艺条件进行优化。因素与水平见表1。
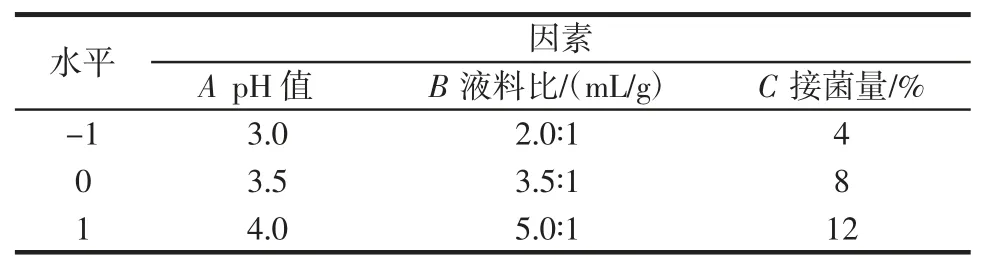
表1 响应面试验因素与水平Table1 Factors and levels of response surface methodology
1.3.4 紫苏蛋白的提取
参考Zhao 等[11]的方法略作改动,首先进行碱溶处理,准确称取20.0 g 发酵紫苏粕,按液料比10∶1(mL/g)加入一定量蒸馏水,调节反应体系的pH 值至9.0,50 ℃恒温水浴,充分浸泡1 h 后,进行离心(3 000 r/min,15 min),保留上清液。将上清液的pH 值调整至4.4,静置10 min 后,使蛋白酸沉。将上清液于3 000 r/min 离心15 min,将离心分离得到的沉淀物以1∶2 质量比溶解,溶液用浓度1.0 mol/L 的NaOH 溶液调pH 值为7.0后,冷冻干燥,得到发酵紫苏粕分离蛋白。
1.3.5 蛋白质含量的测定
参考Cheng 等[12]的方法,准确称取考马斯亮蓝粉末0.10 g,于50 mL 乙醇(95%)中溶解,加入100 mL 磷酸(85%),用蒸馏水定容至1 000 mL,过滤后收集滤液,得到考马斯亮蓝溶液。以标准蛋白质浓度为横坐标X,吸光度A595nm为纵坐标Y,绘制蛋白质浓度标准曲线,计算发酵紫苏粕中的蛋白质含量。回归方程为Y=0.780 7X-0.039,R2=0.991 8,在浓度范围为0~1.0 mg/mL内,蛋白质浓度与A595nm之间具有良好的线性关系,可用于待测样品中蛋白质浓度的计算。
1.3.6 抗氧化肽的制备与条件优化
参考Hashimoto 等[13]的方法,取5.0 g 的发酵紫苏粕于锥形瓶中,加入100 mL 蒸馏水,超声处理20 min,调节pH 值,分别加入碱性蛋白酶(200 U/mg)和胰蛋白酶(250 U/mg),酶加入量分别为1%(160 U/g)、3%(480 U/g)、5%(800 U/g)、7%(1 120 U/g)和9%(1 440 U/g)。在40 ℃水浴恒温振荡器中酶解4 h,灭酶处理15 min,真空抽滤后收集滤液。加入无水乙醇(V滤液∶V无水乙醇=1∶2),静置沉淀12 h,除去上清液,将沉淀物冻干,备用。
1.3.7 发酵紫苏粕抗氧化肽活性的测定
1.3.7.1 DPPH 自由基清除能力的测定
参照Chen 等[14]方法略有改动。用无水乙醇配制浓度为2×10-4mol/L 的DPPH 溶液,将其与紫苏蛋白酶解液以体积比1∶1 均匀混合,于室温下避光反应30 min后,在波长517 nm 处测量溶液的吸光度A。同时,以无水乙醇为参照物,用去离子水和抗坏血酸替代酶解紫苏蛋白溶液,按相同的操作方法测定A517nm。并以此作为空白对照和阳性对照。根据下述公式计算DPPH 自由基清除率(D,%)。
式中:A1为酶解紫苏蛋白溶液+DPPH 乙醇溶液的吸光度;A2为酶解紫苏蛋白溶液+乙醇溶液的吸光度;A0为乙醇液+DPPH 乙醇溶液的吸光度。
1.3.7.2 超氧阴离子自由基清除能力的测定
参照Siswoyo 等[15]方法略有改动。配制酶解紫苏蛋白溶液和Tris-HCl 混合溶液(50 mmol/L,pH8.2),25 ℃下恒温水浴20 min,取出后立即加入温度为25 ℃的0.2 mL 7 mmol/L 邻苯三酚溶液,将混合溶液定容至10 mL。待反应启动后1 min 开始计时,在波长325 nm处,每间隔30 s 测定一次吸光度A,共记录吸光度6 次。以时间(t)为横坐标,A325nm为纵坐标,标准曲线的斜率就是邻苯三酚自氧化速率。用去离子水和抗坏血酸替代酶解紫苏蛋白溶液,按相同的操作方法测定A325nm。并以此作为空白对照和阳性对照。根据下述公式计算超氧阴离子自由基清除率(F,%)。
式中:A0为去离子水和抗坏血酸的邻苯三酚氧化速率计算吸光度曲线的斜率;As为酶解紫苏蛋白溶液的邻苯三酚氧化速率计算吸光度曲线的斜率。
1.3.7.3 ABTS+自由基清除能力的测定
参考Lin 等[16]的方法略有改动。按照体积比1∶1 将过硫酸钾溶液(2.45 mmol/L)与ABTS 溶液(7 mmol/L)均匀混合,室温下避光反应15 h。用磷酸缓冲液(0.01 mol/L,pH7.4) 将ABTS 溶液稀释,直至734 nm处吸光度为0.70,制得ABTS 反应液。取1 mL 酶解紫苏蛋白溶液和5 mL ABTS 反应液,振荡摇匀,于室温下静置10 min 后在734 nm 处测其吸光度A,用去离子水和抗坏血酸替代酶解紫苏蛋白溶液,按相同的操作方法测定A734nm。并以此作为空白对照和阳性对照。根据下述公式计算ABTS+自由基清除率(A,%)。
式中:A734nm为去离子水和抗坏血酸在734 nm 处测其吸光度;A 为酶解紫苏蛋白溶液在734 nm 处测其吸光度。
1.3.7.4 羟基自由基清除能力的测定
将酶解紫苏粕蛋白溶液、FeSO4溶液(9 mmol/L)和水杨酸乙醇溶液(9 mmol/L)以体积比1∶1∶1 混合,然后加入相同体积的H2O2溶液(8.8 mmol/L)。37 ℃恒温水浴30 min 后离心(5 000 r/min,10 min)。在波长520 nm处,测量上清液的吸光度A[17-18]。用去离子水和抗坏血酸代替酶解紫苏蛋白溶液,按相同的操作方法测定A520nm。并以此作为空白对照和阳性对照。根据下述公式计算羟基自由基清除率(N,%)。
式中:A520nm为去离子水和抗坏血酸在520 nm 处测其吸光度;A 为酶解紫苏蛋白溶液在520 nm 处测其吸光度。
1.3.7.5 FRAP 总抗氧化能力的测定
参考Hetharia 等[19]的方法,略有改动。准确称取0.51 g 乙酸钠,加2 mL 冰醋酸,定容至25 mL;准确称取0.078 1 g TPTZ 粉末,加83 μL 浓盐酸,并用蒸馏水定容至25 mL;精确称取0.162 g FeCl3,用30 mL 蒸馏水溶解并摇匀。将上述步骤中制备的溶液以10∶1∶1 的体积比混合,制成FRAP 工作液。准确量取1 mL 酶解紫苏粕蛋白溶液至比色管中,加入制备的工作液6 mL,摇匀,37 ℃恒温水浴加热10 min 后,在波长为593 nm,测量溶液的吸光度,吸光度越大,表示总还原能力就越强。
2 结果与分析
2.1 发酵条件对紫苏粕蛋白质含量影响的单因素试验
2.1.1 pH 值对发酵紫苏粕蛋白质含量的影响
pH 值对发酵紫苏粕蛋白质含量的影响如图1 所示。
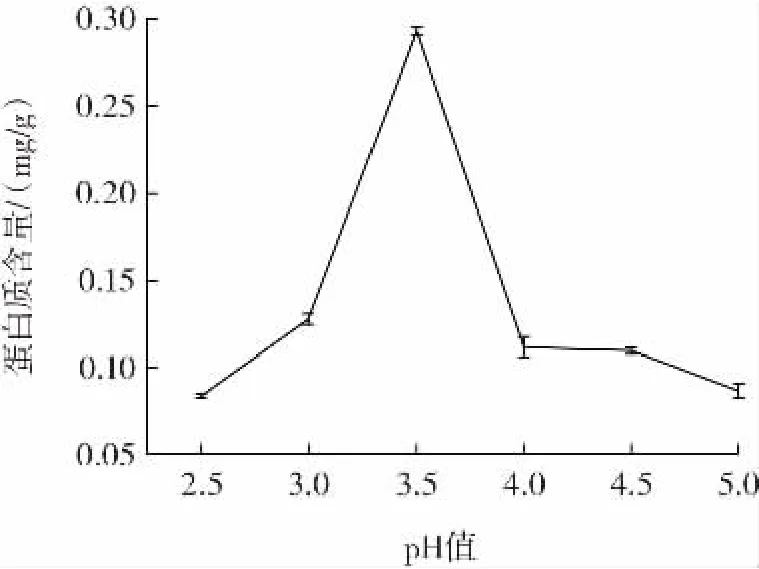
图1 pH 值对发酵紫苏粕蛋白质含量的影响Fig.1 Effect of pH value on protein content of fermented perilla meal
由图1 可知,pH 值从3.0 变化到3.5 时,发酵紫苏粕蛋白质含量增加,达到0.293 mg/g。当pH 值继续增加至4.0 时发酵紫苏粕蛋白质含量又急剧下降,pH 值对发酵紫苏粕蛋白质含量产生影响的原因可能是pH值的改变影响酵母菌的活性[20],当pH 值为3.5 时,发酵紫苏粕蛋白质含量最高,因此选择pH 值为3.5 进行后续试验。
2.1.2 接菌量对发酵紫苏粕蛋白质含量的影响
接菌量对发酵紫苏粕蛋白质含量的影响如图2所示。
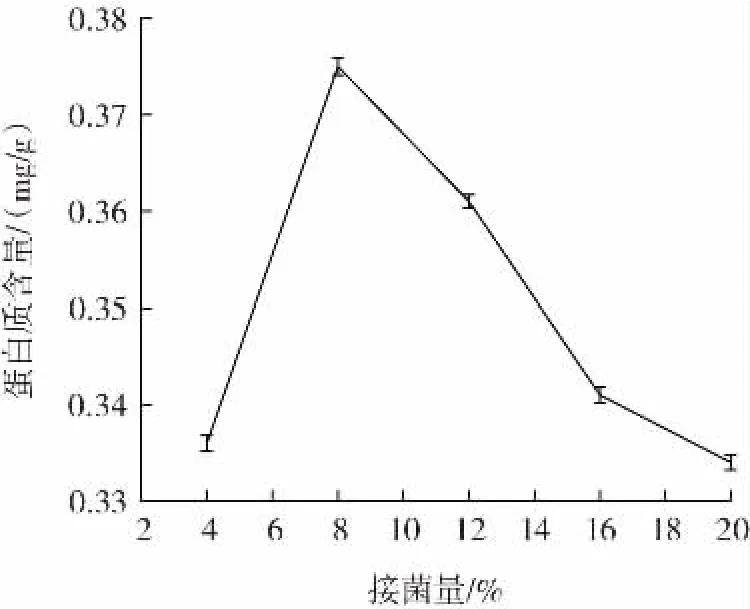
图2 接菌量对发酵紫苏粕蛋白质含量的影响Fig.2 Effect of inoculation amount on protein content of fermented perilla meal
由图2 可以看出,一定范围内,蛋白质含量随着接菌量的增加而提高,当接菌量为8%时,所产生的蛋白质含量达到最高值(0.375 mg/g),随着接菌量的继续增加,蛋白质含量开始下降,且接菌量对蛋白含量产生影响的原因可能是反应体系中微生物过多,大量聚集在紫苏粕表面,降低了代谢速度,影响发酵效果,因此选择接菌量为8%进行后续试验。
2.1.3 液料比对发酵紫苏粕蛋白质含量的影响
液料比对发酵紫苏粕蛋白质含量的影响如图3 所示。
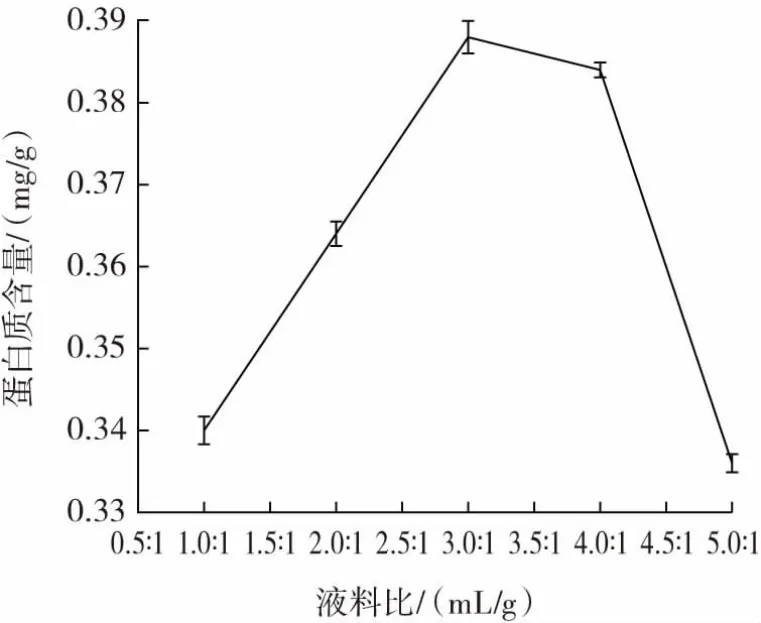
图3 液料比对发酵紫苏粕蛋白质含量的影响Fig.3 Effect of liquid to material ratio on protein content of fermented perilla meal
从图3 可以看出,随着液料比的增加,蛋白质含量明显增加。液料比为3.0∶1(mL/g)时,达到最大值。随着液料比值的进一步增加,蛋白质含量开始下降,当液料比超过4.0∶1(mL/g)时,蛋白质含量迅速下降。这可能是因为反应系统中的水分含量过高,反应溶液被过度稀释,各种营养素的浓度降低,导致微生物代谢减慢,从而影响蛋白质的含量[21]。因此选择液料比3.0∶1(mL/g)进行后续试验。
2.1.4 发酵时间对发酵紫苏粕蛋白质含量的影响
发酵时间对发酵紫苏粕蛋白质含量的影响如图4所示。
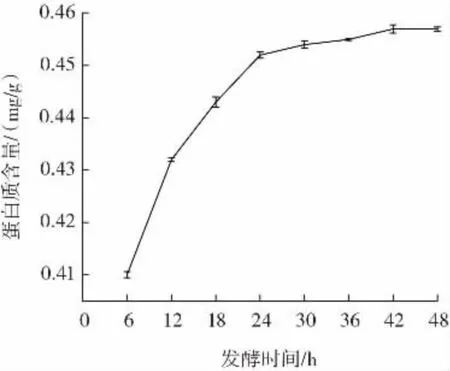
图4 发酵时间对发酵紫苏粕蛋白质含量的影响Fig.4 Effect of fermentation time on protein content of fermented perilla meal
由图4 可以看出,当发酵时间在6~24 h 范围内时,紫苏粕蛋白质含量呈上升状态可能是因为酵母菌可以将其含有复杂的蛋白质分解成更简单、更容易消化的形式,从而增加了紫苏粕蛋白质含量,24~48 h 趋于平缓,这可能是因为营养来源被耗尽,紫苏粕蛋白质含量缓慢增长。选取24 h 为发酵时间,与郑温翔等[22]研究结果一致。
2.2 脱脂紫苏粕发酵最佳工艺条件的确定
2.2.1 试验设计方案及结果
通过中心组合设计法设计响应面试验,优化紫苏发酵工艺,响应面设计及结果如表2 所示。
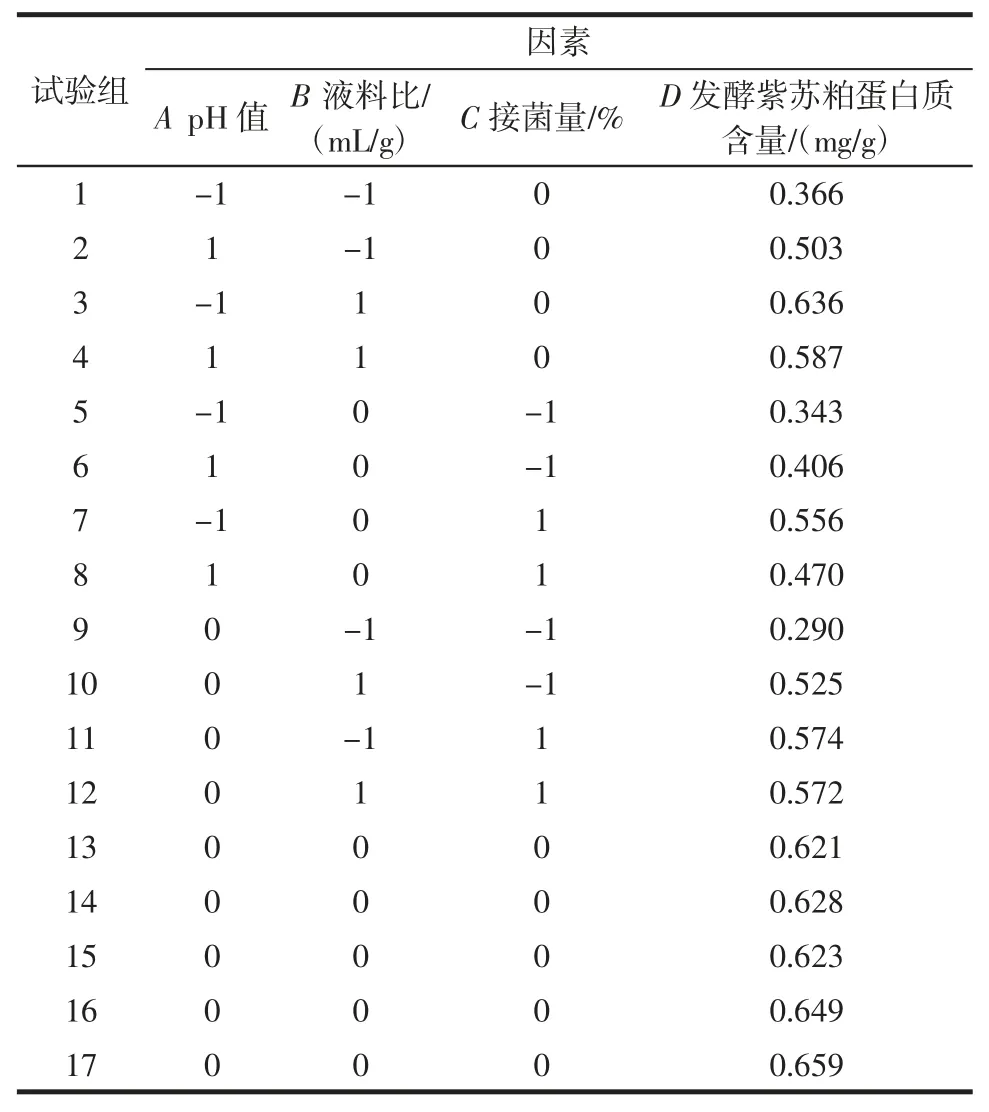
表2 响应面试验设计与结果Table 2 Response surface test design and results
2.2.2 模型的建立及显著性分析
利用Design-Expert 8.0 软件对表2 数据进行多元回归拟合,得到发酵紫苏粕蛋白质含量(Y)、pH 值(A)、液料比(B)、接菌量(C)的二次多项回归模型方程:Y=0.64+8.125×10-3A+0.073B+0.076C-0.047AB-0.037AC-0.059BC-0.080A2-0.056 33-0.11C2。
方差分析结果如表3 所示。
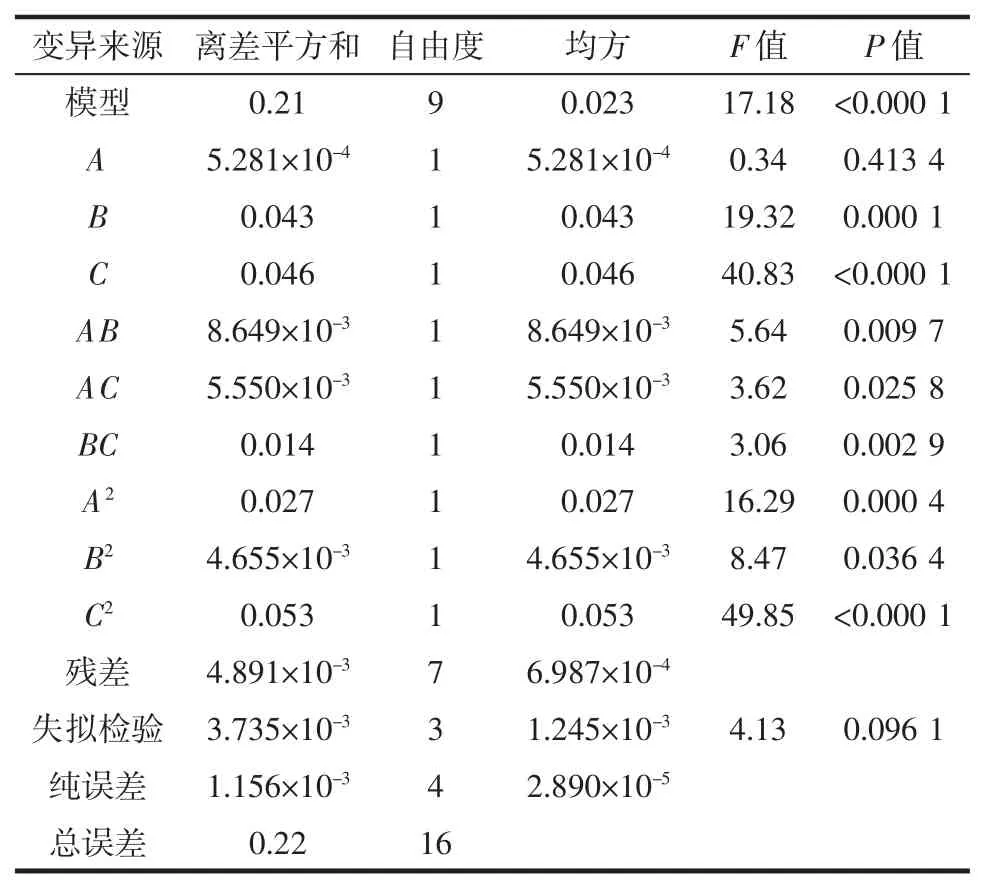
表3 方差分析结果Table 3 Variance analysis results
从表3 可以看出,整体模型水平极显著(P<0.01),失拟项不显著(P>0.05),R2=0.977 3,R2adj=0.948 1,表明该方程具有较高的拟合度。根据方差分析结果显示A不显著,B、C、AB、AC、BC 均显著(P<0.05),表明各因素间具有明显的交互作用。方差分析结果显示,3 种因素对结果的影响大小关系为接菌量(C)>液料比(B)>pH 值(A)。
2.2.3 因素交互作用的影响
pH 值与接菌量、液料比与接菌量和pH 值与液料比的交互作用如图5~图7 所示。
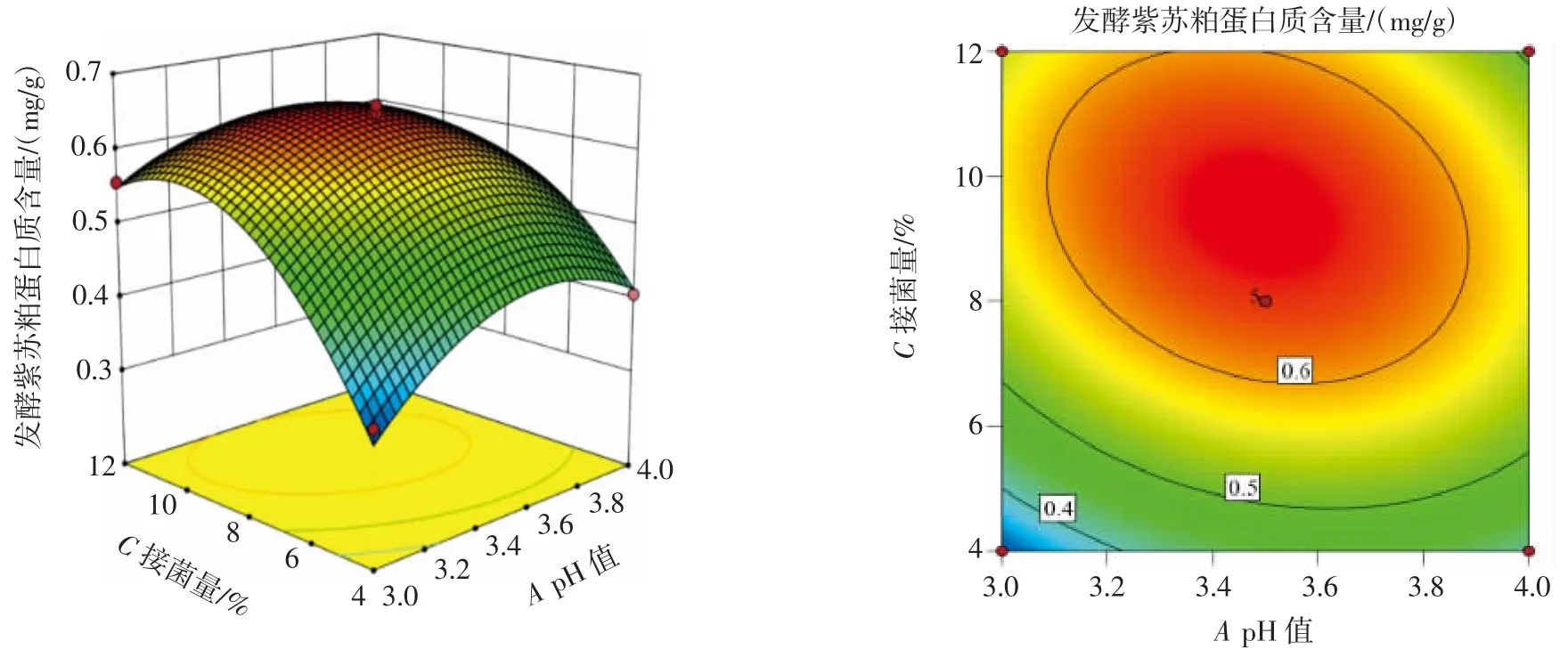
图5 pH 值与接菌量的交互作用Fig.5 Interaction between pH value and inoculation amount
根据回归方程,为了检验各因素之间的相关性,对结果进行了响应面分析,如图5、6 和7 所示。图中响应面和等高线形状的变化更直接地反映了pH 值、液料比和接菌量对蛋白质含量的影响。在响应面图中,曲面越陡,凸起越大,表明所分析的两个因素之间的相互作用与对响应值的影响呈正相关。在等高线图中,等高线形状越接近椭圆,表明所分析的因素之间就有越显著的相互作用。
从图5 可以看出,保持pH 值不变,随着接菌量的增加,蛋白质含量先增加后降低。从等高线的形状可以看出,pH 值和接菌量之间的相互作用对响应值有显著影响。从图6 可以看出,当液料比保持不变,接菌量增加时,蛋白质含量先增加后降低。从等高线的形状可以看出,液料比和接菌量之间的相互作用对响应值有显著影响。从图7 可以看出,当pH 值保持不变,液料比增大时,蛋白质含量先增加后降低。从等高线形状可以看出,pH 值和液料比之间的相互作用对响应值有显著影响。
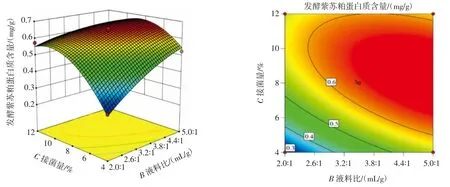
图6 液料比与接菌量的交互作用Fig.6 Interaction between liquid - solid ratio and inoculation amount
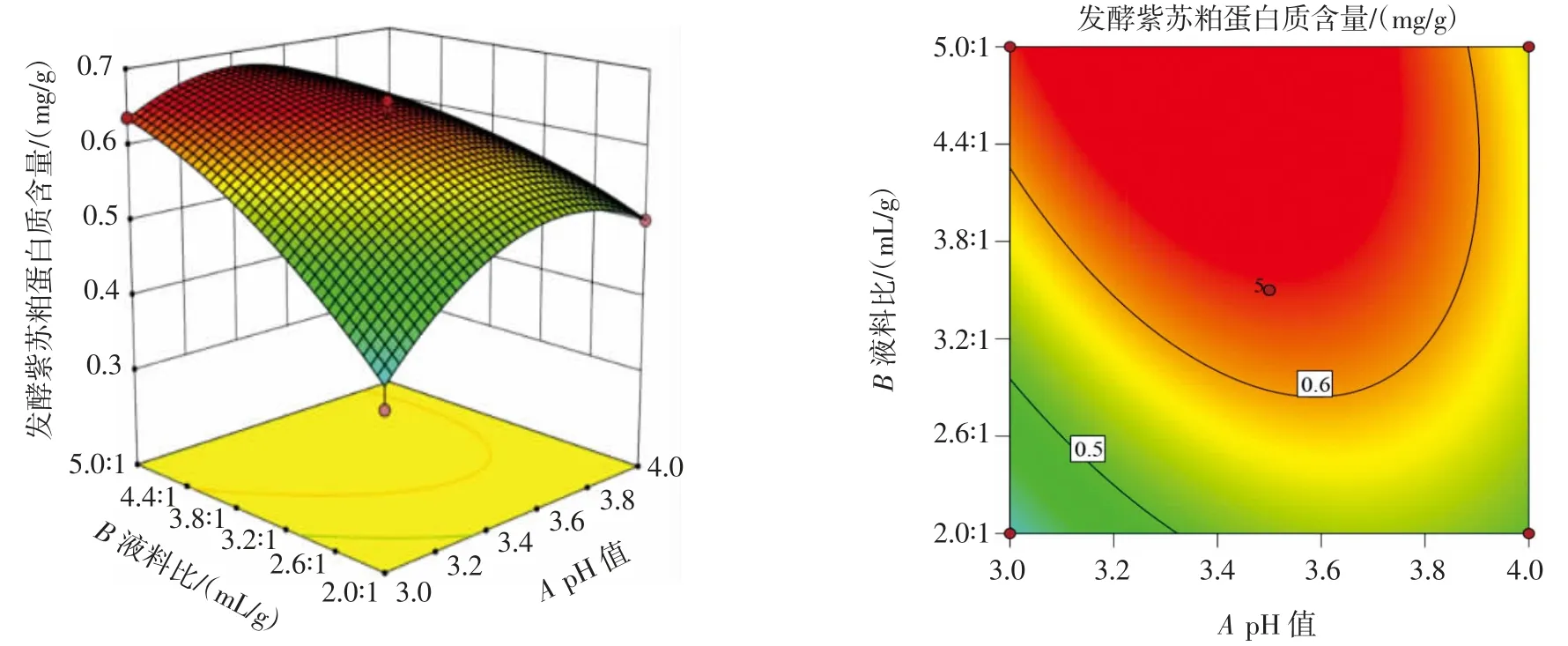
图7 pH 值与液料比的交互作用Fig.7 Interaction between pH and liquid-solid ratio
2.2.4 最优工艺参数
采用Design-Expert 8.0 软件进行分析并求解二次多元回归模型,得到的最佳发酵工艺条件为pH3.37、液料比5.0∶1(mL/g)、接菌量为8.48%,蛋白质理论含量0.683 mg/g。通过对实际可操作性的考虑,将优化条件调整为pH3.4、液料比5.0∶1(mL/g)、接菌量8.5%。在此条件下进行3 次重复试验,得到蛋白质含量的平均值为0.679 mg/g,与理论值相比,其相对误差约为0.59%<5%,说明响应面法对发酵条件的优化可靠。
2.3 不同酶解条件对发酵紫苏粕制备抗氧化肽活性的影响
2.3.1 酶种类与酶用量对DPPH 自由基清除能力的影响
在其他条件相同的情况下,改变酶的种类与酶的用量,考察其对DPPH 自由基清除能力的影响,结果如图8 所示。
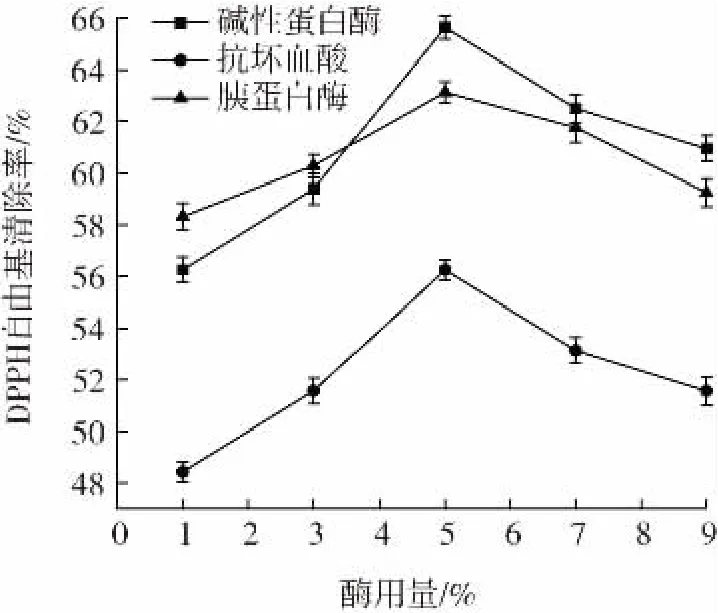
图8 不同酶解条件对DPPH 自由基清除能力的影响Fig.8 Effect of different enzymatic hydrolysis conditions on scavenging ability of DPPH
酶用量为1%~9%时,碱性蛋白酶组、抗坏血酸组和胰蛋白酶组对DPPH 自由基的清除率均呈现先上升后下降的趋势,碱性蛋白酶组和胰蛋白酶组对DPPH自由基清除效果优于抗坏血酸组。酶用量在5%时达到最高值,清除率分别为65.63%、63.13%、56.26%。这是由于蛋白酶与蛋白质分子中肽键的接触概率会随着酶用量的增加而增加,但当酶量超过一定值时,酶与蛋白的接触趋于饱和状态,因此,清除率会随着酶用量的增加而降低[23]。
2.3.2 酶种类与酶用量对超氧阴离子自由基清除能力的影响
在其他条件相同的情况下,改变酶的种类与酶用量,考察其对超氧阴离子自由基清除能力的影响,结果如图9 所示。
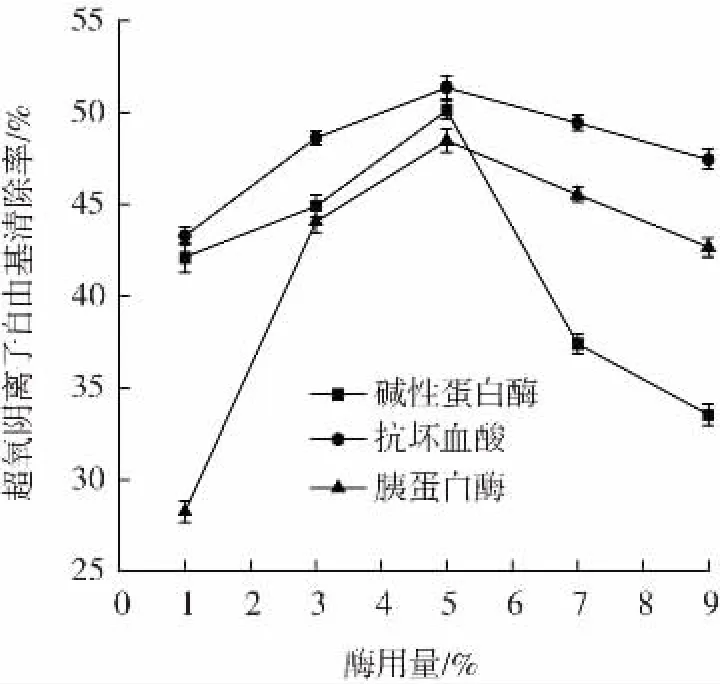
图9 不同酶解条件对超氧阴离子自由基清除能力的影响Fig.9 Effect of different enzymatic hydrolysis conditions on scavenging ability of superoxide anion radical
酶用量为1%~3%时,胰蛋白酶组的清除率急速上升,碱性蛋白酶组上升较为平缓。在酶用量5%~9%范围内,各组样品的清除率都呈下降趋势,酶用量为5%时清除能力均达到最高,碱性蛋白酶组的清除率为50.14%,而胰蛋白酶组略低,清除率为48.48%。胡学智等[24]研究表明,在同样的条件下,碱性蛋白酶酶解液与胰蛋白酶酶解液对超氧阴离子的清除力度表现出较大差异,是由不同酶对底物蛋白质的特异性选择导致的。
2.3.3 酶种类与酶用量对ABTS+自由基清除能力的影响
在其他条件相同的情况下,改变酶的种类与酶的用量,考察其对ABTS+自由基清除能力的影响,结果如图10 所示。
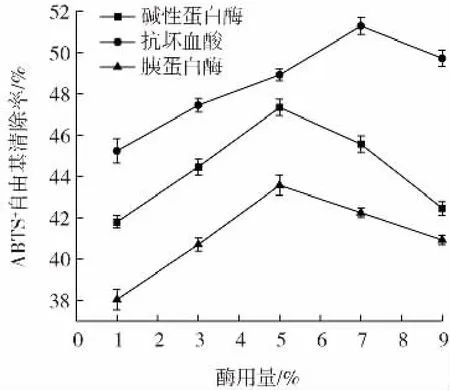
图10 不同酶解条件对ABTS+自由基清除能力的影响Fig.10 Effects of different enzymatic hydrolysis conditions on scavenging ability of ABTS+ free radicals
酶用量为1%~9%时,3 组样品均呈现先上升后下降的趋势。碱性蛋白酶组和胰蛋白酶组的ABTS+自由基清除率都在酶用量为5%时达到最大,分别为47.35%、43.58%。与碱性蛋白酶组和胰蛋白酶组相比,抗坏血酸组对ABTS+自由基的清除能力更强。张文敏等[25]研究说明,在酶用量及其他反应条件相同的条件下,胰蛋白酶酶解液对ABTS+自由基的清除能力低于碱性蛋白酶,与试验结果一致。
2.3.4 酶种类与酶用量对羟基自由基清除能力的影响在其他条件相同的情况下,改变酶的种类与酶的用量,考察其对羟基自由基清除能力的影响,结果如图11 所示。
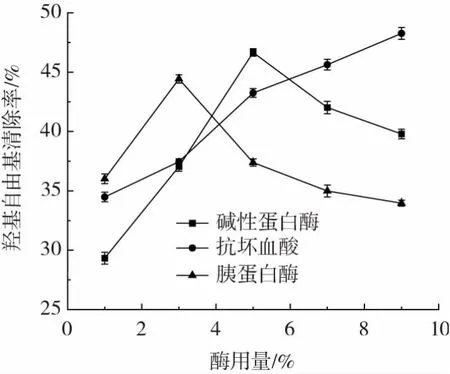
图11 不同酶解条件对羟基自由基清除能力的影响Fig.11 Effect of different enzymatic hydrolysis conditions on scavenging ability of hydroxyl radical
酶用量为1%~5%时,碱性蛋白酶组和抗坏血酸组对羟基自由基的清除率呈现上升趋势,胰蛋白酶组呈先上升后下降的趋势。当酶用量超过5%时,碱性蛋白酶组和胰蛋白酶组抗氧化能力均呈现下降趋势,而抗坏血酸的抗氧化能力呈缓慢上升的状态。当酶加入量为5%时,碱性蛋白酶对羟基自由基的清除率最高,达45.63%,清除效果最好。张文敏等[25]的研究结果表明,在同等酶用量的条件下,碱性蛋白酶酶解液对羟基自由基的清除能力优于胰蛋白酶酶解液,与本试验结论相吻合。
2.3.5 酶种类与酶用量对FRAP 总抗氧化能力的影响
在其他条件相同的情况下,改变酶的种类与酶的用量,考察其对FRAP 总抗氧化能力的影响,结果如图12 所示。
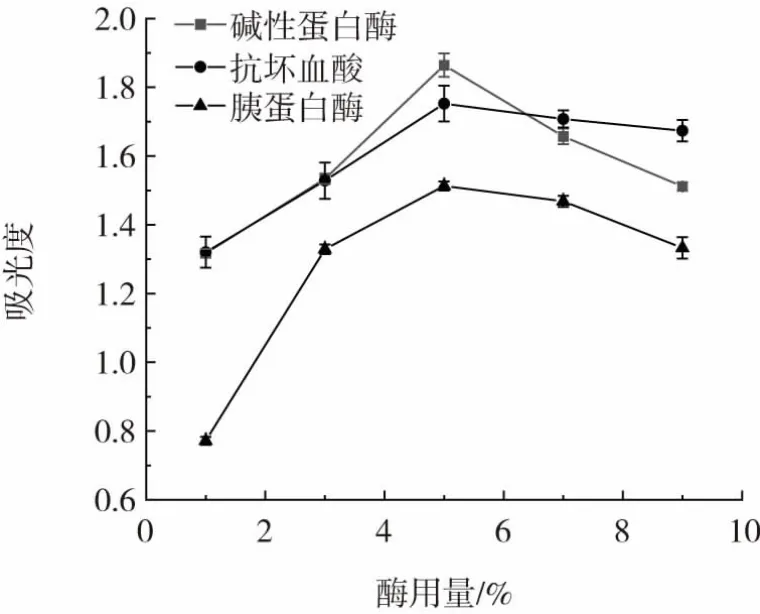
图12 不同酶解条件对FRAP 总抗氧化能力的影响Fig.12 Effects of different enzymatic hydrolysis conditions on total antioxidant capacity of FRAP
酶用量为1%~9%时,3 组样品均呈现先上升后下降的趋势,这与Zhang 等[26]研究结果一致。在酶用量1%~5%范围内,碱性蛋白酶组与胰蛋白酶组的抗氧化能力均低于抗坏血酸组。当酶用量高于5%,碱性蛋白酶组对FRAP 总抗氧化能力反而高于抗坏血酸组。
3 结论
通过单因素和响应曲面法对紫苏粕发酵工艺条件进行优化,得到最佳发酵工艺为pH3.4、液料比5.0∶1(mL/g)、及接菌量8.5%(质量分数),在此条件下蛋白质实际含量0.679 mg/g。试验中3 个因素间的相关程度较高。因素影响的大小顺序为接菌量>液料比>pH 值。以最优条件下发酵后的紫苏粕通过酶解制备抗氧化肽,当碱性蛋白酶的用量在5%(800 U/g)时,发酵紫苏粕酶解液的抗氧化活性呈现最佳,酶解液对DPPH 自由基、超氧阴离子自由基、ABTS+自由基、羟基自由基的清除率分别可达65.63%、50.14%、47.35%、45.63%。为紫苏加工副产物利用和抗氧化肽的开发提供理论参考。
