不同剂量EGCG 改善代谢综合征的效果及其机制
2023-09-19马慧王津额日赫木魏嘉宇王硕
马慧,王津,额日赫木,魏嘉宇,王硕*
(1. 山西师范大学 食品科学学院,山西 太原 030031;2. 南开大学医学院 天津市食品科学与健康重点实验室,天津 300350)
代谢综合征表现为肥胖、高血压、血脂异常、胰岛素抵抗和高血糖中至少3 个以上特征,其发生会增加个体罹患2 型糖尿病和心血管疾病的风险[1-2]。由于代谢综合征病理的复杂性,很难设计一种有效预防或延缓代谢综合征的特效药,通常采用靶向一种病症的单一药物或靶向多种病症的药物组合进行治疗,这些药物包括他汀类药物和降血糖药物等[3]。近年来,食用和药用植物及其生物活性成分由于无毒或低毒的特点,在慢性病的预防和控制中受到越来越多的关注,大量研究表明,许多食用和药用植物或其活性成分如多酚、多糖等可以抵抗肥胖或代谢综合征[4]。
绿茶作为一种健康饮品历史悠久,深受世界各地人们的喜爱,对人体健康有益,可以改善代谢综合征、降低某些慢性疾病的风险,如糖尿病、非酒精性脂肪肝和心血管疾病等[5-6]。表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG) 是绿茶多酚中含量最丰富的儿茶素,也是最具生物活性的成分,占绿茶总儿茶素的50%以上[7]。在过去的几十年中,EGCG 对健康的有益作用已被广泛报道,大量的细胞实验、动物实验和人群干预实验都显示出EGCG 可以减轻体重、缓解代谢综合征、预防糖尿病及心血管疾病等[8-10],例如,在高脂饮食条件(脂肪供能占比为60%)下,与未经EGCG 处理的小鼠相比,经过16 周EGCG 干预(在饮食中含量为0.32%)小鼠的体质量、体脂和内脏脂肪的质量显著降低[11],这些结果也在另外一项采用高脂/西式饮食喂养小鼠的研究中重现[12]。Sheng 等[13]指出EGCG 可能会激活肝脏法尼醇X 受体(farnesoid X receptor,FXR),而使肠道FXR 失活,这可能会对肥胖产生有益影响。此外,EGCG 对胆汁酸受体(takeda G protein-coupled receptor,TGR5) 的激活可以增加血清中酪酪肽(peotideYY,PYY) 和胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)的水平,这可能有助于提高胰岛素敏感性。在基因缺陷糖尿病模型db/db小鼠中,通过饮食补充EGCG(在饮食中含量为1%)可预防葡萄糖不耐受,并减少病变胰岛细胞的数量[14]。
然而,不同剂量EGCG 对代谢的影响及其作用机制尚不清楚。Yang 等[15]指出EGCG 的代谢调节作用涉及2 个主要机制,包括直接机制和间接机制。直接机制直接作用于消化器官,如阻止吸收、抑制消化酶和改变微生物群,而间接机制则通过调节基因表达、蛋白质表达和包括肝脏、肌肉和脂肪组织在内的各种组织的信号转导来介导[16]。但很少有研究关注其剂量效应,Bitzer 等[17]在用不同剂量EGCG 干预高脂饮食小鼠肥胖时发现高剂量EGCG 虽然也可以达到减肥效果,但是通过测量肠氧化应激指标,发现随着剂量的增加,肠道氧化应激水平并没有下降趋势,并随着EGCG浓度增加,氧化应激水平反而升高,表明高浓度EGCG可能具有一定的副作用。因此迫切需要引起对其剂量效应的关注。
本文根据EGCG 在茶多酚中所占比例,以C57BL/6J 小鼠为研究对象,构建高脂小鼠模型,探究不同剂量EGCG 对高脂饮食小鼠体质量和血清生理生化指标的影响,从肠道脂质吸收方面对EGCG 降脂机制进行研究,并测定不同剂量EGCG 对肠氧化应激水平的影响,旨在为指导EGCG 在代谢综合征中的应用并降低其可能的副作用提供参考。
1 材料与方法
1.1 实验动物
60 只无特定病原体(specific pathogen free,SPF)级6 周龄雄性C57BL/6J 小鼠:北京维通利华实验动物技术有限公司,许可证编号北京SYXK(京)2017-0033。
1.2 材料与试剂
低脂对照饲料(D12450J,脂肪提供10%能量)、高脂饲料(D12492,脂肪提供60%能量):江苏省协同医药生物工程有限责任公司;EGCG:上海源叶生物科技有限公司;谷丙转氨酶(alanine transaminase,ALT)测定试剂盒、谷草转氨酶(aspartate aminotransferase,AST)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、谷胱甘肽(glutathione,GSH)测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒、髓过氧化物酶(myeloperoxidase,MPO)测定试剂盒、总胆固醇(total cholesterol,TC) 测定试剂盒、甘油三酯(triglyceride,TG) 测定试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C) 测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒:南京建成生物工程研究所;LunaScriptTMSuperMix Kit 反转录试剂盒、Luna Universal qPCR Master Mix 实时荧光定量PCR 预混液:美国NEB 有限公司;超纯水:杭州娃哈哈集团有限公司;NucleoZOL 试剂:德国MACHEREY-NAGEL 公司;乙醚:天津市化学试剂六厂。
1.3 仪器与设备
超微量分光光度计(Nanophotometer N50):德国Implen 公司;实时荧光定量多聚核苷酸链式反应(real-time quantitativepolymerase chain reaction,qPCR)仪(CFX):美国BIO-RAD 公司;酶标仪(M200pro):瑞士Tecan 公司;组织破碎仪(TP-24):杰灵仪器制造(天津)有限公司;数显磁力搅拌水浴锅(HH-6SC):常州普天仪器制造有限公司;离心机(Sorvall ST 16R):美国Thermo Scientific 公司;高压灭菌锅(CL-40M):日本ALP 株式会社;分析天平(QUINIX224-1CN):赛多利期科学仪器(北京)有限公司;罗氏血糖测试仪(Accu-Chek):罗氏诊断产品(上海)有限公司;基因扩增仪(Mastercyclernexus gradient):德国Eppendorf 公司。
1.4 方法
1.4.1 动物实验
将60 只6 周龄C57BL/6J 小鼠置于室温为20~25 ℃、12h 光照/12h 黑暗循环的环境中适应性喂养1 周,称小鼠体质量并随机分为5 组(每组12 只):正常饮食对照组(记为NC),高脂饮食模型组(记为HFD)、低剂量EGCG 干预组(记为EL)、中剂量EGCG 干预组(记为EM)及高剂量EGCG 干预组(记为EH)。低、中、高剂量EGCG 灌胃剂量分别为50、100、200 mg/kg bw,连续灌胃12 周,并每周监测体质量,所有小鼠均可以自由采食和饮水,饲养于南开大学实验动物中心的SPF级动物房,末次灌胃禁食12 h 后,所有实验动物在实验前用戊巴比妥钠(40 mg/kg,1%水溶液,现用现配)进行麻醉以减轻疼痛并采集血液,迅速收集肝脏、附睾脂肪、肾周脂肪、回肠组织,称量肝脏、附睾脂肪和肾周脂肪的质量,所有组织立即在液氮中冷冻,以便后期进行分析。所有的动物实验操作都严格遵守天津市《实验动物管理条例》的相关规定。
1.4.2 血清生化指标检测
ALT、AST、HDL-C、LDL-C、TG、TC 均按照相应试剂盒说明书进行测定。
1.4.3 葡萄糖耐量测试(oralglucosetolerancetest,OGTT)
在第11 周,将动物过夜禁食10 h,然后灌胃葡萄糖溶液(2.0 g/kg bw)。使用血糖仪从尾静脉尖端收集血液以进行葡萄糖灌胃之前(0 min) 和之后(15、30、60、90、120 min)血糖浓度的测量。
1.4.4 实时荧光定量PCR 检测
使用TRIzol 试剂从冷冻的回肠组织中提取总RNA,然后用LunaScriptTMSuperMix Kit 反转录试剂盒合成cDNA,最后在CFX Connect 实时系统上进行qPCR 反应。qPCR 引物由天津擎科生物技术有限公司合成,引物序列见表1,其中β-Actin 基因被用作归一化,通过2-ΔΔCt 法计算每个基因的相对表达水平。
表1 实时荧光定量PCR 所用的引物序列Table 1 Primers for real-time quantitative PCR
1.4.5 肠氧化应激指标测定
SOD、GSH 和MDA 均按照相应试剂盒说明书要求进行测定。
1.5 数据处理
所有测试至少重复3 次,使用T 检验对两组数据之间的统计学差异进行计算,P<0.05 为有统计学差异,P<0.01 为有显著统计学差异,P<0.001 为有极其显著的统计学差异,数据表示为平均值±标准差。所有统计分析均使用SPSS 22.0 软件进行。两组之间的差异通过双尾学生t 检验进行分析。3 组或更多组之间的差异使用单因素方差分析,并用Student-Newman-Keuls 进行事后检验分析。当比较不同组变化涉及时间变量时,采用双向重复测量方差分析,并用Student-Newman-Keuls 进行事后检验,当P<0.05 时,结果被认为具有统计学意义。
2 结果与分析
2.1 EGCG 对高脂饮食小鼠体质量和脂肪质量的影响
在为期12 周的干预过程中,不同剂量EGCG 对高脂饮食小鼠体质量和脂肪质量的影响见图1。

图1 不同剂量EGCG 对高脂饮食小鼠体质量和脂肪指数的影响Fig.1 Effects of different doses of EGCG on the body weight and fat indexes of mice fed with a high-fat diet
由图1A 可知,在实验结束时,与NC 组相比,HFD组小鼠的体质量明显增加。EGCG 干预可显著降低高脂饮食引起的体质量增加,且随着剂量的增加,降脂效果逐渐增强,但各剂量组间并无显著性差异(P>0.05)。由图1B、图1C 可知,相比于NC 组小鼠,HFD 组小鼠的附睾脂肪指数和肾周脂肪指数显著增加(P<0.05),不同剂量EGCG 均可显著降低HFD 组小鼠的附睾脂肪指数和肾周脂肪指数(P<0.05)。
2.2 EGCG 对高脂饮食小鼠糖代谢的影响
图2 为不同剂量EGCG 对高脂饮食小鼠血糖的影响。

图2 不同剂量EGCG 对高脂饮食小鼠血糖的影响Fig.2 Effects of different doses of EGCG on the hyperglycemia of mice fed with a high-fat diet
高脂饮食造成小鼠糖耐量异常,由图2A 可知,与HFD 组小鼠相比,低、中、高剂量EGCG 均可明显降低60 min 时小鼠的血糖水平,从而使其接近NC 组小鼠血糖水平,其中低、中剂量EGCG 效果更佳,通过计算曲线下面积(area under the curve,AUC),结果同样显示EL组和EM 组小鼠葡萄糖耐受水平显著改善(P<0.05),而EH 组小鼠与HFD 小鼠之间无显著差异(P>0.05)。
2.3 EGCG 对高脂饮食小鼠脂代谢的影响
图3 为不同剂量EGCG 对高脂饮食小鼠脂质代谢的影响。
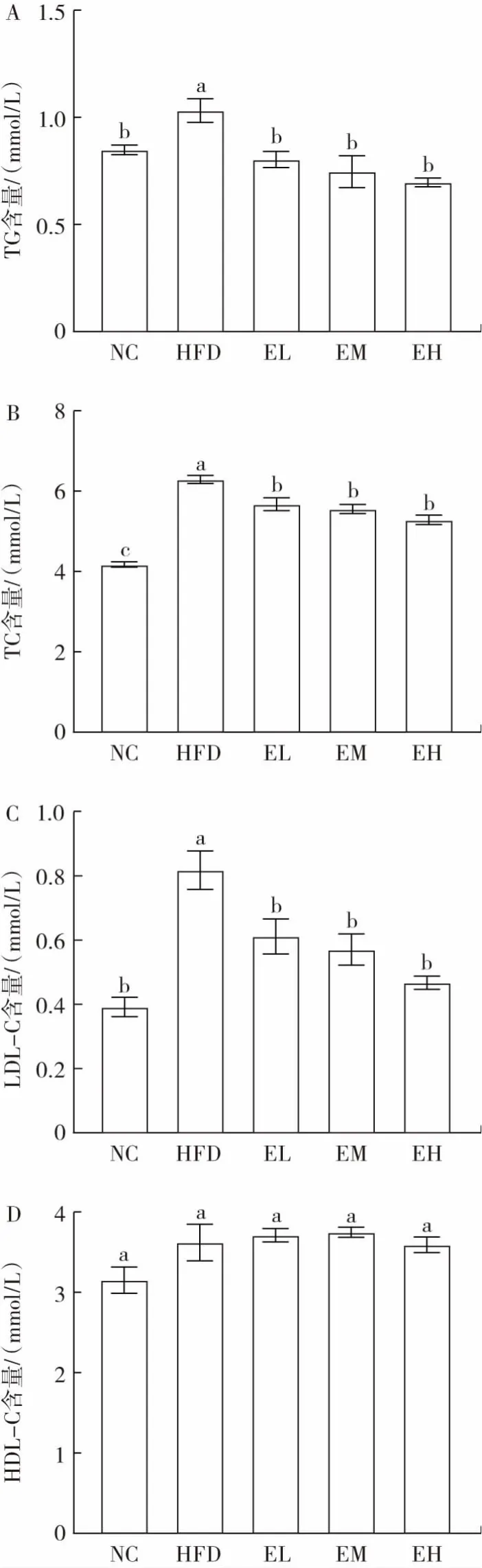
图3 不同剂量EGCG 对高脂饮食小鼠脂质代谢的影响Fig.3 Effects of different doses of EGCG on the serum lipid levels of mice fed with a high-fat diet
由图3 可知,高脂饮食导致小鼠血脂代谢异常,特征表现为HFD 组的TC、TG 和LDL-C 的含量显著高于其他组别(P<0.05),所有组的HDL-C 含量均未观察到显著差异(P>0.05)。不同剂量EGCG 均可显著降低高脂饮食引起的血清TG、TC 和LDL-C 含量的升高(P<0.05),且各剂量之间无显著差异(P>0.05)。
2.4 EGCG 对高脂饮食小鼠肝功能的影响
图4 为EGCG 对高脂饮食小鼠肝功能的影响。

图4 不同剂量EGCG 对高脂饮食小鼠肝功能的影响Fig.4 Effects of different doses of EGCG on the liver function
由图4A 可知,各组之间肝脏指数(肝脏质量/体质量)均无显著差异(P>0.05)。由图4B 可知,高脂饮食造成小鼠肝脏质量显著高于其他组别(P<0.05)。不同剂量EGCG 可显著降低肝脏质量,且呈现一定的剂量依赖性。由图4C、图4D 可知,HFD 组小鼠的ALT 活力显著高于NC 组(P<0.05),表明肝功能受到了一定损伤,不同剂量EGCG 干预可显著降低血清ALT 活力(P<0.05),各组间AST 活力无显著差异(P>0.05)。
2.5 EGCG 对肠道脂质吸收相关基因表达的影响
图5 为不同剂量EGCG 对高脂饮食小鼠肠道脂质吸收相关基因表达的影响。

图5 不同剂量EGCG 对高脂饮食小鼠肠道脂质吸收相关基因表达的影响Fig.5 Effects of different doses of EGCG on the expression of genes related to lipid absorption in the ileum of mice fed with a high-fat diet
脂肪酸转运蛋白CD36 和脂肪酸转运蛋白4(FATP4) 以及乳糜微粒的载脂蛋白ApoB48 是3 个影响脂质吸收的重要蛋白。由图5 可知,在基因水平上,与NC 组小鼠相比,高脂饮食引起CD36 和ApoB48 表达的上调,不同剂量EGCG 均可显著下调CD36 及ApoB48 的表达水平(P<0.05),中、高剂量EGCG 对CD36的影响程度高于低剂量EGCG,各组之间FATP4 表达水平无显著差异(P>0.05)。
在肠道中高表达的CD36 蛋白在脂肪酸的摄取过程中发挥着重要作用[18],FATP4 也参与肠道脂肪酸的摄取[19],在餐后条件下,80%~90%的脂质运输并装载于含ApoB48 蛋白的乳糜微粒中,乳糜微粒负责将外源性食物中的脂肪从小肠携带到肝脏[20-21],在本研究中发现EGCG 可以降低小肠中CD36 和ApoB48 的基因表达水平,证明EGCG 可以减少肠道对脂质的吸收。综上,不同剂量的EGCG 可能通过下调肠道中脂质吸收相关基因的表达,减少机体对脂质的吸收,从而达到改善脂质代谢、调节代谢综合征的效果。
2.6 EGCG 对肠氧化应激指标的影响
不同剂量EGCG 对肠氧化应激指标的影响如表2所示。
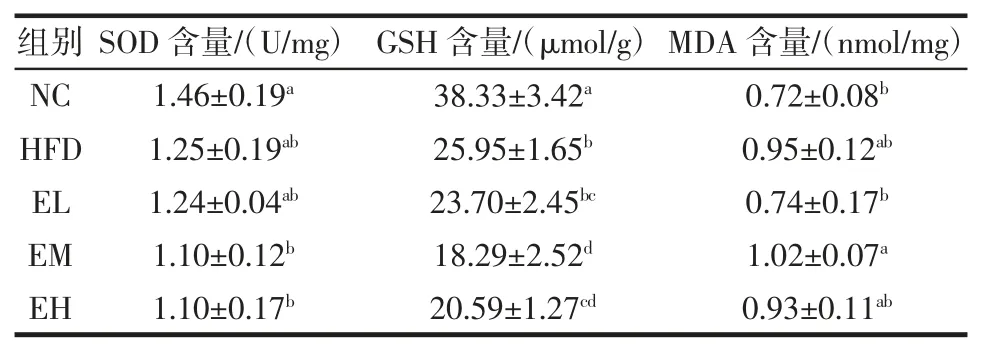
表2 不同剂量EGCG 对肠氧化应激指标的影响Table 2 Effects of different doses of EGCG on oxidative stress indicators in the ileum
由表2 可知,与NC 组小鼠相比,高脂饮食引起肠氧化应激水平升高,包括引起SOD 含量和GSH 含量下降,以及MDA 含量的上升。随着EGCG 剂量的增加,肠道氧化应激水平并没有下降趋势,并随着EGCG浓度增加,中、高剂量EGCG 会升高氧化应激水平,减少GSH 含量,表明高剂量EGCG 可能具有一定的副作用,这与Bitzer 等[17]的研究结论相一致。
3 结论
本研究通过检测糖脂代谢表观指标以及与肠组织中脂质代谢相关蛋白基因的表达水平,探究不同剂量EGCG(50、100、200 mg/kg bw)对高脂饮食小鼠脂代谢的效果及机制研究。结果表明,与高脂对照组比较,不同剂量EGCG 均可显著降低小鼠体质量,改善脂质代谢异常,减轻肝脏损伤,且各剂量之间并无显著差异,只有低、中剂量EGCG 可改善糖代谢,进一步研究发现各剂量EGCG 可能通过减少肠道对脂质的吸收从而达到改善代谢综合征的效果,但中、高剂量EGCG可能具有一定的肠毒性。
