乙状结肠癌根治术后发生吻合口瘘的危险因素分析
2023-09-15黄勇吴兆映邹俊伟张磊史良会
黄勇,吴兆映,邹俊伟,张磊,史良会
近年来,结直肠癌(colorectal cancer,CRC)发病率在全球癌症发病率已上升至第3位,死亡率上升至第2位。据统计,2020年中国CRC新发病例占全球新发病例的28.8%(56万/193万),死亡率占全球死亡率的30.6%(29万/94万)[1-2]。根治性手术可改善患者的长期生存率。但是,术后吻合口瘘(anastomotic leakage,AL)是CRC根治术后严重并发症之一,导致AL的原因很多,国内外众多研究结果并不完全一致[3-4]。乙状结肠是结直肠癌中仅次于直肠的好发部位[5]。本文通过回顾性分析乙状结肠癌患者行根治性手术后发生AL的高风险因素,为减少AL发生率提供科学的理论依据。
1 资料与方法
1.1 一般资料 统计2016年5月至2022年10月于皖南医学院第二附属医院普通外科行根治性手术的71例乙状结肠癌患者的临床资料,其中男性43例,女性28例,年龄44~89岁,平均年龄(68.11±10.62)岁。其中行腹腔镜手术者56例,开放手术者15例。纳入标准:①术前CT、肠镜及病理检查结果确诊为乙状结肠恶性肿瘤;②临床病理资料完整;③由同一手术团队完成乙状结肠癌根治术;④一期吻合且未行保护性造瘘;⑤术前未行新辅助放化疗;⑥术后病理切缘阴性。排除标准:①行姑息性手术;②行永久或保护性造瘘手术;③术前行新辅助放化疗;④术后因手术外其他原因死亡。本研究经医院伦理委员会审批通过。
1.2 手术方法 腹腔镜手术步骤:麻醉后,取膀胱截石位,垫起臀部,常规消毒铺巾,于脐上作切口,置入10 mmTrocar,建立CO2气腹,使腹内压达13 mmHg;于右锁骨中线平脐、右髂前上棘交点处分别作5 mm、10 mm穿刺孔,分别置入5 mm Trocar、10 mm Trocar作为主刀操作孔。在左侧对称位置作两处5 mm穿刺孔置入5 mm Trocar作为一助操作孔。于骶骨岬水平上切开乙状结肠内侧腹膜,向近端游离显露肠系膜下动静脉根部,清扫253淋巴结,未保留左结肠动脉者于根部离断血管,保留左结肠动脉者自肠系膜下动脉根部分离出左结肠动脉、乙状结肠动脉及直肠上动脉,离断乙状结肠动脉及直肠上动脉。游离肠管至距肿瘤下缘5 cm,裸化乙状结肠壁后用直线切割闭合器在距肿瘤下缘5 cm处离断直肠。做下腹部正中切口约5 cm,置入切口保护套,将离断的肠管及其系膜提出腹腔,直视下在肿瘤上缘10 cm处切断乙状结肠,移除标本。在乙状结肠残端放置吻合器帽。再次充气建立气腹,肛门予以稀碘伏水冲洗后插入管型吻合器,与腹腔内的吻合器帽衔接后击发吻合,检查系膜无扭转,肠管无张力,创面无出血,左右盆腔各放置引流管一根。关闭气腹,逐层缝合各切口。开腹手术手术步骤:准备工作与腹腔镜手术同,取下腹正中切口,上端绕脐,长约20 cm,逐层进入腹腔。打开乙状结肠内侧腹膜,游离肠系膜下动静脉根部,同腹腔镜组方法处理血管并清扫253淋巴结。向下游离乙状结肠及系膜至肿瘤下方5 cm处离断,再于肿瘤上方10 cm离断标本,近端置入抵钉座待用。肛门消毒后将相应型号吻合器从肛门置入,行直肠残端与降结肠端端吻合。检查系膜无扭转,肠管无张力,创面无出血,左右盆腔各放置引流管一根,逐层缝合切口。
1.3 AL的诊断标准 术后发生AL的诊断标准(满足任意一项即确诊):①引流管内出现粪样物;②术后出现腹痛腹胀、发热、腹膜刺激征,炎性指标明显升高;③腹部CT见腹盆腔内游离气体,可集聚于吻合口周围,吻合口连续性中断,周围可见明显渗出;④消化道造影见造影剂从吻合口溢出;⑤肠镜检查可见吻合口缺损;⑥二次手术证实。根据严重程度将AL分为三级:A级是指经CT等影像学检查发现,患者无明显临床症状,无需特殊处理;B级是指有腹痛、发热等临床表现,直肠阴道或引流管内有脓性分泌物流出,白细胞、C反应蛋白、降钙素原等炎性指标升高,需经抗感染、冲洗引流等保守治疗;C级是指除B级瘘的表现外,还出现腹膜炎、脓毒血症、多器官功能衰竭、休克等严重并发症,需再次手术干预。
1.4 研究方法 分析影响乙状结肠癌术后发生AL的相关因素,根据时间节点分为三个时段:①术前因素:年龄、性别、是否合并基础疾病(高血压、糖尿病)、2002营养风险筛查评分(nutrition risk screening,NRS2002)、身体质量指数(body mass index,BMI)、肿瘤大小、不全性肠梗阻、术前贫血(男性低于120 g/L,女性低于110 g/L)、术前白蛋白水平、肿瘤病理分期。②术中因素:手术方式、手术时间、是否保留左结肠动脉。③术后因素:术后贫血(男性低于120 g/L,女性低于110 g/L)、术后血糖、术后白蛋白水平。
1.5 统计学方法 采用SPSS24.0软件进行数据统计分析,计数资料采用χ2检验或Fisher确切概率法;使用Logistic 回归模型,将单变量分析中有统计学意义的变量进一步行多因素分析,筛选出影响AL发生的独立危险因素。检验水准α=0.05。
2 结果
2.1 乙状结肠癌根治术后发生AL的相关情况 71例入组病例中,共9例(12.7%)患者术后发生AL,其中有2例术前有不全性肠梗阻表现。9例患者中有7例为B级瘘,发生于术后第5~7天,均予以经腹腔引流管持续冲洗吸引等保守治疗措施后痊愈出院。2例为C级瘘,1例发生于术后第2天,另1例发生于术后第3天,均经二次手术造瘘补救,但仍有1例患者因严重感染导致死亡。
2.2 乙状结肠癌根治术后发生AL的单因素分析 将患者的临床病理资料依次纳入统计学模型中,进行影响乙状结肠癌根治术后发生AL的单因素分析。结果显示,肿瘤大小、是否合并基础疾病(高血压、糖尿病)、NRS2002评分以及术后白蛋白≤30 g/L与AL的发生有关(P≤0.05,见表1)。
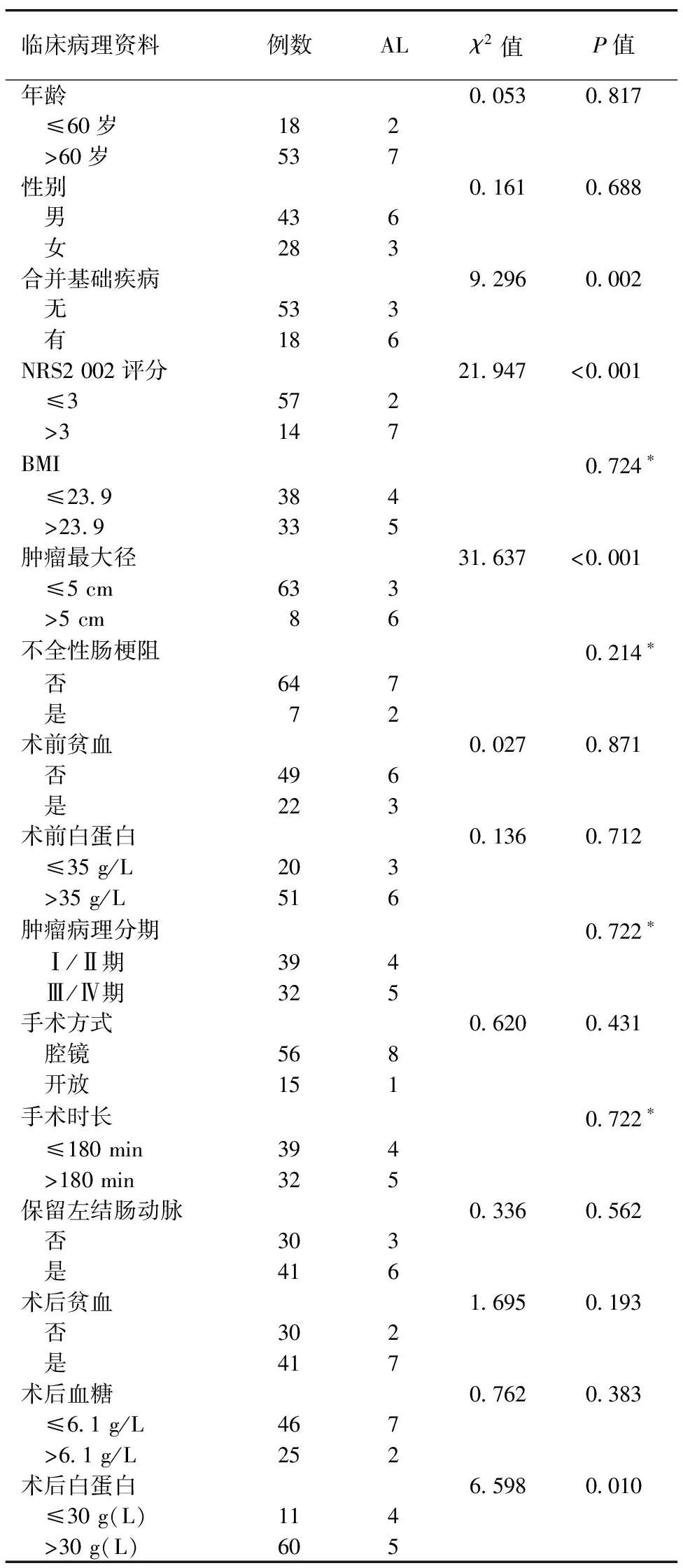
表1 71例乙状结肠癌根治术后AL发生率与临床病理资料的单因素分析(例)
2.3 乙状结肠癌根治术后发生AL的多因素分析 将单因素分析中具有统计学意义的自变量纳入Logistic回归模型中行多因素分析(自变量赋值情况详见表2)。结果表明,肿瘤最大径>5 cm与NRS2002评分≥3分是影响乙状结肠癌根治术后发生AL的独立危险因素(P≤0.05,见表3)。

表2 自变量赋值情况
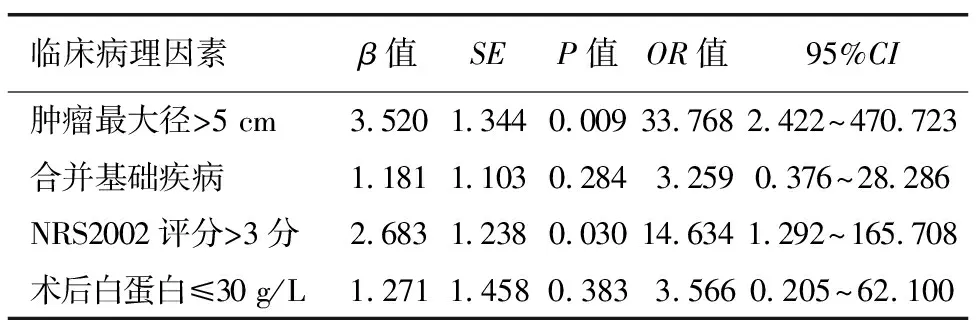
表3 71例乙状结肠癌根治术后发生AL的多因素Logistic回归分析
3 讨论
AL是结直肠癌术后最严重的手术相关并发症,发生率约为1.8%~19.2%,死亡率达到2.0%~16.4%[6]。本组病例中,共9例患者术后发生AL,发生率为12.7%(9/71),与既往研究报道基本一致。
导致AL的影响因素很多,各研究结果并不完全相同。患者是否合并糖尿病、高血压等基础疾病是影响胃肠道肿瘤术后AL发生的重要因素[7]。国内研究显示,伴有2型糖尿病的结直肠癌患者,若术前糖化血红蛋白>6.3%将会增加术后AL的发生率[8]。另一项研究统计了1 594例直肠癌患者,结果表明同时合并糖尿病的患者术后AL的发生率为14.94%,高于无糖尿病患者的10.16%,单因素及多因素分析均证明糖尿病是影响AL发生的重要因素[9]。高血压同样是影响吻合口愈合的危险因素,崔鹏等[10]研究表明,行全胃切除并食管空肠吻合术的患者中,合并有高血压组术后发生AL的概率为14.3%(5/35),无高血压组为5.1%(10/198),差异具有统计学意义(P=0.040)。血糖及血压增高主要是会引起小动脉血管硬化,导致肠道微循环血供不佳,从而使组织愈合能力及抗感染能力下降,血糖增高还会导致体内糖代谢紊乱,降低组织营养利用度,进一步引起蛋白质代谢障碍,引起组织修复能力受损,最终导致AL发生。术后低蛋白血症是评价术后营养状况的重要指标。导致术后血浆白蛋白降低的因素有很多,其中术前营养状况差和手术创伤大是主要因素,二者通过加重患者术后应激,导致机体持续处于高代谢状态,增加了蛋白质消耗。与此同时严重的应激状态会使肝脏优先合成急性时相蛋白,从而减少白蛋白的产生。并且机体在应激时会增加胰高血糖素分泌、减少胰岛素分泌,导致蛋白质合成减少,降解增加,机体处于负氮平衡,术后低蛋白血症随之加重[11]。研究表明,腹腔感染将导致术后低蛋白血症的发生,腹腔感染引起TNF-α、IL-2、VEGF等炎性介质大量释放,导致血管内皮糖萼降解,增加血管通透性,与此同时白细胞黏附于血管内皮细胞,破坏多糖-蛋白质复合物的结构,引起毛细血管通透性增加,最终导致血浆白蛋白漏出至血管外[12 ]。术后低蛋白血症会导致患者大量体液进入第三间隙,有效循环血量不足从而引起小血管收缩,影响吻合口血供,同时低蛋白血症会引起吻合口水肿,导致组织愈合能力下降,严重时发生AL。日本一项研究纳入了200例接受根治性手术的非转移结直肠癌患者,结果显示,术后发生AL组与无AL组相比较,两组患者之间术前血清白蛋白水平,差异无统计学意义,但发生AL组术后血清白蛋白低于对照组,差异具有统计学意义,表明术后低蛋白血症是导致结直肠癌术后发生AL的潜在影响指标[13]。明永静等[14]研究显示,当术后血清白蛋白≤30 g/L时,AL 发生率高于术后白蛋白>30 g/L的患者,多因素分析进一步证实术后白蛋白<30 g/L的患者发生AL的风险增加近3.8倍(OR=3.812,P=0.016)。而AL发生将引起腹腔内感染,进一步加重了低蛋白血症,形成恶性循环。
本研究显示,合并基础疾病及术后白蛋白<30 g/L均与乙状结肠癌术后AL的发生具有相关性,但多因素分析结果提示二者并不是影响AL的独立危险因素,考虑可能是因为样本量较小,导致结果产生偏倚,需进一步大样本研究来证实。
Nisar等[15]收集了1 862例接受结直肠癌手术患者的临床资料,结果显示肿瘤直径>4 cm是影响AL发生的独立危险因素。Kawada等[16]研究表明,在154例结直肠癌手术患者中,AL总体发生率为12.3%(19/154),肿瘤直径>5 cm的患者术后AL发生率为27.3%(12/43),对照组为6.3%(7/111),差异具有统计学意义(P<0.001),多因素分析结果表明肿瘤直径>5 cm将增加AL发生的风险(P=0.020)。肿瘤大小是导致肠管堵塞的决定性因素,肿瘤体积越大,患者发生肠梗阻的概率越高,研究表明术前合并肠梗阻将对术后吻合口瘘的发生产生不良影响[14]。本研究数据显示肿瘤体积越大,术前发生肠梗阻的概率越高,肿瘤≤5 cm的63例患者中,有2例(3.2%)术前发生不全性肠梗阻,而肿瘤>5 cm的8例患者中有5例(62.5%)术前发生不全性肠梗阻。但单因素分析结果显示不全性肠梗阻并不是影响吻合口瘘发生的危险因素(P=0.214),产生此结果的原因可能有两方面,一方面是因为不全性肠梗阻病例数量较少,另一方面是因为此研究排除了因肠梗阻未能解除或无法完善肠道准备导致行永久或临时性造瘘的病例,有选择偏倚。肿瘤大小同样是影响手术进程的重要因素,较大的肿瘤体积将导致术中视野受阻,解剖层次辨别困难,可能对腹腔内肠管横断和吻合时的操作产生不利影响。本研究结果显示,肿瘤最大径≤5 cm的63例患者中,有3例发生术后AL,而肿瘤最大径>5 cm的8例患者中有6例发生AL,统计学分析结果提示肿瘤最大径>5 cm是影响乙状结肠癌根治术后发生AL的独立危险因素。
营养风险是指患者自身存在的与营养状况相关的不利因素,对疾病发展或围手术期恢复带来不利影响的风险。术前营养风险筛查2002(NRS2002)评分是被欧洲肠外肠内营养学会推荐的通过对128例临床随机对照研究进行系统评价后总结出的术前营养风险评估工具,用于评估患者术前营养状况,目前已广泛应用于临床营养筛查工作中,NRS2002评分=疾病严重程度评分(根据疾病轻重程度递增加0~3分)+营养状况评分(根据营养状况递减加0~3分)+年龄评分(年龄>70岁者加1分),总分≥3分被认为存在营养风险[17]。最近Zhong等[18]通过对858例接受根治性手术的结直肠癌患者进行回顾研究,建立一种能够有效评估术后AL发生的预测模型,结果发现术前NRS2002评分≥3分是预测患者术后发生AL的独立危险因素。国内一项关于胃癌术后AL的研究收集了共369例患者的临床资料进行分析,结果显示NRS2002评分可以有效预测胃癌根治术后发生AL的风险[19]。本研究71例患者中有14例NRS2002评分≥3分,其中有7例发生术后AL,单因素及多因素分析结果显示NRS2002评分≥3分对预测乙状结肠癌根治术后发生AL具有重要意义。
综上所述,肿瘤最大径>5 cm、是否合并有基础疾病、NRS2002评分≥3分以及术后白蛋白含量≤30 g/L与乙状结肠癌根治术后AL的发生具有相关性,肿瘤最大径>5 cm与NRS2002评分≥3分是影响AL发生的独立危险因素。因此,对于乙状结肠癌患者术前应充分评估,对于肿瘤体积较大者术中应谨慎操作,吻合时应仔细检查,避免应肿瘤体积过大导致暴露不清,同时应关注患者围手术期间营养状况,积极营养支持,避免AL的发生。
