CRISPR/dCas9-KRAB系统沉默猪LncRNA-NEAT1基因
2023-09-15赵为民戴超辉付言峰李碧侠任守文程金花
赵为民, 戴超辉, 陈 哲, 涂 枫, 李 辉, 付言峰, 李碧侠, 任守文, 程金花
(1.江苏省农业科学院畜牧研究所,江苏 南京 210014; 2.江苏省农业种质资源保护与利用平台,江苏 南京 210014; 3.农业农村部种养结合重点实验室,江苏 南京 210014)
长链非编码RNA (Long non-coding RNA,LncRNA) 是一类本身不编码蛋白、转录本长度超过200 bp的RNA。研究结果表明LncRNA参与了X染色体失活、胚胎发育、基因印记、癌症、免疫等各种细胞生命活动[1-5]。
近年来大量畜禽相关的LncRNA被鉴定出来,这些LncRNA紧密参与了畜禽肌肉发育、免疫调控、繁殖等重要性状[6-9],注释和解析这些LncRNA的功能对进一步挖掘调控畜禽重要经济性状的功能元件具有深远意义。然而大多数LncRNA定位于细胞核,而RNAi的工作系统主要在细胞质中发挥作用,对定位于细胞核的LncRNA作用非常有限[10-12],这限制了LncRNA的功能解析。
CRISPRi系统通过核酸酶活性失活的Cas9(dCas9)和sgRNA的复合物结合到某个基因的转录起始位点(Transcription start site,TSS)附近,物理性阻碍RNA聚合酶的通过,从而导致基因沉默[13]。通过dCas9融合基因抑制结构域如KRAB(Krüppel-associated box),形成dCas9-KRAB复合结构,可进一步提高转录抑制的效率[14-16]。Liu等[17]利用CRISPRi系统鉴定了数百个与细胞生长相关的LncRNA,Klann等[18]利用CRISPRi系统鉴定了大量与基因表达调控相关的功能元件。CRISPRi系统在抑制基因表达上也呈现出较强的特异性[19-20],是研究LncRNA功能的新一代工具。
LncRNA-NEAT1是在研究肌细胞分化时发现的一个长链非编码 RNA[21],其作为核心组分主要参与细胞亚结构旁斑(Paraspeckle)的形成,在细胞分化,癌症发生和病毒感染等生物学过程中发挥着重要作用[21-23]。本课题组前期研究结果表明猪LncRNA-NEAT1基因在脂蛋白刺激下表达显著上调,表明其在Toll样受体2(Toll Like Receptor 2,TLR2)介导的先天性免疫反应中可能起到调控作用[24]。本研究利用CRISPR/dCas9-KRAB系统来抑制LncRNA-NEAT1基因的表达,为后续进一步研究其在先天性免疫反应中的功能奠定基础。
1 材料和方法
1.1 细胞、菌株与质粒
Trans5a感受态菌株购于北京擎科生物科技有限公司,Lenti-dCas9-KRAB-blast载体由华中农业大学赵长志惠赠,猪PK15细胞、px330载体由本实验室保存。
1.2 试剂
RNA提取试剂盒购于南京诺唯赞医疗科技有限公司;DNA提取试剂盒、DNA marker购于北京擎科生物科技有限公司;内切酶BbsI、T7E1酶购于NEB公司;PCR酶、T载体、末端转移酶TdT、T4连接酶、qPCR试剂、反转录试剂盒购于宝生物工程(大连)有限公司;无内霉毒素质粒试剂盒购于天根生化科技(北京)有限公司;Blasticidin S HCl (灭瘟素S)购于南京碧云天生物技术有限公司;DNA纯化回收试剂盒购于Zymo ResearchZymo research_安诺伦(北京)生物科技有限公司公司;DMEM培养基、青链霉素购于武汉博士德生物工程有限公司;胎牛血清购于Biological Industries (BI)公司;opti-MEM和LipofectamineTM3000 Transfection Reagent购于赛默飞世尔科技(中国)有限公司。
1.3 猪LncRNA-NEAT1基因的亚细胞表达分布
待细胞密度长至80%左右,胰酶消化细胞,用预冷PBS清洗两遍后加入Buffer A(10 mmol/L tris-cl,10 mmol/L NaCl,0.5% IGEPAL© CA-630),冰上放置5 min,离心后上清液用于细胞质RNA的提取。用Buffer A洗涤沉淀2次,沉淀用于细胞核RNA的提取。
1.4 猪LncRNA-NEAT1基因的5′末端快速扩增(5′RACE)
基于前期测序获得部分序列结果[24],LncRNA-NEAT1基因的5′末端快速扩增过程如下:利用oligodT反转录cDNA第一链,然后再利用TdT酶进行5′末端dC-tailing,回收纯化后,用引物5P(5′-AAGCAGTGGTATCAACGCAGAGTACGCGGGGGGGGGG-3′)和5′末端的特异性引物5′GSP(5′-CTGCCTCCCTCCTTCAGACAAAG-3′)扩增其5′末端。 PCR扩增条件:95 ℃ 5 min,95 ℃ 30 s,65 ℃(-0.5 ℃)45 s,72 ℃ 1 min,15个循环;95 ℃ 1 min,60 ℃ 45 s,72 ℃ 1 min,20个循环;72 ℃ 3 min。扩增的PCR产物经过DNA纯化回收后与T载体连接,然后转化Trans5a感受态细胞,后续进行测序验证。
1.5 LncRNA-NEAT1基因启动子区域的sgRNA设计
针对LncRNA-NEAT1基因启动子区(-300~0 bp)利用CRISPOR(http://crispor.tefor.net/)在线设计2对sgRNA。设计原则为选取cfdSpecScore>80,Doench′16-Score>50的sgRNA。
1.6 px330-sgRNA质粒构建
依据sgRNA的序列合成反向互补的单链寡核苷酸sgF和sgR,并在sgF的5′端添加CACCG,在sgR的5′端添加AAAC。95 ℃变性5 min,室温冷却,使sgF和sgR退火互补。BbsⅠ 酶切px330载体,回收纯化后与退火的寡核苷酸连接,转化Trans5a感受态细胞,后续进行测序验证与无内霉毒素质粒提取。
1.7 px330- sgRNA-dCas9-KRAB载体构建
通过酶切px330载体,将Cas9序列替换为多克隆位点,然后再将dCas9-KRAB-BSD插入到该多克隆位点。具体方法如下:首先以px330载体为模板,通过引物F:5′-TTGTACCGGTCGTACGGCTAGCCTCGAGAAGCTTGAATTCCTAGAGCTCGCTGA-3′和R:5′-GATGCGGCCGCTCCCCAGCAT-3′进行PCR扩增。 PCR产物包含引入了多个酶切位点(引物F下划线部分)的bGH poly(A)片段。然后对PCR产物和px330载体分别进行AgeⅠ和NotⅠ双酶切并进行连接,转化Trans5a感受态细胞,后续进行测序验证与质粒提取。此重组后的载体为px330-MCS。将筛选好的sgRNA先构建到px330-MCS,为px330-sgRNA-MCS。然后对px330-sgRNA-MCS和Lenti-dCas9-KRAB-blast进行BsiWⅠ和EcoRⅠ双酶切,将Lenti-dCas9-KRAB-blast载体中的dCas9-KRAB-BSD连接到px330-sgRNA-MCS中,形成重组载体px330-sgRNA-dCas9-KRAB。
1.8 Blasticidin S筛选质量浓度摸索
猪PK15细胞铺板12孔板,24 h后待细胞密度达到80%左右,分别添加0 μg/ml、1 μg/ml、3 μg/ml、4 μg/ml的Blasticidin S,每个质量浓度处理3次重复,每2 d换1次,在第7 d时观察细胞的死亡情况,使细胞致死的最小剂量为后续的药筛质量浓度。
1.9 LncRNA-NEAT1基因的沉默
猪PK15细胞在转染前1 d铺12孔板,转染时密度大约70%。对照组转染px330-dCas9-KRAB,实验组分别转染px330-sgRNA1-dCas9-KRAB和px330-sgRNA2-dCas9-KRAB质粒,48 h后,利用Blasticidin S筛选细胞7 d后进行LncRNA-NEAT1基因的表达检测。
1.10 定量PCR
1 μg RNA反转录成cDNA,使用QuantStudio 5进行qPCR扩增。对照组与试验组各3个生物学重复,每个样品重复3次。采用三步法扩增,程序简要如下:预变性95 ℃ 2 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。数据均以平均值±标准差表示。使用单因素方差分析各组之间的差异显著性。引物序列见表1。

表1 引物序列信息
2 结果与分析
2.1 猪LncRNA-NEAT1表达的亚细胞定位
利用低渗溶液将细胞总RNA分为细胞质和细胞核RNA,RT-PCR结果显示LncRNA-NEAT1表达于细胞核,在细胞质中几乎不表达(图1)。HPRT作为细胞内参基因,其在细胞核内转录后会向细胞质中运输,其mRNA在细胞质中的表达量多于细胞核。图1结果显示HPRT在细胞质的表达量高于细胞核,符合其表达定位。

图1 LncRNA-NEAT1在细胞质与细胞核中的表达Fig.1 Expression of LncRNA-NEAT1 in cytoplasm and nucleus
2.2 猪LncRNA-NEAT1转录起始位点
为了确定LncRNA-NEAT1的转录起始位点,通过5′RACE对其5′端序列进行了克隆,图2结果显示得到大约270 bp的条带,与预期相符。
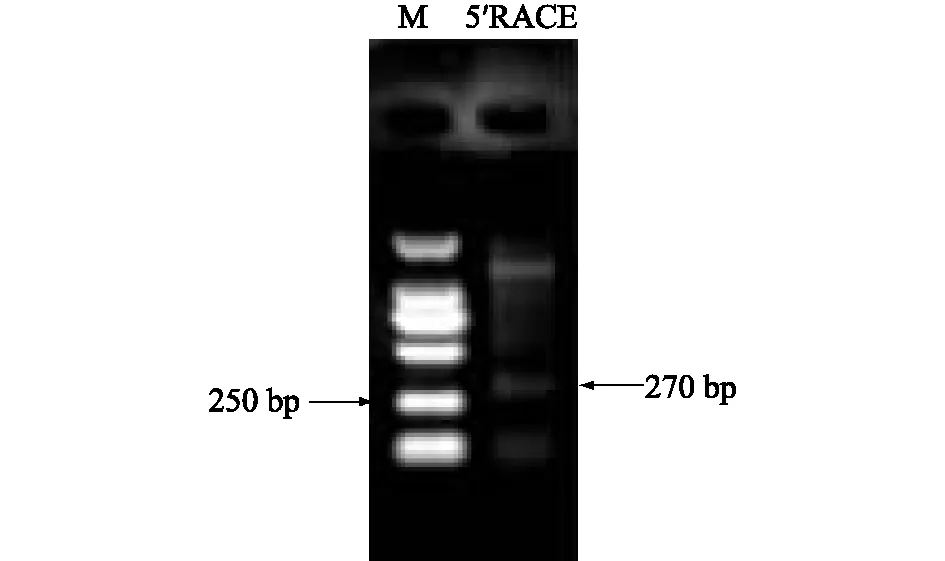
图2 LncRNA-NEAT1的5′RACE扩增结果Fig.2 5′RACE amplification of LncRNA-NEAT1
2.3 猪LncRNA-NEAT1启动子区的sgRNA设计与效率验证
通过CRISPOR在线设计程序,对LncRNA-NEAT1启动子区(-300~0 bp)设计了2对sgRNA,分别为sgRNA1:5′-CCGAGGCGTCTCCTCAGACA-3′,PAM为GGG,位置约-200 bp,Doench 16-Score参数为63;sgRNA2:5′-GAGCAATGCCCCGGGTGACG-3′,PAM为CGG,位置约-150 bp,Doench 16-Score参数为63。
2.4 px330-sgRNA-dCas9-KRAB载体的酶切验证
图3显示构建的px330-sgRNA-dCas9-KRAB经过BsiWⅠ和EcoRⅠ双酶切后,得到约4 200 bp的px330骨架和5 000 bp的dCas9-KRAB-BSD片段,与预期相符。

M:DNA相对分子质量标准样品;1:px330-sgRNA1-dCas9-KRAB载体BsiWⅠ和Eco RⅠ双酶切;2:px330-sgRNA2-dCas9-KRAB载体BsiWⅠ和Eco RⅠ双酶切。图3 px330-sgRNA-dCas9-KRAB质粒的酶切鉴定Fig.3 Identification of px330-sgRNA-dCas9-KRAB plasmid by enzyme digestion
2.5 Blasticidin S筛选质量浓度的确定
图4结果显示,在加Blasticidin S培养7 d后,1 μg/ml质量浓度Blasticidin S处理的细胞只有部分细胞死亡(图4B),而3 μg/ml与4 μg/ml质量浓度Blasticidin S处理的的细胞几乎全部死亡(图4C、图4D),因此在后续的筛选中,Blasticidin S筛选质量浓度为3 μg/ml。图4A为阴性对照组,细胞生长正常。

A:阴性对照组;B:1 μg/ml的Blasticidin S;C:3 μg/ml 的Blasticidin S;D:4 μg/ml 的Blasticidin S。图4 不同质量浓度Blasticidin S对细胞的致死效果Fig.4 The killing effect of different concentrations of Blasticidin S on cells
2.6 CRISPR/ dCas9-KRAB系统沉默猪LncRNA-NEAT1的表达
细胞转染px330-sgRNA-dCas9-KRAB(试验组)与px330-dCas9-KRAB(对照组)36 h后,添加Blasticidin S筛选细胞7 d,对LncRNA-NEAT1基因的表达进行qPCR检测。结果(图5)显示,与对照组相比,sgRNA1和sgRNA2分别使LncRNA-NEAT1表达下降了73%和55%,达到显著水平(P<0.05)。

*表示与对照组相比差异显著(P<0.05)。图5 sgRNA1和sgRNA2对LncRNA-NEAT1基因的沉默效果Fig.5 Silencing effect of sgRNA1 and sgRNA2 on LncRNA-NEAT1 gene
2.7 猪LncRNA-NEAT1启动子区的切割验证
为了进一步验证CRISPR/ dCas9-KRAB系统中的sgRNA是否会切割其结合位点,利用Sanger测序对sgRNA1和sgRNA2的结合位点进行分析。结果(图6)显示试验组中sgRNA1和sgRNA2的结合位点和对照组一致,其序列没有发生碱基缺失或者插入。

图6 猪LncRNA-NEAT1启动子区sgRNA结合位点的Sanger测序峰图Fig.6 Sanger sequencing peak map of sgRNA binding sites in the promoter region of pig LncRNA-NEAT1
3 讨 论
近年来随着重测序以及功能基因组学的发展,猪相关的LncRNA与增强子等被大量鉴定出来[6,25]。CRISPRi与RNAi和CRISPR/dCas9敲除相比,在研究细胞核内相关的LncRNA或表达增强子(Enhancer-derived RNAs,eRNAs)上有着较大优势[12,15],并且也可以进行高通量的筛选研究,为解析猪功能基因组以及挖掘重要调控元件奠定基础。
LncRNA-NEAT1在最初发现时定位于小鼠肌细胞核内,作为核心组分主要参与细胞亚结构旁斑(Paraspeckle)的形成[21]。本试验发现猪LncRNA-NEAT1几乎只表达于细胞核,表明LncRNA-NEAT1的表达定位在物种间相对保守。由于Lenti-dCas9-KRAB-blast载体较大(约14 kb),如果再联合转染sgRNA表达载体,会导致转染效率低,从而会影响基因沉默效果。本研究通过酶切与亚克隆构建了px330-sgRNA-dCas9-KRAB这种“All-in-one”载体,将sgRNA和dCas9-KRAB表达元件都整合到一个载体,大幅度缩减了载体,提高了表达效率[26-27],从而进一步提升沉默效果。
位于TSS不同位置的sgRNA对CRISPR/ dCas9-KRAB的沉默效果具有决定性作用[15,28]。因此本研究首先利用5′RACE确定了LncRNA-NEAT1的TSS。由于大多数编码LncRNA基因,其表达水平相对于编码蛋白基因较低[29-31], 确定这些重要而表达水平较低的LncRNA的TSS并不容易,这也是利用CRISPR/dCas9-KRAB系统沉默LncRNA一个限制因素。
TSS附近启动子区对基因表达水平有重要影响,其区域内碱基的删除或插入会影响其基因的表达[32-34]。尽管dCas9呈现失活的状态,并不会切割sgRNA的结合位点[13],为了进一步验证LncRNA-NEAT1的表达下调不是由于sgRNA切割TSS附近启动子区造成的,本研究利用Sanger测序对试验组sgRNA的结合位点进行序列分析,结果显示其结合位点并没有发生删除或者插入,表明LncRNA-NEAT1的表达下调是通过CRISPR/dCas9-KRAB系统来实现。
本研究获得了LncRNA-NEAT1基因的TSS位点,在其附近启动子区设计并验证了2对有效sgRNA,通过构建“All-in-one”载体,利用CRISPR/dCas9-KRAB系统有效沉默了猪LncRNA-NEAT1基因的表达。
