甘蓝黑斑病病原菌鉴定及其对杀菌剂的敏感性
2023-09-15刘志刚余方伟李建斌王神云宋江华
刘志刚, 余方伟, 张 伟, 于 利, 李建斌, 王神云, 宋江华
(1.安徽农业大学园艺学院,安徽 合肥 230036; 2.江苏省农业科学院蔬菜研究所,江苏 南京 210014)
十字花科芸薹属植物(Brassicaspp.)包含甘蓝(Brassicaoleraceavar.capitataL.)、白菜(Brassicarapa)和油菜(Brassicanapus)等多种蔬菜油料作物,在全球种植的农作物中占有重要地位。2019年,甘蓝及其他芸薹属作物的栽培面积位列中国蔬菜种植面积前十,同时该类作物的出口量达9.853×104t,在中国蔬菜主要出口种类中位列第2[1]。江苏省是甘蓝的重要种植区之一[2],近年来,随着甘蓝栽培面积逐渐扩大,黑斑病频频发生,成为影响甘蓝可持续生产的重要病害。
十字花科作物黑斑病由链格孢属真菌(Alternariaspp.)引起,可危害植物的叶片、茎、叶柄、角果等组织。叶面发病时,侵染部位产生水渍状小点,并逐渐形成许多肉眼可见的小黑点,后期发展成同心轮纹病斑,病斑有时穿孔[3]。世界范围内,黑斑病导致印度十字花科油料作物产量损失15%~71%,在加拿大,因黑斑病导致的十字花科油料作物产量损失达20%~30%[4]。除了导致作物减产外,链格孢属真菌还会产生70多种真菌毒素,其中交链孢酚单甲醚(Alternariol 9-monomethyl ether)具有基因毒性、交链孢毒素(Altertoxin)具有致突变性,是人类健康的潜在威胁[5-6]。
链格孢属真菌种类多且分类复杂,目前已有记录的就有300多种[7]。为了明确甘蓝黑斑病病原菌的分类地位,王超等[8]通过核糖体DNA内转录间隔区(rDNA-ITS)序列分析发现,芸薹生链格孢(Alternariabrassicicola)是引起东北农业大学实习基地内甘蓝黑斑病的病原菌。另有研究结果表明,芸薹生链格孢、芸薹链格孢(Alternariabrassicae)、萝卜链格孢(Alternariaraphani)、链格孢(Alternariaalternata)均能侵染甘蓝[3]。为了揭示江苏省甘蓝黑斑病的病原菌种类,从江苏省南京市和宜兴市采集疑似黑斑病的甘蓝病株,在明确分离菌株形态学特征和致病性的基础上,结合多基因分子系统学研究,鉴定甘蓝黑斑病致病菌,同时测试不同杀菌剂对病原菌的室内毒力,以期为甘蓝黑斑病病原菌的鉴别和防治提供科学依据。
1 材料与方法
1.1 病样采集与病原菌分离
在南京市江宁区和宜兴市周铁镇甘蓝种植区,选取具有黑斑病发病典型症状的甘蓝植株,拍照并采集病叶备用。按照方中达[9]的常规组织分离方法进行甘蓝黑斑病病原菌分离,从病变叶片边缘切下5 mm×5 mm大小的叶片组织,75%乙醇表面消毒90 s,无菌水洗净后用灭菌滤纸吸干水分,接种于PDA培养基(货号CM0139,Oxoid公司产品),置于25 ℃条件下培养。长出的菌落经过单孢纯化,保存于4 ℃冰箱中备用。
1.2 形态特征观察
用打孔器在菌落边缘取直径为0.5 cm的菌丝块,接种到PDA平板中央,置于25 ℃培养7 d,然后观察菌落形态。用无菌水洗脱分生孢子,在光学显微镜(货号Olympus CX33,Olympus公司产品)下观察分生孢子形态特征。
1.3 致病性测定
用于病原菌致病性测试的甘蓝品种HBJD283由江苏省农业科学院蔬菜研究所提供。将甘蓝种子播种在含基质的50穴育苗盘中,于温室中培养约30 d后备用。
菌丝块接种法:供试菌株在25 ℃培养7 d,然后用打孔器在菌落边缘取直径为0.5 cm的菌丝块,将菌丝块接种于离体甘蓝叶片表面,以接种琼脂块的叶片作为对照。接种后的叶片置于托盘内,覆盖保鲜膜保湿,在25 ℃条件下培养3 d,然后观察发病情况。
孢子喷雾法:将供试菌株接种至PDA培养基中,置于25 ℃条件下培养7~10 d,收集分生孢子,使用无菌水调整分生孢子悬浮液中分子孢子含量为1 ml 1×105个。通过喷雾法将孢子悬浮液喷洒在离体甘蓝叶片上,以喷洒无菌水的叶片作为对照。接种后的叶片置于托盘内,覆盖保鲜膜保湿,在25 ℃条件下培养3 d,然后观察发病情况。
1.4 分子生物学鉴定
用灭菌牙签从25 ℃培养10 d左右的PDA平板上刮取菌丝,根据Cenis[10]报道的方法提取菌株基因组DNA。利用目的基因引物对供试菌株的rDNA-ITS、过敏原基因(Alta1)、3-磷酸甘油醛脱氢酶基因(GAPDH)进行PCR扩增(表1)。PCR扩增体系(50 μl):25 μl 2×QuickTaq© HS DyeMix(DTM-101,Toyobo),1 μl基因组DNA,上下游引物各2 μl,20 μl ddH2O。扩增程序,rDNA-ITS:95 ℃预变性3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 40 s,30个循环;最后72 ℃ 7 min。Alta1基因:95 ℃预变性3 min;94 ℃ 30 min,57 ℃ 30 s,72 ℃ 45 s,30个循环;最后72 ℃ 10 min。GAPDH基因:95 ℃预变性3 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,30个循环;最后72 ℃ 10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后,送通用生物(安徽)股份有限公司进行双向测序。获得的目的片段序列经校对后,在NCBI网站进行BLAST检索分析。下载芸薹生链格孢、其他链格孢属成员及番茄匍柄霉的目的基因序列,采用MEGA 7.0软件构建多基因系统发育树。

表1 扩增目的基因所用引物
1.5 病原菌对杀菌剂敏感性测定
采用菌丝生长抑制试验测定病原菌对不同化学药剂的敏感性。供试药剂如下:25%苯醚甲环唑用乳油(EC)稀释(终质量浓度分别为1.000 0 μg/ml、0.500 0 μg/ml、0.250 0 μg/ml、0.125 0 μg/ml、0.062 5 μg/ml);25%丙环唑用乳油(EC)稀释(终质量浓度分别为1.000 0 μg/ml、0.500 0 μg/ml、0.250 0 μg/ml、0.125 0 μg/ml、0.062 5 μg/ml);50%异菌脲用可湿性粉剂(WP)稀释(终质量浓度分别为2.000 μg/ml、1.000 μg/ml、0.500 μg/ml、0.250 μg/ml、0.125 μg/ml);80%代森锰锌用可湿性粉剂(WP)稀释(终质量浓度分别为200.0 μg/ml、100.0 μg/ml、50.0 μg/ml、25.0 μg/ml、12.5 μg/ml);40%氟硅唑用乳油(EC)稀释(终质量浓度分别为1.000 0 μg/ml、0.500 0 μg/ml、0.250 0 μg/ml、0.125 0 μg/ml、0.062 5 μg/ml);50%咯菌腈用可湿性粉剂(WP)稀释(终质量浓度分别为1.000 0 μg/ml、0.500 0 μg/ml、0.250 0 μg/ml、0.125 0 μg/ml、0.062 5 μg/ml);45%戊唑醇用悬浮剂(SC)稀释(终质量浓度分别为1.000 0 μg/ml、0.500 0 μg/ml、0.250 0 μg/ml、0.125 0 μg/ml、0.062 5 μg/ml);40%己唑醇用悬浮剂(SC)稀释(终质量浓度分别为1.000 0 μg/ml、0.500 0 μg/ml、0.250 0 μg/ml、0.125 0 μg/ml、0.062 5 μg/ml)。
菌丝生长抑制测定:将直径为0.5 cm的菌块分别接种到含杀菌剂PDA平板和不含杀菌剂但含等量稀释溶剂的PDA平板(对照)上。每个处理重复4次。接种后的PDA平板置于25 ℃恒温培养箱中培养7 d,然后以十字交叉法测量各处理的菌落直径,求出菌落直径平均值,并计算抑制率。菌丝生长抑制率=(对照菌丝生长直径-不同杀菌剂下的菌丝生长直径)/(对照菌丝生长直径-0.5 cm)×100%。
使用SPSS Statistics 20,对以10为底数的杀菌剂质量浓度的对数值(x)和对应的菌丝生长抑制率(Y)进行回归分析,求出毒力回归方程(Y=ax+b)和有效抑制中浓度(EC50)。
2 结果与分析
2.1 甘蓝黑斑病田间典型症状
田间调查发现,甘蓝植株下部叶片发病最为频繁,同时叶球部分也有发病。发病初期形成圆形褪绿斑,随着病情进一步发展,病斑逐渐扩大变黑,四周伴有黄色晕圈,后期病斑转为淡褐色且带有同心轮纹,湿度高时可见黑褐色霉状菌丝,病斑部分有时破裂或穿孔,严重时病斑汇集成块,叶片大面积枯死,全株叶片由外向内干枯(图1)。

图1 甘蓝黑斑病田间症状Fig.1 Symptoms of cabbage black spot in the field
2.2 病原菌分离
采用组织分离法对甘蓝病叶进行病原分离和纯化,共得到6个菌株,利用显微镜观察菌丝产孢形态及孢子形态(图2)。6个菌株菌落形态和分生孢子形态的具体描述见表2。HB1、HB3、HB6菌落和分生孢子形态相似但孢子大小略有差异,其他3个菌株的菌落和分生孢子形态差异明显。

图2 分离获得的6个病原菌的形态学特征Fig.2 Morphological characteristics of six pathogens
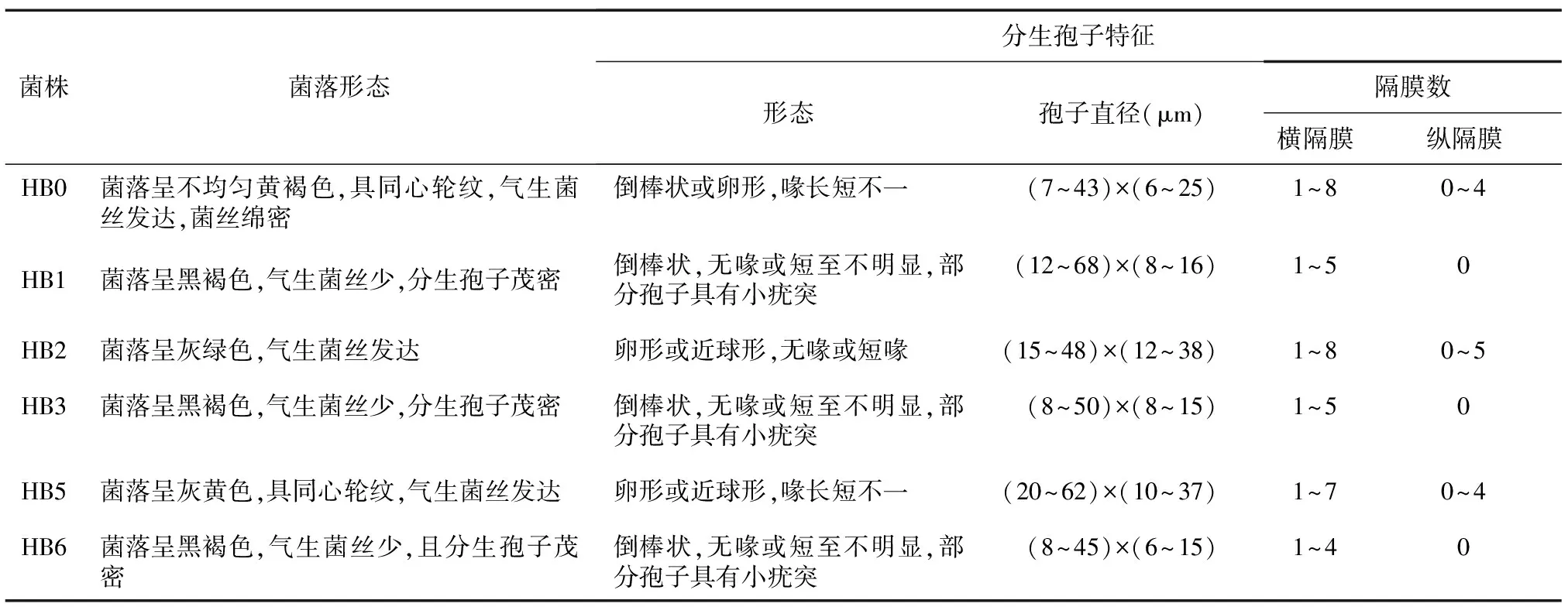
表2 6个病原菌菌株的形态学比较
2.3 病原菌的致病性
参照科赫氏法则测试分离病原菌的致病性。通过菌丝块法及孢子喷雾法接种甘蓝离体叶片发现,在分离的菌株中,仅有HB1、HB3、HB6能在甘蓝叶片上致病(图3)。与对照相比,接种上述3个菌株菌丝块的叶片黄化严重,有时可见霉层,且病斑部分易破裂(图3);通过喷雾法接种孢子3 d后,叶片表面密布水渍状小病斑,病斑周围黄化,与田间甘蓝黑斑病初期症状一致(图3)。

图3 分离获得的甘蓝黑斑病病原菌的致病性Fig.3 Pathogenicity of the pathogens causing cabbage black spot
2.4 分子生物学鉴定及序列分析
在形态学初步鉴定的基础上,结合分子鉴定技术进一步明确分离得到的黑斑病病原菌的分类地位。基于形态学鉴定及致病性测定,确定HB1、HB3、HB6为病原菌,以HB1、HB3、HB6的基因组DNA为模板,分别扩增rDNA-ITS、Alta1、GAPDH基因,经测序获得rDNA-ITS长度分别为578 bp、587 bp、587 bp,Alta1长度分别为516 bp、511 bp、518 bp,GAPDH长度分别为595 bp、595 bp、596 bp的目的片段。将3个菌株的目的片段序列在NCBI网站进行BLAST检索分析,结果显示供试菌株的目的片段与芸薹生链格孢菌株具有很高的序列相似性(99.63%~100.00%)。下载芸薹生链格孢及其他链格孢属成员的目的基因序列(表3),按照首尾相连方法将上述序列拼接后进行分析。以番茄匍柄霉为外群,采用MEGA7.0软件中的最大似然法(Maximum likelihood)构建多基因系统发育树,以Bootstrap进行1 000次重复检验,估算分支的自展支持率,分析供试菌株与其近缘种菌株的亲缘关系,确定其分类地位。如图4所示,本研究中获得的3个菌株与芸薹生链格孢的2个参考菌株紧密聚类在一起,自展支持率为100%。综合致病性测定结果以及病原菌形态特征,结合多基因序列联合分析,最终确定分离得到的甘蓝黑斑病病原菌为芸薹生链格孢。
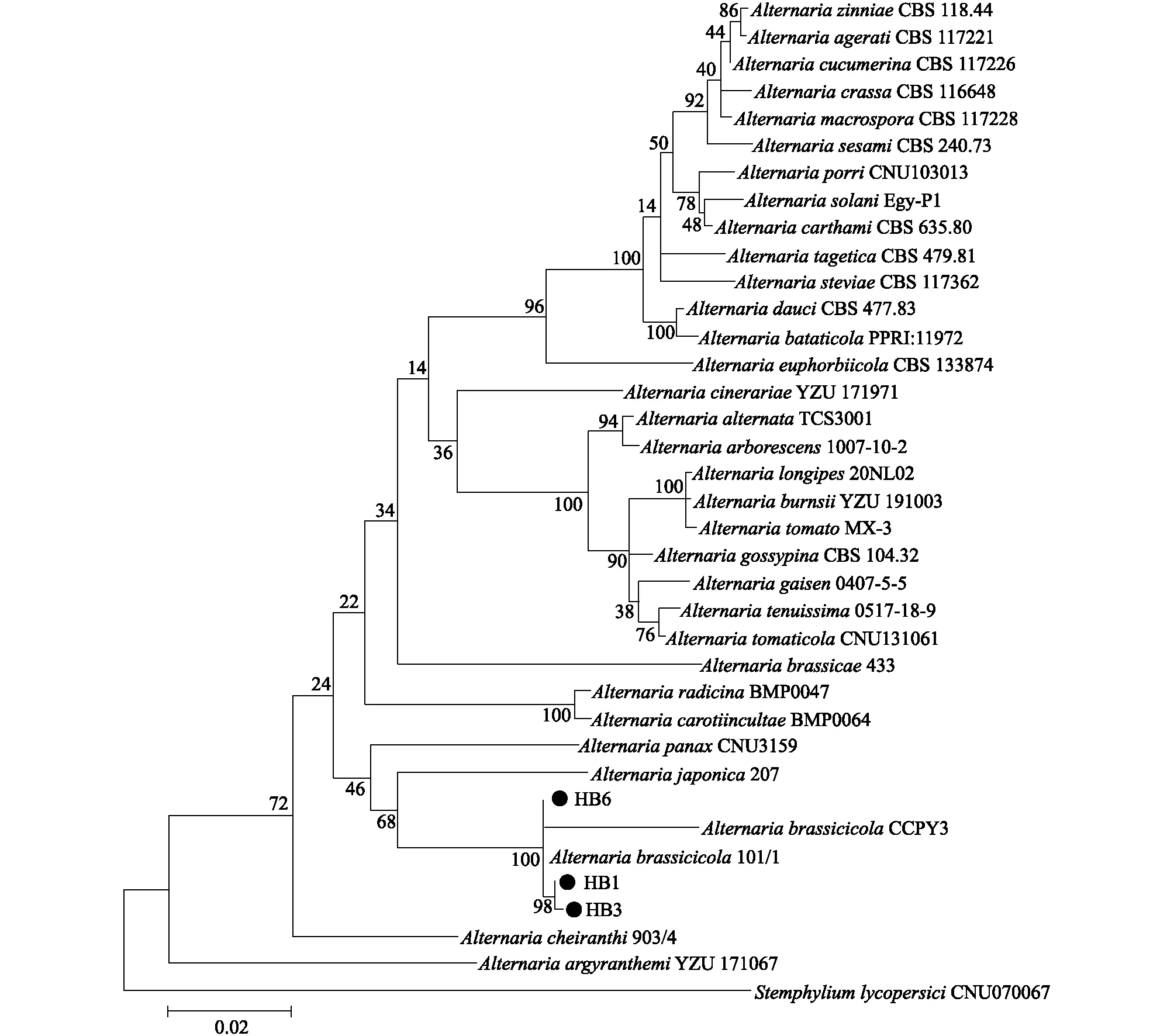
节点处仅显示大于50%的自展支持率,黑色圆圈标示处为供试菌株。图4 基于rDNA-ITS、Alt a1、GAPDH的多序列联合聚类分析Fig.4 Phylogenetic analysis based on rDNA-ITS, Alt a1, GAPDH
表3 聚类分析所用的参考菌株及其目的基因和核糖体DNA内转录间隔区(rDNA-ITS) GenBank登录号
2.5 病原菌对杀菌剂的敏感性
采用菌丝生长抑制法测试8种杀菌剂对供试菌株HB1的毒力。结果显示,苯醚甲环唑、咯菌腈、己唑醇、氟硅唑、戊唑醇、丙环唑、异菌脲对供试菌株的抑制效果较好,EC50分别为0.037 μg/ml、0.039 μg/ml、0.064 μg/ml、0.134 μg/ml、0.175 μg/ml、0.263 μg/ml、0.641 μg/ml,对供试菌株的抑制效果最弱的药剂为代森锰锌,其EC50为280.101 μg/ml(表4)。
3 讨 论
链格孢属真菌种类多且分类复杂[14-17],目前已有记录的就有300多种[7],随着高通量测序技术的快速发展,越来越多的真菌基因组相继被报道,这也为多序列联合分析提供了极大便利。基于168个链格孢属真菌菌株的Alta1、GAPDH、内聚半乳糖醛酸酶基因(endoPG)、rDNA-ITS、翻译延伸因子1-alpha基因(TEF1)、RNA聚合酶II亚基基因(RPB2)和一个匿名基因区域OPA10-2的序列,Woudenberg等[18]构建了链格孢属真菌系统发育树。在其他植物黑斑病的病原菌鉴定方面,研究人员在rDNA-ITS的基础上,联用Alta1、三磷酸腺苷酶基因(ATPase)、钙调蛋白基因(CAL)、GAPDH、RPB2、TEF1中的部分基因,明确了大麻黑斑病[19]、香蕉黑斑病[20]、甜瓜黑斑病[21]的病原菌。本研究通过rDNA-ITS、Alta1、GAPDH序列联合分析发现,致病菌株HB1、HB3、HB6与2个芸薹生链格孢参考菌株紧密聚在一起,综合致病性测定结果以及病原菌形态特征,确定从甘蓝病叶中分离到的黑斑病病原菌为芸薹生链格孢。鉴于引起十字花科黑斑病的链格孢属真菌的种群组成复杂[22],后续将进一步对江苏省其他地区的甘蓝黑斑病病样进行病原菌分离鉴定,借以探明江苏省甘蓝黑斑病的致病菌组成。
如何有效防治链格孢属真菌引起的黑斑病是当前蔬菜生产上面临的难题,目前十字花科芸薹属栽培种中缺乏高抗黑斑病的材料,只在亚麻荠(Camelinasativa)、荠菜(Capsellabursa-pastoris)等其他十字花科植物中发现了一些抗性较好的种质资源[23]。化学防治仍然是目前十字花科作物黑斑病防控的重要手段。本研究结果表明,苯醚甲环唑、咯菌腈、己唑醇、氟硅唑、戊唑醇、丙环唑、异菌脲对甘蓝黑斑病病原菌的抑制作用较强。前人研究结果表明,丙环唑、苯醚甲环唑、己唑醇对引起秋葵黑斑病的链格孢具有较好的抑制效果[24];咪鲜胺、异菌脲、戊唑醇对引起核桃黑斑病的链格孢有较好抑制作用[25];戊唑醇和苯醚甲环唑这两种三唑类药剂对白菜黑斑病的芸薹链格孢的抑制效果较好[26];苯醚甲环唑对三七黑斑病病原菌(Alternariapanax)的菌丝生长抑制效果明显[27];丙环唑对导致芥菜黑斑病的芸薹链格孢的抑制效果较好[28];咯菌腈和异菌脲对引起月季黑斑病的链格孢的抑制作用较强[29]。从以上研究结果可以看出,在测试的化学药剂中,苯醚甲环唑和戊唑醇为代表的三唑类、咯菌腈为代表的苯基吡咯类、异菌脲为代表的二甲酰亚胺类杀菌剂对黑斑病病原菌的菌丝生长抑制效果总体较好。但也有报道,异菌脲对三七黑斑病病原菌的菌丝生长抑制效果较差[27];戊唑醇和异菌脲对引起芍药黑斑病的链格孢的抑制作用较差[30]。因此,针对链格孢属真菌引起的不同植物的黑斑病,需要筛选和匹配合适的杀菌剂,才能达到较好防治效果。由于本研究筛选的药剂主要来自室内毒力测定试验结果,后续需要室外试验来进一步检验。
