广东联盟中成药集采品种质量评价标准研究Δ
2023-09-14陈举亮林慧芸胡紫微广州中医药大学第二附属医院广东省中医院药学部广州510120广东省中医院珠海医院药剂科广东珠海519000
陈举亮 ,张 慧 ,林慧芸 ,胡紫微 (1.广州中医药大学第二附属医院/广东省中医院药学部,广州 510120;2.广东省中医院珠海医院药剂科,广东 珠海 519000)
国家药品集中带量采购(简称“集采”)政策作为深化医药卫生体制改革的重要举措,自实施以来大大降低了患者药品费用负担,增加了医疗机构医保结余留用资金,促进了医药行业健康发展[1]。目前已有7 批药品纳入国家药品集采范围,但主要涉及化学药品种。中医药是中华传统文化的瑰宝,随着药品集采工作常态化和制度化的开展,各省份也逐渐开启了中成药集采工作的探索。2021 年12 月广东省药品交易中心发布了《广东联盟清开灵等中成药集中带量采购文件》,并于2022 年4月公布了《广东联盟清开灵等中成药集中带量采购拟中选/备选结果》,标志着包括广东省在内的多省份中成药集采工作正式拉开帷幕。
2021年1月国务院办公厅发布的《关于推动药品集中带量采购工作常态化制度化开展的意见》提到“集中采购的原则是质量优先”[2];2021 年8 月发布的《国家医疗保障局对十三届全国人大四次会议第4126 号建议的答复》也明确表示“中成药集中采购需要先完善其质量评价标准,坚持质量优先”[3]。在前期化学药的集采中,保障质量的方式是优先纳入已通过仿制药一致性评价的品种。然而,中成药目前并未进行类似的一致性评价,同时由于中药的特殊性,以《中国药典》为代表的法定标准体系也只能判断产品“合格”与否,无法区分“优劣”,市场上“合格劣质”的中成药大量存在。因此,在中成药集采执行过程中,如何把控入围产品的质量成为重中之重。
遗憾的是,在广东联盟发布的中成药集采方案中,首先对各品种进行分组分类,然后根据厂家的报价或降幅来确定中选品种[4],在中选规则中价格因素占主导地位,产品的质量和疗效属性并未充分体现,在实际执行过程中可能存在中标结果与药品质量、疗效脱钩的风险。一方面,在前期产品竞标博弈中,部分生产企业为获得中选资格,已将价格压低至逼近成本价,中选后面临中药材、中药饮片等原料价格大幅上涨的市场环境,为保证获益,厂家难免采用低价的劣质中药饮片进行投料生产,最终影响患者使用中成药的疗效和安全性。另一方面,激烈的价格竞争使得一些大型知名的生产企业落选和退出,部分原本在医疗机构认可度较高的高质量产品逐渐沦为市场“配角”。若中选产品为医疗机构过去未曾使用过的品种,则临床医生在选用时很可能对该品种的质量和疗效存在疑虑。降低价格是集采的主要目的,但药品质量与生命安全息息相关,如果仅重视价格而忽略质量,则违背了药品集采的初衷。为了确保中成药集采“降价不降质”,“低价中标”必须基于一定的产品质量。
综上,本研究旨在构建一套覆盖中成药从生产加工到临床使用全生命周期的质量评价标准,用于中成药集采品种的综合质量评价。该标准是对广东联盟中成药集采方案的有益补充,有望解决中成药集采的质量困局,助力中成药集采政策加速推进。
1 评价标准框架结构的制定
本研究在制定中成药综合质量评价标准过程中,选择评价指标主要遵循以下基本原则——科学性:遵循传统中医药理论与实践特点;专属性:考虑中成药在理论来源、药效机制、原材料选择、生产加工、制剂工艺等方面的独特性,设置区别于化学药的特色指标;综合性:质量考察指标选择全面,涵盖中成药从生产到使用的全过程,可多角度反映质量;可操作性:评价数据容易获得,便于快速得出评价结果,适合大范围推广应用;客观性:评价结果以量化方式呈现,精准反映不同品种的质量差异。在评价方法上,本研究采用文献调研法,结合德尔菲法确定质量评价标准的框架体系结构,最后将定性分析与定量分析相结合,应用层次分析法确定各级指标的权重和分值。参与讨论的专家涉及多个行业领域,具有多学科背景,包括医疗机构决策层人员、药学管理和采购人员、中西医临床医生和临床药师、卫生健康和药品监督管理等行政部门人员、药学政策研究专家、药品生产企业管理层人员以及科研院所和高校从事统计学、卫生经济学和循证医学研究的知名学者。结合中成药集采中各方最关注的质量相关因素,本研究最终确定生产过程和药效评估为考察中成药质量的两大维度,围绕这2 个一级维度,进一步构建包含8 个二级维度和31 个三级指标的多角度、多层次的集采中成药质量评价体系,具体质量评价标准框架见图1。
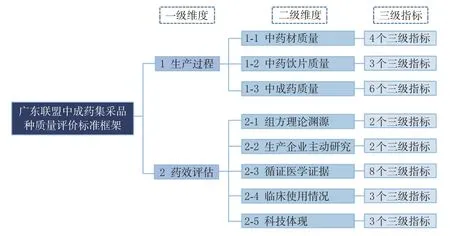
图1 广东联盟中成药集采品种质量评价标准框架图
2 生产过程维度评价指标的制定
中成药是以中药材为原料,在中医药理论指导下,因预防及治疗疾病的需要,按规定的处方和制剂工艺加工制成一定剂型的中药制品,如各种丸剂、散剂、冲剂等。根据“中药质量源于设计”的理念,中成药的质量形成于生产过程,并在整个生命周期中得以优化和提升[5]。中成药的生产经历了中药材(原材料)→中药饮片(中间品)→中成药(成品)的过程,每一步的质量控制均影响着最终产品的质量优劣。因此,本研究从生产过程维度对中成药的质量进行评价,选择中药材质量、中药饮片质量和中成药质量作为评价的二级维度,评价指标覆盖中成药从源头到成品的整个生命链条。
2.1 中药材质量
中药材是中药饮片和中成药的起始原料,是中药产业链的最前端,因此中药材的质量是中成药质量的源头和首要保障。依据中药材在种植、采收、生产、加工等过程中的质量关键影响因素,中药材质量的评价共设置4个指标:基原清晰、道地药材、规范化生产和质量检验。
基原清晰针对来源于几种不同近缘物种或非近缘物种,但常作为同一种中药使用的中药材。不同基原中药的化学成分和物质基础可能存在差异,影响临床疗效。例如,贝母是典型的多基原药材,其中川贝母在2020 年版《中国药典》中收载的来源有6 个基原。研究表明不同基原的川贝母,其主要有效成分生物碱的含量存在明显差异[6]。因此,多基原的中药材应经过明确的物种鉴定,并根据制剂的要求固定药材基原。
“道地药材”是公认的优质中药材代名词,得益于优良的种质资源、适宜的生态环境和规范的生产加工技术,产自道地产区的药材通常具有更优的品质和更好的临床疗效[7]。例如,云南的三七、四川的附子、辽宁的细辛、河南的地黄和山药等。因此,本研究将“是否为道地药材”纳入评价指标,可在一定程度上反映药材的质量。
规范化生产是指在药材的种植过程中实行标准化和规范化管理。为了缓解中药资源紧缺的问题,一些常用大宗药材如人参、黄芪、贝母、元胡等多为人工种植,规范化的种植生产是药材质量稳定与安全的重要保障。《“十四五”中医药发展规划》明确提出“健全中药材种植养殖、仓储、物流、初加工规范标准体系。鼓励中药材产业化、商品化和适度规模化发展,推进中药材规范化种植、养殖”[8]。《中药材生产质量管理规范》(good agricultural practice for Chinese crude drug,GAP)是生产企业进行规范化生产的技术指导原则,优质的中药材应符合GAP要求。
质量检验是对中药材质量进行把关的重要环节,参照的标准包括《中国药典》、部颁标准、局颁标准和地方中药材标准等。事实上,由于中药材的农产品属性,目前大多数药材由药农种植,再由收购商收购,转卖给中药饮片或中成药生产企业,这一过程中并未进行质量检验,导致药材质量良莠不齐。因此,本研究将质量检验合格报告纳入中药材质量评价指标,以鼓励中成药生产企业选用经中药材种植企业规范化种植并检验合格的中药材作为原材料,保障产品质量。
2.2 中药饮片质量
中药饮片系指药材经过炮制后可直接用于中医临床或中成药制剂生产使用的药品。中药饮片的质量是中成药质量的基础,对于中成药疗效具有决定性的作用。中药饮片质量的评价主要包括3个指标:炮制规范、产业化和规模化程度、规格等级。
中药炮制是极具中医药特色的一项传统制药技术,是中药减毒增效临床实践的精华。规范的炮制工艺是稳定中药饮片质量的前提,不规范的炮制必然会影响中药饮片的临床疗效,甚至安全性。优质中成药的生产企业,应能提供所用中药饮片的清晰炮制过程和所参照的炮制规范文件,如《全国中药饮片炮制规范》、地方(省级)炮制规范等。
中药饮片生产的产业化和规模化程度在一定程度上影响着饮片的质量。近年来虽然国家大力推行《药品生产质量管理规范》(good manufacturing practice for drugs,GMP),但依然存在大量以“作坊式”生产为主的小型饮片生产企业,其生产设备不配套,难以形成规范化和规模化生产线,存在中药饮片质量把控不到位的风险。因此,本研究将是否配备规模化生产线以及是否符合GMP 要求纳入评价指标,以衡量中药饮片生产企业的产业化和规模化水平。
规格等级是反映中药饮片质量的一个重要指标,划分原则通常是在规格下根据中药饮片属性的连续性特征列出不同等级,如按外观特征、断面特征、质地、厚度、直径、含杂率、气味等进行区分[9],规格等级越低,表示质量越好。
2.3 中成药质量
中成药作为生产过程的最终产品,其质量主要以6个指标进行考察:药用辅料、生产规范、技术工艺、安全风险控制、产品质量一致性和质量标准参照。
中成药的药用辅料应经过优选。中成药许多不良反应与辅料有关,例如:鱼腥草注射液的严重不良反应与聚山梨酯80相关[10];抑菌剂苯甲酸钠能诱发相关性水肿和急性荨麻疹[11];甜味剂阿斯巴甜可致儿童头痛或癫痫[12]。因此,为保证用药安全,中成药生产企业应重视药用辅料的选择和安全性研究。
生产规范指中成药生产过程中各个环节均应符合质量管理规范,包括GMP、《药品经营质量管理规范》(good supplying practice for drugs,GSP)及各种规范配套的技术操作规范(standard operating procedures,SOP)等。优质中成药的生产企业还应对各种规范文件进行及时更新和完善。
中成药生产最常用的加工工艺包括提取、分离、浓缩和干燥等,这些环节的技术水平高低直接影响着有效物质浓度的高低,关乎最终产品的疗效。为了保证中成药质量,生产车间应具有较高的工艺技术水平,配备自动化生产体系,并且在一定程度上应用新辅料、新技术和新设备等。此外,有能力的中成药生产企业应使用信息化手段进行工艺技术的精细化管理[13]。
安全风险控制是保证产品安全性的重要环节。首先,处方中含有毒药味的中成药,要求毒性成分明确且限量合理;其次,须有效控制重金属及有害元素、农药残留等外源性污染物的限量;最后,药品说明书中的安全信息,如药物不良反应、毒性成分、药物相互作用、特殊人群用药等,应当标示得详细清晰,以降低患者的用药风险。
产品质量一致性是疗效一致性的前提条件。中成药组方复杂,较多的生产步骤容易放大药品之间的差异性,最终导致临床疗效差异。优质的中成药应该具有良好的一致性,包括批内一致性、批间一致性、有效期内一致性,其中重点是有效成分的含量范围和指纹图谱要一致[14]。
质量标准参照是指对生产的最终中成药产品进行质量检验所参照的标准。《中国药典》是国家充分考虑全国各地药品生产企业的实际情况和水平差异所制定的法定标准,是药品质量的底线。为了保证产品的优质性,中成药生产企业应制定高于法定标准的内控标准,在产品出厂时对中成药质量严格把关。
3 药效评估维度评价指标的制定
在中成药集采的执行中,除价格外,药效如何是医疗机构进行采购决策时的首要考虑因素。优质的中成药品种应该具有确切的药效。在本研究的质量评价体系中,药效评估维度共设置5 个二级维度:组方理论渊源、生产企业主动研究、循证医学证据、临床使用情况和科技体现,从多个角度对集采的中成药品种进行全面、综合的药效评估。
3.1 组方理论渊源
中成药的形成深深扎根于中医药理论的土壤,这是其区别于化学药的最大特点,因此本评价体系围绕理论渊源设置了中成药特色性评价指标。组方理论渊源的评价包括2个三级指标:理论来源和组方原理。
理论来源是指中成药处方的中医理论来源和出处,如来源属于古代经典名方、经典古籍或名家经验等。《伤寒论》《金匮要略》等经典医书中的中药古方剂是我国历代医药学家经过千百年医疗实践创造、总结的经典方剂,应用历史悠久、经验证据充分,其有效性已经过了大量实践的检验。
组方原理是指中成药处方各药味配伍成方的原理,反映了组方的科学有效性。若中成药处方中君、臣、佐、使各组分在处方中的作用和地位以及相互关系已清晰揭示,并从药理效应、物质基础、药动学及其影响因素等方面阐明组方原理,则可认为该中成药药效确切。
3.2 生产企业主动研究
不同中成药品种疗效的侧重点不同,由此形成的产品差异化是生产企业制定市场推广策略的重要依据,只有疗效确切且不良反应少的优势品种才能在中成药集采的市场竞争中脱颖而出,因此中成药生产企业应主动开展充分的药效研究。本研究对生产企业主动研究的评价设置2个三级指标:中成药研发阶段的药效研究和上市后的有效性再评价。
生产企业在中成药研发阶段的药效研究主要包括溶出度试验和生物等效性试验。溶出度试验主要通过考察固体中成药在体外的溶出行为是否一致来间接判断临床疗效是否一致。生物等效性试验是以药物的生物效应或活性评价为基础,利用整体动物、离体组织、器官、微生物和细胞以及相关生物因子等作为试验体系来评价药物的有效性[15]。
由于药品上市前研究的局限性,许多中成药并未进行充分的临床试验研究,因此上市后的有效性再评价情况将成为中成药疗效的重要支撑。生产企业作为药品上市后再评价的主体,有责任和义务对其生产的中成药开展上市后的有效性再评价,因此本评价标准对主动开展有效性再评价研究的生产企业,在产品药效指标上赋予更高的分数。药品上市后,有效性再评价的主要内容应包括对药品已经批准的适应证、新适应证以及特殊人群进行研究,以补充其有效性数据,从而对药品上市后的疗效进行再次评价[16]。
3.3 循证医学证据
循证医学是考察药品临床使用效果、进行实际治疗有效性评价的重要方法,因此本研究将循证医学证据作为中成药药效评估的二维指标之一。循证医学证据应源于当前可获得的质量最优的相关研究证据,包括原始研究证据和二次整合后的证据[17—18]。这一维度下共设置8 个三级指标,包括:(1)临床指南——指由国家中医药管理局、中华医学会、中华中医药学会、中国医师协会、《中成药治疗优势病种临床应用指南》标准化项目组等权威组织发布的临床指南,指南中的推荐级别和证据等级越高,此项指标得分越高;(2)专家共识——指由各专业学会编写的专家共识;(3)系统评价/Meta分析;(4)卫生技术评估报告;(5)随机对照试验;(6)病例研究;(7)队列研究;(8)个案报告。
3.4 临床使用情况
此前由湖北牵头的19省份联盟中成药集采,入围品种的综合评分中引入了医疗机构认可度指标,由联盟地区19个省份所有二级及以上医疗机构(共2.4万余家)参与评价[19],中标结果既体现了医疗机构的临床认可度,又提高了中成药质量与疗效评分的公信力。然而,广东联盟中成药集采并未引入类似的评价机制,因此本研究借鉴湖北联盟的成功经验,在质量评价标准中补充此项,设置对临床使用情况的评价,指标分别涉及医生认可度、患者认可度和市场广泛度3个方面,通过医患的反馈和市场销量反映待评中成药品种的疗效。
3.5 科技体现
优质的中成药生产企业必定会在围绕品种的品牌建设和科技体现方面发力。科技体现不仅可间接反映该中成药的有效性,同时能够促进科技成果的转化,提升中成药产品的科学价值、临床价值与市场价值,为中成药的临床合理应用提供依据。科技体现维度的评价包含3个三级指标:品种授权专利、获得奖项和国家中药保护。
品种授权专利指围绕某一具体中成药品种的国家授权发明专利,是中成药生产企业自主科技创新能力的体现。专利内容包括制剂的制备方法、质量控制关键技术、创新工艺、有效成分的含量测定方法、中药指纹图谱等。
中成药品种的获奖情况,既展现了其生产企业高质量发展的强劲动力,同时也是对产品质量和疗效的充分肯定。此项指标中,纳入评分的获奖情况包括含金量和行业内认可度较高的国家级、省部级奖项,例如国家科学技术进步奖、中国发明协会发明创业奖等。
国家中药保护是由国家对质量稳定、疗效确切的中药品种实行的分级保护,包括国家秘密保护、中药品种保护等。根据《中药品种保护条例》[20],申请中药一级保护品种要求“对特定疾病有特殊疗效”,申请中药二级保护品种要求“对特定疾病有显著疗效”。因此,如果某生产企业的中成药品种已成功申请国家中药保护,其保护级别可在一定程度上反映有效性。
4 评分细则的制定
为使质量评价结果具有良好的可操作性,本评价体系为各评价指标设置了评分细则,尽量避免因评价人员主观因素而导致的评价结果差异。同时,为了量化评价结果,更直观地呈现不同厂家生产的中成药产品的质量差异,每个一级维度、二级维度和三级指标均被赋予相应分值,分值的大小依据指标的重要性设置,中成药产品在各个具体指标上的得分高低可在一定程度上反映厂家质量控制的薄弱环节。
每个中成药品种的质量总分为100分。由于生产过程的严格把控是产品具有良好疗效的先决条件,因此本评价体系对生产过程这一维度赋予更大的比重,旨在引导中成药生产企业重视质量的源头控制。2个一级维度生产过程和药效评估,赋分占比为6∶4。生产过程总分为60分,重点考察中成药生产企业在整个生产链条中的质量控制情况。药效评估维度总分为40分,重点考察中成药对疾病治疗的有效性。由于中成药几乎都为复方制剂,处方中包含多种药味,因此三级指标中的分值为所有药味的总分值,实际得分将按照以下计算方式进行折算:指标得分=(处方中满足条件的药味数/总药味数)×指标分值。此外,本评价标准还根据市场实际情况和医疗机构实际用药情况设立了“负分”机制,对出现质量负面事件的中成药品种进行扣分。质量负面事件包括质量抽检不合格、在国家药品不良反应监测报告中出现、医疗机构反馈的其他质量问题等。根据总得分将参评中成药品种的质量分为3个等级,80分(含)以上为优等,50~<80 分为中等,50 分以下为差等。各个指标的具体评分细则见表1。
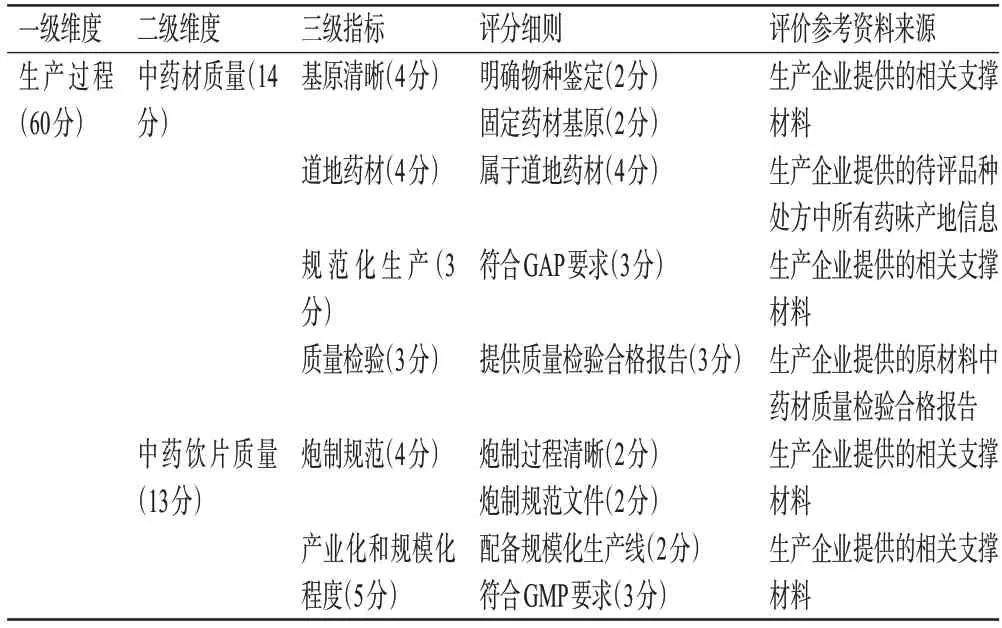
表1 中成药集采品种质量评价标准评分细则
5 结语
广东联盟中成药集采是中成药集采政策落地的一次有益探索,但集采文件中的规则设置仍有部分未尽之处,本研究从国家中成药集采要“坚持质量优先”的政策导向出发,立足中成药临床使用过程中各方最关注的质量与疗效问题,构建了中成药集采品种质量评价的体系与标准。本评价体系包含生产过程和药效评估两大维度,其中生产过程维度针对中成药从中药材、中药饮片到中成药全链条的各个环节均设置了质量追踪指标,全面体现了中成药的质量控制;药效评估维度从理论渊源、临床使用、企业研究、科技体现等方面多角度地评估了中成药的疗效。本研究构建的质量评价标准有望为“基于一定质量的低价中标”中成药集采方案提供理论和数据支撑。笔者认为,在广东联盟中成药集采现有规则的基础上,强化产品的质量属性,将中成药的质量评分结果与价格竞争及其他因素相结合,综合评价确定集采入围和中选品种,不仅符合国家有关集采政策的精神,也能为医疗机构制定中成药集采决策提供参考。
在下一步研究中,笔者团队将根据建立的质量评价标准对《广东联盟清开灵等中成药集中带量采购拟中选/备选结果》中的部分品种展开质量评价,并发表质量分析研究报告。本研究建立的质量评价标准尚有许多不足之处,未来将在实践中不断优化调整,并根据中医药学科发展方向和行业专家学者建议进行更新和补充,以期形成一套科学、完善、可复制、可推广的中成药质量评价方案。
