术前系统免疫炎症指数和γ-谷氨酰转肽酶与肝癌患者临床病理特征及预后的相关性
2023-09-14柳科军
刘 迪,柳科军,卜 阳
肝细胞癌(HCC)的发病率在世界范围内呈上升趋势,目前已居于恶性肿瘤发病率第5位,死亡率居第3位[1]。早期准确预测HCC患者的预后对优化肝癌诊疗策略和延长生存时间至关重要,肿瘤TNM分期作为预测HCC患者生存预后的经典评价指标具有明显的滞后性,临床亟须更多敏感且可靠的预后指标来监测HCC的进展与评估患者的生存预后情况。HCC的发生及发展受到肿瘤微环境及机体抗肿瘤免疫反应的影响,其中炎症反应能够诱导肿瘤细胞的激活增殖、促进免疫逃逸、抵抗细胞凋亡及侵袭转移[2]。系统免疫炎症指数(SII)是由血小板、中性粒细胞和淋巴细胞计数计算得出的,能够更好地综合反映肿瘤患者的局部免疫状态与全身炎症反应的关系[3]。SII在消化道肿瘤的诊断和预后中具有重要预测意义[4]。肝脏中γ-谷氨酰转肽酶(γ-GGT)主要参与机体的氧化应激反应和细胞外谷胱甘肽合成与代谢[5]。而在严重的肝脏炎症、肝硬化及晚期肿瘤中,血清γ-GGT升高与疾病进展及不良预后也具有正相关性[6]。在临床工作中,肿瘤患者免疫状态及肝功能是影响诊疗效果和预后的重要因素。同理,针对HCC患者,综合评估其全身炎症状态和肝功能,可能更有利于准确预测其疾病预后,并有助于为个体化治疗提供精准方案。为此,本研究旨在探讨SII联合γ-GGT与肝癌患者临床病理特征和预后的相关性,期望为准确评估肝癌患者生存预后提供更多、更为可靠的临床依据。
1 资料与方法
1.1 一般资料:收集2013年1月至2019年9月宁夏医科大学总医院收治HCC患者的临床资料,并进行回顾性分析。纳入研究的患者共213例,其中,男性166例,女性47例;年龄分布为23~82岁,平均年龄为(52.65±9.72)岁。
1.1.1 纳入标准:①患者为初次就诊,经手术(肝癌根治性切除术)切除标本病理检查证实为肝细胞癌;②年龄>18岁者;③患者术前未接受抗肿瘤治疗;④患者术前检查未见淋巴结转移或远处转移;⑤患者术前肝功能Child-Pugh分级为A级或B级者;⑥随访资料完整者。
1.1.2 排除标准:①患免疫系统、血液系统疾病者;②入院前6个月内有大手术史者;③合并其他部位的恶性肿瘤者;④患严重心脑血管疾病者(例如心肌梗死、脑梗死等)。
1.2 方法
1.2.1 数据收集:利用宁夏医科大学总医院电子病历管理系统收集患者的一般临床资料、病理资料和实验室检查数据。根据术前血常规检测结果计算SII值,计算公式为SII =血小板计数(×109/L)×中性粒细胞计数(×109/L)/淋巴细胞计数(×109/L)。本研究将腹部增强CT或腹部磁共振成像明确显示肝内存在新发肿瘤病灶或于其他系统内发现新的肿瘤转移病灶的情况称作肝癌术后复发。而将从手术当天起一年时间内,经相关影像学检查发现肝内具有新发肿瘤病灶的情形定义为肝癌术后肝内肿瘤早期复发。
1.2.2 随访:对纳入研究的患者进行术后定期随访,记录患者影像学检查、实验室检查等结果。随访终止日期为2022年12月31日。患者术后生存时间从手术时间开始算起,到患者死亡时间或末次随访时间为止。
1.3 统计学方法:采用SPSS 22.0统计软件,计数资料以频数表示,比较采用χ2检验。根据患者的生存状态,利用ROC曲线确定SII和γ-GGT分组的最佳临界值。采用Spearman分析术前SII和γ-GGT与肝癌患者临床病理相关性。采用Kaplan-Meier法绘制生存曲线,组间差异比较采用Log-rank检验。采用Cox比例风险模型评估不同因素影响患者预后的价值,以P<0.05为差异有统计学意义。
2 结果
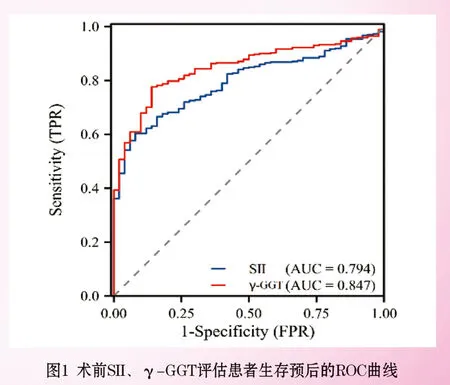
2.1 术前SII、γ-谷氨酰转肽酶临界值的确定:SII的ROC曲线下面积为0.794(95%CI:0.745~0.844),P<0.05,γ-GGT的ROC曲线下面积为0.847(95%CI:0.803~0.891),P<0.05。根据ROC曲线计算出SII和γ-GGT的最佳临界值分别为194.38和40.50,见图1(封三)。根据最佳临界值,分为低SII组(SII≤194.38,n=89)和高SII组(SII>194.38,n=124),以及低γ-GGT组(γ-GGT≤40.50,n=90)和高γ-GGT组(γ-GGT>40.50,n=123)。
2.2 术前SII和γ-GGT与肝癌患者临床病理特征的关系:如表1、表2所示,低SII组与高SII组在性别、吸烟史、饮酒史、白蛋白水平及病理分型上比较差异无统计学意义(P>0.05),但高SII组的T分期、N分期较低SII组晚,肿瘤肝内早期复发率较低SII组高,差异有统计学意义(P<0.05)。与低γ-GGT组比较,高γ-GGT组的TNM分期较晚,肿瘤肝内早期复发率高,差异无统计学意义(P>0.05)。2组患者之间的其他病理特征比较,差异无统计学意义(P>0.05)。
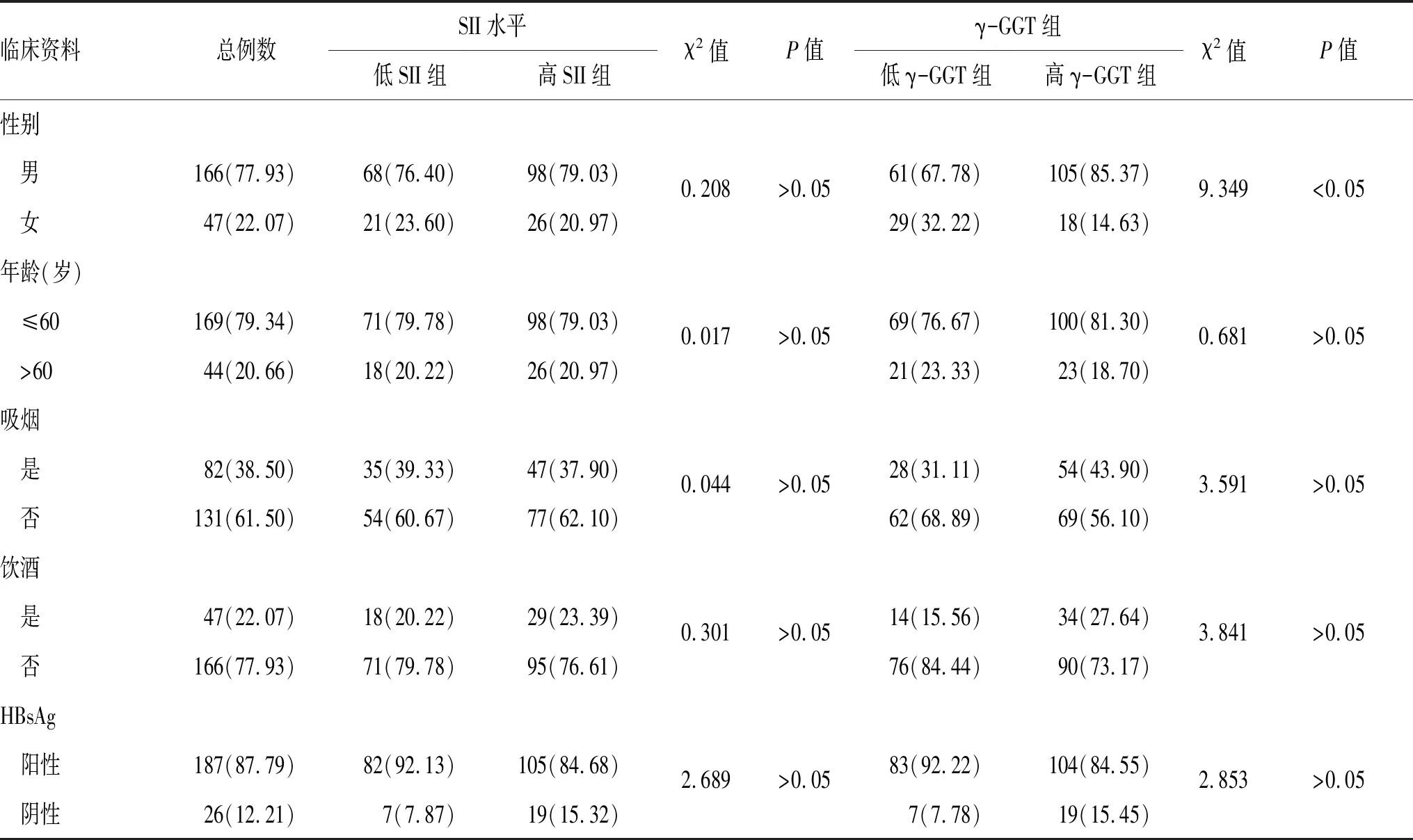
表1 术前SII和γ-GGT与肝癌患者一般临床资料的关系[n(%)]
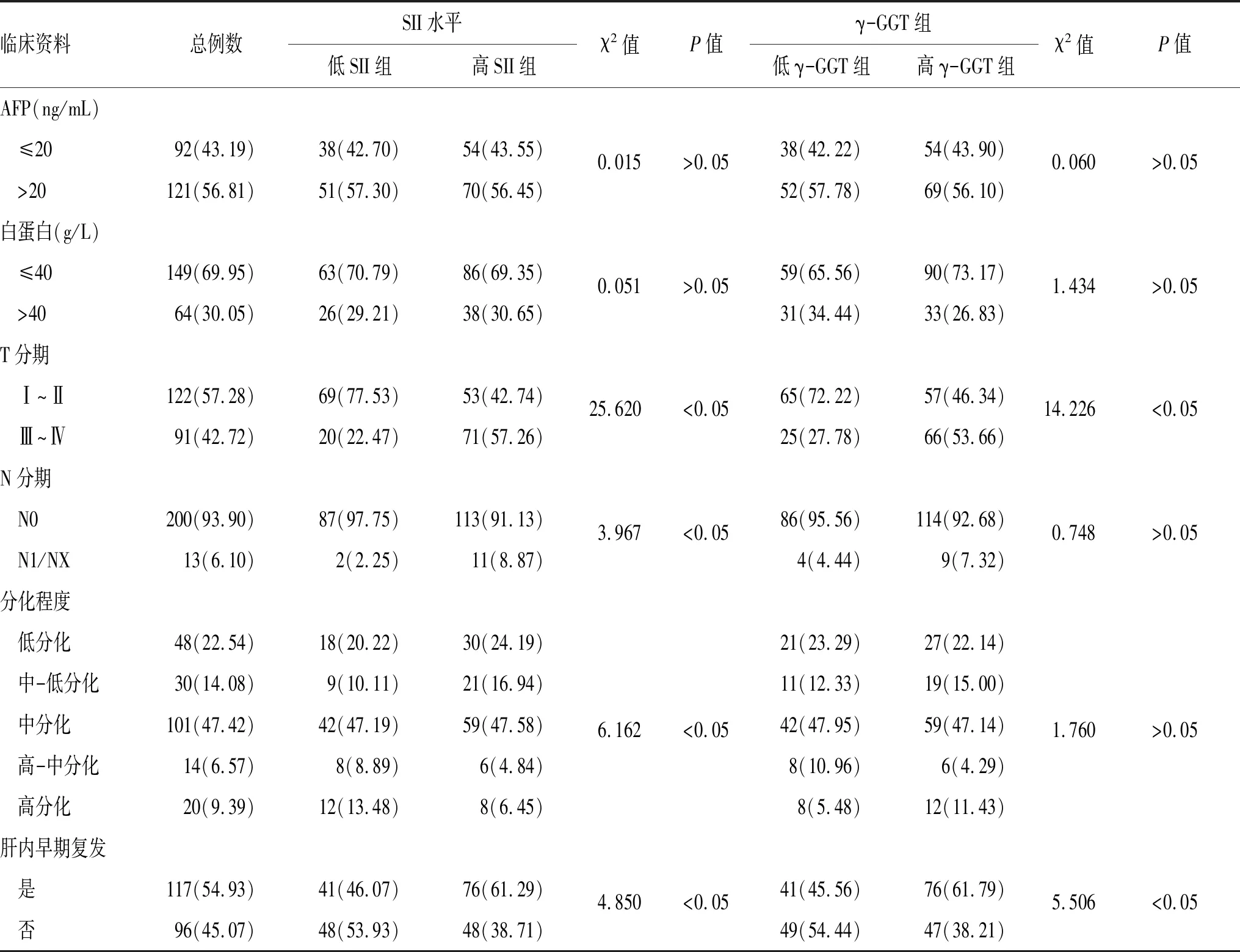
表2 术前SII和γ-GGT与肝癌患者临床病理特征的关系[n(%)]
2.3 术前SII和γ-GGT与肝癌患者临床病理相关性的Spearman秩相关分析:Spearman秩相关分析显示,术前SII与T分期、N分期及肝内早期复发呈正相关关系,而与肿瘤病理分化程度呈负相关关系。术前γ-GGT与吸烟、饮酒、T分期及肝内早期复发也呈正相关关系,见表3。
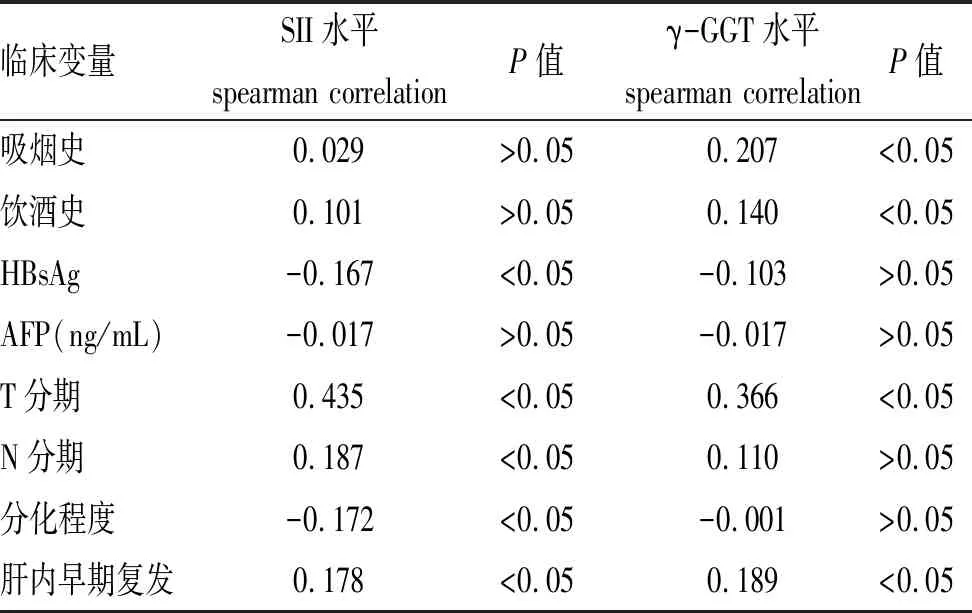
表3 术前SII和γ-GGT与肝癌患者临床病理相关性的Spearman分析
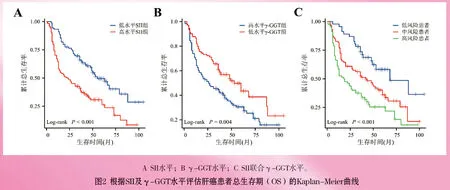
2.4 术前SII和γ-GGT与肝癌患者术后生存时间的分析:纳入研究213例患者总生存时间为1~105个月,中位生存时间为36个月。结果显示,低 SII组和高SII组患者的中位生存时间分别为55个月(95%CI:39.658~70.342)和22个月(95%CI:11.087~32.913),P<0.05,见图2A(封三)。低γ-GGT组和高γ-GGT组患者的中位生存时间分别为53个月(95%CI:35.243~70.757)和26个月(95%CI:11.984~40.016),P<0.05,见图2B(封三)。同时我们根据SII联合γ-GGT将肝癌患者分为3组,见表4。结果显示,低风险、中风险和高风险患者的中位生存时间分别为68个月(95%CI:32.887~103.113)、42个月(95%CI:26.031~57.969)和18个月(95%CI:9.235~26.765),P<0.05,见图2C(封三)。

表4 SII联合γ-GGT预测肝癌患者预后的风险评分(分)
2.5 术前SII和γ-GGT与肝癌患者术后预后的Cox比例风险模型:我们将饮酒、肿瘤组织病理分化程度、T分期、白蛋白、AFP水平、SII及γ-GGT纳入Cox比例风险模型中进行分析,单因素Cox比例风险模型分析发现T分期、SII及γ-GGT是肝癌患者术后总体生存的独立危险因素。多因素分析显示术前SII和γ-GGT是肝癌患者术后生存预后的独立危险因素(P<0.05),见表5。
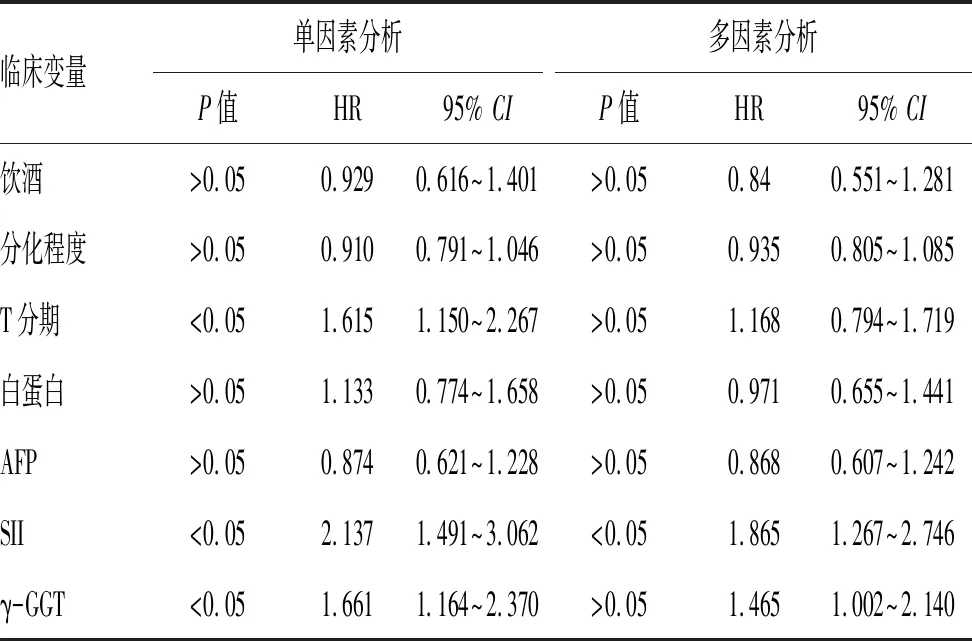
表5 肝癌患者术后生存预后影响因素的Cox回归分析
3 讨论
本研究探讨了术前SII和γ-GGT对肝癌患者临床病理特征及预后的影响,结果显示SII和γ-GGT与临床分期、肿瘤肝内早期复发相关,术前SII和γ-GGT是影响肝癌患者术后总生存时间的独立危险因素,术前低SII和低γ-GGT组的肝癌患者术后生存预后更佳。
1986年Dvorak等认为肿瘤的结构组成与外伤后机体愈合时形成的肉芽组织极为相似,指出了炎症反应和肿瘤之间的关系[7]。炎症反应是机体一种重要的免疫防御机制,但是炎症反应能够促使机体释放致炎因子、促血管生成因子、细胞外基质降解酶等细胞因子,促进肿瘤细胞增殖、血管新生、侵袭和转移[2]。研究发现与中性粒细胞与淋巴细胞比率(NLR)或血小板与淋巴细胞比率(PLR)等临床指标相比,SII对恶性肿瘤具有更好的预后价值[8]。作为一个综合反映淋巴细胞、中性粒细胞和血小板的临床参数,SII能够综合评估机体全身炎症反应水平及抗肿瘤免疫状态。而SII升高的原因主要是淋巴细胞减少、中性粒细胞增多和血小板数量增多。其中淋巴细胞作为机体免疫应答功能的主要免疫细胞,其介导的细胞毒性作用及释放的细胞因子能够抑制肿瘤的增殖及转移[9]。而中性粒细胞可以促进炎症因子的释放,协助构建肿瘤细胞生长的微环境,从而为肿瘤的侵袭、转移和复发提供条件[10]。在恶性肿瘤的发生和发展过程中,机体血小板的活性增强能促使血管内皮生长因子分泌增加,从而为肿瘤组织的血管形成提供土壤[11]。这也佐证了术前SII升高与肝癌患者不良预后相关,也提示抗感染治疗可能改善肿瘤患者的远期预后。
γ-GGT参与谷胱甘肽(GSH)的代谢,γ-GGT可在GSH代谢期间产生额外的ROS,以ROS为代表的化学物质,可进一步诱导肿瘤的侵袭和转移,γ-GGT的促氧化活性可能导致持续的氧化应激反应,最终致细胞增殖或凋亡,增大肿瘤发生的风险[6]。而γ-GGT对肝癌的影响可能是由于肿瘤细胞中γ-GGT增多和癌组织本身或其周围的炎症刺激作用,使肝细胞膜的通透性增加,导致血中γ-GGT增高,同时肿瘤细胞γ-GGT表达升高将导致ROS的连续产生,可能促进肿瘤细胞的增殖及侵袭[12]。Fu等[13]对130名接受肝移植治疗的肝癌患者的术前血清γ-GGT进行了统计分析,显示γ-GGT是接受肝移植治疗的肝癌患者总生存时间的独立预测因素,与本研究结果一致。同时,我们的结果表明SII联合γ-GGT更能反映机体全身炎症反应水平、抗肿瘤免疫状态及肝功能情况,可以更准确地预测肝癌患者的生存预后。基于本研究预后风险评分,SII联合γ-GGT可以准确预测肝癌患者术后不良预后,术前SII>194.38和γ-GGT>40.50为高风险患者,可以在早期进行术后辅助治疗(如预防性TACE、靶向免疫调节治疗和全身治疗等),以期为患者争取更好的预后。
综上所述,本研究发现术前SII和γ-GGT与临床分期、肿瘤肝内早期复发相关,术前SII和γ-GGT升高的患者预后较差。SII和γ-GGT作为一种无创性、易监测的实验室指标,可纳入临床评估肝癌患者生存预后的预测模型中,为临床医生制定更好的个体化治疗方案提供一定的参考。
