吉西他滨联合周疗法紫杉醇脂质体治疗晚期胃癌的疗效
2023-09-13李春兰裴乐乐
姚 磊,李春兰,裴乐乐
江苏省第二中医院药剂科,南京 210017
胃癌是源于胃上皮组织的癌症,是我国常见的消化系统恶性肿瘤。其起病隐匿,早期常无明显症状和体征,容易漏诊,发现时常属中晚期[1]。晚期胃癌一般指已经转移、扩散或者无法进行根治手术的胃癌,如出现远处脏器转移或淋巴结转移及直接侵犯邻近脏器或伴有腹腔转移、大量腹水的胃癌[2]。临床治疗晚期胃癌主要采用化疗,以改善患者的临床症状,减轻痛苦和最大限度地延长患者的生命。吉西他滨是一种主要针对肺癌、或者胰腺癌已经局部晚期、或者出现非小细胞转移现象的化疗药物,可与顺铂联用,通过控制细胞有丝分裂,杀灭增殖迅速的肿瘤细胞[3]。但大量临床研究发现[4-5],单独用吉西他滨进行化疗效果有限,且易引发骨髓抑制、血小板减少、白细胞减少及消化系统功能紊乱等不良反应。紫杉醇脂质体是一种低风险的化疗药物,其可通过促进微管双聚体装配并且阻止其解聚,从而阻碍肿瘤细胞的分裂,抑制肿瘤生长[6]。研究结果显示,它也可以与顺铂联合用于非小细胞肺癌患者的一线化疗,且效果良好[7]。目前,国内关于紫杉醇脂质体与吉西他滨联用治疗胃癌的报道较少,本研究探讨吉西他滨联合周疗法紫杉醇脂质体治疗晚期胃癌的疗效及其对患者血清肿瘤标志物及免疫功能的影响,旨在为临床相关研究提供参考。
1 一般资料
选取于本院进行治疗的晚期胃癌患者92例。
纳入标准:①所有研究对象均满足《中华医学会肺癌临床诊疗指南(2018版)》[8]中晚期胃癌相关诊断标准,经胃镜和病理活检确诊;②检查时观察的病灶可行测量;③美国东部肿瘤协作组简化活动状态评分表[9]评分≥2分;④TNM分期为Ⅲ~Ⅳ期,且生存时间在3个月及以上;⑤患者及家属知情并签署同意书。
排除标准:①合并其他部位恶性病变者;②行根治术后疾病复发者;③伴发严重的肝、肾功能异常者;④对本研究所用药物过敏或严重不耐受者;⑤妊娠期妇女;⑥无法配合本研究随访或中途退出者。
用随机数字表法将研究对象分为观察组(n=46)和对照组(n=46)。对照组:男27例,女19例;年龄为40~80岁,平均(65.43±7.57) 岁;病程为1~8年,平均(3.35±1.12) 年;鳞癌17例,腺癌24例,大细胞癌5例;TNM分期:ⅢB期24例,Ⅳ期22例。观察组男25例,女21例,年龄为40~79岁,平均(64.59±7.73) 岁;病程为1~7年,平均(3.05±1.01) 年;鳞癌16例,腺癌27例,大细胞癌3例;TNM分期:ⅢB期26例,Ⅳ期20例。2组患者的基线资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批通过。
2 方法
2.1 治疗方法
对照组采用吉西他滨联合顺铂(GP方案)进行化疗:第1、8天将注射用盐酸吉西他滨(规格为0.2 g,江苏豪森药业股份有限公司)溶于生理盐水100 mL中,以1 000 mg·m-2静脉滴注,同时于每周第1天将注射用顺铂(规格为30 mg,江苏豪森药业集团有限公司)溶于生理盐水100 mL中,以75 mg·m-2静脉滴注。每个疗程21 d,共进行2个疗程。
观察组在对照组治疗的基础上加用紫杉醇脂质体化疗:每周第1天在对照组治疗的基础上将注射用紫杉醇脂质体(规格为30 mg,南京绿叶思科药业有限公司)溶于生理盐水500 mL中,以75 mg·m-2行静脉滴注。每个疗程21 d,共进行2个疗程。
2.2 观测指标
2.2.1治疗效果 治疗2个疗程后评估近期疗效[10]。完全缓解(complete remission,CR):经影像学检查证实病灶消失,无新病灶出现,且病灶消失状态维持时间>30 d。部分缓解(partial remission,PR):经影像学检查病灶最大直径缩小≥50%,无新病灶出现,且病灶缩小情况维持时间>30 d。稳定(stable disease,SD):经影像学检查病灶最大直径缩小<50%或增大程度<25%,无新病灶出现,且病灶稳定情况维持时间>30 d。进展(progressive di-sease,PD):经影像学检查病灶增大≥25%或有新病灶出现。总有效率=[(CR的例数+PR的例数)/总例数]×100%。疾病控制率=[(CR的例数+PR的例数+SD的例数)/总例数]×100%。
2.2.2生存情况 所有受试者通过电话、门诊等方式随访1年,以入组时间为随访起始时间至结束、失访或死亡为截止时间,记录随访6个月2组患者的生存情况及中位生存期和无进展生存期。
2.2.3血清肿瘤标志物 于治疗前和治疗2个疗程后分别抽取受试者清晨空腹静脉血3 mL,血液标本均以4 000 r·min-1(半径13.5 cm)离心10 min,分离血清,置于-20 ℃保存待测。用酶联免疫吸附试验测定E-钙黏连蛋白(E-cadherin,E-cad)水平,试剂盒购自卡迈舒(上海)生物科技有限公司。用化学发光免疫分析法测定血清癌胚抗原(carcino-embryonic antigen,CEA)、鳞状细胞癌抗原(squamous cell carcinoma antigen,SCCA)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)的水平,试剂盒均购自深圳迈瑞生物医疗电子股份有限公司。用放射性免疫法测定细胞角蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYERA21-1)的水平,试剂盒购自广州科方生物技术股份有限公司。所有操作均严格按照试剂盒说明书进行。
2.2.4免疫学指标 取2.2.3项下血液标本,用赛默飞Attune CytPix成像型流式细胞仪测定免疫学相关因子T淋巴细胞亚群CD3+、CD4+、CD8+、自然杀伤细胞(natural killer cell,NK)、调节性T细胞(regulatory T cells,Treg)、辅助性T细胞17(helper T cell 17,Th17),计算CD4+/CD8+值、Th17/Treg值。
2.2.5不良反应发生情况 记录2组患者用药后恶心呕吐、腹泻、血小板减少、中性粒细胞减少、脱发、肝功能损伤、肾功能损伤、外周神经毒性等不良反应的发生情况。
2.3 统计学方法

3 结果
3.1 治疗效果的比较
治疗后,观察组与对照组的治疗总有效率分别为73.91%、63.04%,疾病控制率分别为93.48%、84.78%,2组近期治疗总有效率与疾病控制率比较,差异无统计学意义(P>0.05)。结果见表1。

表1 2组治疗效果的比较 (n=46)
3.2 生存情况的比较
治疗后随访6个月,观察组的生存率明显高于对照组,中位生存期及无进展生存期均明显长于对照组(P<0.05)。结果见表2。
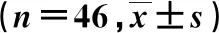
表2 2组生存情况的比较
3.3 血清肿瘤标志物水平的比较
治疗后,2组患者血清肿瘤标志物sEC、CEA、CA19-9、SCCA及CYERA21-1的水平均明显下降(P<0.05),2组比较差异无统计学意义(P>0.05)。结果见表3。
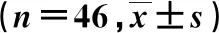
表3 2组血清肿瘤标志物水平的比较
3.4 免疫学指标的比较
治疗后,2组患者的免疫学指标均优于治疗前,观察组CD3+、CD4+、CD4+/CD8+值及NK较对照组高(P<0.05),CD8+、Treg、Th17、Th17/Treg值较对照组低(P<0.05)。结果见表4。

表4 2组免疫学指标的比较
3.5 不良反应发生情况的比较
治疗后,观察组恶心呕吐、腹泻、血小板减少及肝肾功能损伤、外周神经毒性等不良反应的发生率均显著低于对照组(P<0.05)。结果见表5。

表5 2组用药后不良反应发生情况比较(n=46)
4 讨论
晚期胃癌是指肿瘤组织已经侵及胃的浆膜层或突破浆膜层发生浆膜外转移的胃癌,主要表现为胃部疼痛,伴有恶心、呕吐、体质量减轻、贫血、乏力、水肿、发热和黄疸等症状,部分患者会出现副肿瘤综合征[11]。我国胃癌的发病率高于世界平均水平,患病率与死亡率分别位于所有恶性肿瘤的第2位和第3位,因此胃癌的治疗一直是临床研究的重点[12]。化疗作为治疗胃癌的重要手段,可控制胃癌的进展,延长患者的生存期。但有研究显示,使用单一化疗药物不良反应较多,不利于改善患者的预后,而联合2种及以上化疗药物治疗的疗效较好,可降低不良反应的发生率,提高治疗效果[13]。基于此,本研究联合应用吉西他滨与紫杉醇脂质体治疗晚期胃癌,探讨其临床应用价值。
吉西他滨是一种广谱抗癌药物,对多种肿瘤都有很好的治疗效果,其主要通过抑制肿瘤细胞的复制发挥抗肿瘤作用。但该药在细胞内的半衰期较短,需持续大剂量用药才能维持其药效[14-15]。但持续大剂量用药会引发不良反应,如肝肾毒性、神经毒性、胃肠道反应等,严重影响治疗效果。紫杉醇脂质体属于细胞毒类抗肿瘤药,通常作为卵巢癌的一线化疗药物,其进入人体后主要被体内网状内皮系统吞噬继而激活自身免疫系统的功能,使药物主要在肝、脾、肺和骨髓等组织中蓄积,从而提高药物的治疗效果,降低药物的治疗剂量和毒性,提高患者的耐受性。紫杉醇脂质体与吉西他滨联用可弥补吉西他滨的不足,改善总体治疗效果[16-17]。徐海源等[18]的研究结果也显示,采用紫杉醇脂质体联合顺铂治疗老年晚期肺鳞状细胞癌的疗效较好,且血液学不良反应较少。本研究结果显示,治疗后观察组与对照组的治疗总有效率分别为73.91%、63.04%,疾病控制率分别为93.48%、84.78%,2组近期治疗总有效率与疾病控制率比较差异无统计学意义,治疗后2组患者血清肿瘤标志物sEC、CEA、CA19-9、SCCA及CYERA21-1的水平均较治疗前明显下降,观察组治疗后随访6个月的生存率明显高于对照组,中位生存期及无进展生存期均明显长于对照组。这与既往的研究结果相符[18],表明吉西他滨联合周疗法紫杉醇脂质体治疗晚期胃癌的效果显著,可明显降低肿瘤标志物的水平,改善患者的远期预后,延长患者的生存期,具有较高的临床应用价值。
本研究结果显示,治疗后2组免疫学指标均优于治疗前,观察组CD3+、CD4+、CD8+、CD4+/CD8+值及NK均高于对照组,Treg、Th17、Th17/Treg值均低于对照组,表明吉西他滨联合周疗法紫杉醇脂质体治疗可在一定程度上改善晚期胃癌患者的免疫情况,这与LV W Z等[19]的研究结果相似。葛琳[20]的研究结果显示,大部分恶性肿瘤患者的机体处于免疫功能低下的状态,使患者抵抗外界感染的能力受到严重影响。紫杉醇可通过改善晚期胃癌患者的免疫抑制状态,提高其免疫力[21]。紫杉醇脂质体是将难溶于水的紫杉醇包封在脂质体磷脂双分子层中制备而成,其作用与紫杉醇相似,但其不良反应较紫杉醇低,因而周剂量紫杉醇脂质体的应用可明显改善晚期肺癌患者的免疫功能[22]。已有研究表明,由于脂质体药物独特的药代动力学特性,紫杉醇脂质体在患者体内的半衰期延长,血药浓度波动小,因而其对患者血液、血压、肝肾功能的影响更小,不良反应更少[23-24]。本研究结果显示,用药后观察组恶心呕吐、腹泻、血小板减少及肝肾、功能损伤、外周神经毒性等的发生率均比对照组低,表明吉西他滨联合周疗法紫杉醇脂质体治疗可明显降低用药后不良反应的发生率,这与上述研究的结果一致。此外,本研究与张莹等[25]的研究结果存在一定差异,该研究结果显示,紫杉醇脂质体与吉西他滨分别联合顺铂治疗肺癌的远期疗效与近期疗效比较差异均无统计学意义,且紫杉醇脂质体可维持机体免疫功能稳定。可能是由于本研究选取样本具有一定的局限性,样本容量较小,且应用紫杉醇脂质体联合吉西他滨治疗肺癌的报道较少,其作用机制尚存争议,加之本研究的随访时间较短,故可能对结果产生一定影响。后续应扩大样本容量和范围,延长随访时间,查阅更多文献资料,深入探讨紫杉醇脂质体联合吉西他滨治疗胃癌的应用价值。
综上所述,吉西他滨联合周疗法紫杉醇脂质体治疗晚期胃癌的近期、远期疗效显著,可明显降低患者肿瘤标志物的水平,缓解患者的临床症状,改善患者的免疫功能,降低不良反应的发生率,且安全性良好,可在临床推广应用。
