他莫昔芬脂质体的制备及抗肿瘤活性研究
2023-09-13景莎莎胡海洋
景莎莎,梁 宇,胡海洋
1.西安国际医学中心医院,西安 710100;2.深圳市博德维环境技术股份有限公司西安分公司,西安 710000;3.沈阳药科大学,本溪 117004
乳腺癌的发病率位居中国女性恶性肿瘤的首位[1],世界卫生组织2020年的数据显示,乳腺癌已正式取代肺癌,成为全球第一大癌症[2],约70%的乳腺癌为激素受体阳性[3],目前针对这类乳腺癌的主要治疗手段为内分泌治疗[4]。
他莫昔芬(tamoxifen,TAM)与雌激素竞争性结合雌激素受体(estrogen receptor,ER),从而抑制乳腺癌细胞的增殖[5]。研究发现,TAM能显著抑制ER阳性乳腺癌的复发和转移[6-7]。但TAM在水中的溶解度极低,口服胃肠道溶出差,生物利用度较低[8]。
本研究利用脂质体生物相容性好、毒性低、广泛用于癌症治疗的优点[9],将TAM制备成他莫昔芬脂质体(tamoxifen liposomes,TAM-LIPs)。TAM-LIPs利用高通透性和滞留(enhanced permeability and retention,EPR)效应靶向肿瘤组织,增加药效,降低毒性。包封率(encapsulation efficiency,EE)和载药量(drug loading,DL)直接决定药物在体内的疗效[10],故提高EE和DL非常重要。Box-Behnken效应面法已广泛应用于制剂的优化中[11],适用于多因素多水平实验设计,评价因素与指标间的非线性关系,具有预测性好、精度高的优点[12]。现拟利用薄膜分散法[13]制备TAM-LIPs,用Box-Behnken效应面法同时优化EE、DL,验证用最佳处方制备的TAM-LIPs在体液(pH 7.4)中的稳定性,研究TAM-LIPs对人乳腺癌MCF-7细胞的抑制作用,提高乳腺癌内分泌疗法的治疗效果。
1 仪器与材料
1.1 仪器
日立L-2000系列高效液相色谱仪(日本Hitachi公司);RE52CS型旋转蒸发器(上海亚荣生化仪器厂);TGL-16C型台式离心机(上海安亭科学仪器厂);KYC-100B型恒温培养摇床(上海福玛实验设备有限公司);马尔文激光粒度仪(美国DT公司);TECAN SPECTRA多功能酶标仪(德国Wetzlar公司);细胞培养超净工作台(上海龙跃仪器设备制造有限公司);MM-1型微量振荡器(上海亚荣生化仪器厂)。
1.2 试药
枸橼酸他莫昔芬(质量分数为99.0%,大连美仑生物技术有限公司);蛋黄卵磷脂、胆固醇均购自上海艾韦特医药科技有限公司;甲基噻唑蓝、胰酶、DMSO均购自美国Sigma公司;高糖DMEM培养基(美国HyClone公司);96孔细胞培养板(无锡耐思生物科技有限公司);葡聚糖凝胶G-50(北京索莱宝科技有限公司);甲醇(色谱纯,山东禹王化工有限公司);透析袋(相对分子质量为14 000,美国联合碳化物公司)。
1.3 细胞
人乳腺癌细胞株MCF-7购自北京北纳创联生物技术研究院。
2 方法与结果
2.1 TAM-LIPs与空白脂质体的制备
TAM-LIPs:精密称取适量的蛋黄卵磷脂、胆固醇和TAM,置于250 mL茄形瓶中,用氯仿溶解,减压旋转蒸发除去有机溶剂,使其形成均匀薄膜。将适量pH 7.4的磷酸盐缓冲液(PBS)加入茄形瓶中,55 ℃水浴条件下水化30 min,得到TAM-LIPs混悬液。
空白脂质体(BLANK-LIPs):制备方法同TAM-LIPs,溶解脂质材料时加入蛋黄卵磷脂、胆固醇即可,不加入TAM。
2.2 TAM体外分析方法的建立
2.2.1高效液相色谱法(HPLC)分析条件与标准曲线的建立 色谱柱为Kromasil C18(200 mm×4.6 mm,5 μm);流动相为甲醇-水(含质量浓度为5 mL·L-1的三乙胺)=10∶90;流速为1 mL·min-1;检测波长为240 nm;柱温为35 ℃;进样量为20 μL。
标准曲线为A=41 838C-5 297.3(R2=0.999 8),他莫昔芬质量浓度在2.00~100.00 μg·mL-1范围内线性关系良好。
2.2.2包封率测定 采用葡聚糖凝胶法[14]测定TAM-LIPs的包封率,精密吸取TAM-LIPs混悬液0.5 mL加于微柱顶端,以2 000 r·min-1离心2 min,再加入蒸馏水0.5 mL,以2 000 r·min-1离心3 min,收集洗脱液,重复上述操作。收集前3管洗脱液,合并后置于10 mL量瓶中,以甲醇定容,用HPLC法测定,并计算包封于脂质体中TAM的质量(m1);另取TAM-LIPs混悬液0.5 mL,置于10 mL量瓶中,加甲醇破乳并稀释至刻度,测定总药物质量(m2)。EE=(m1/m2)×100%。
2.3 Box-Behnken实验设计
EE和DL是TAM-LIPs质量评价中的重要指标,选择磷脂与药物质量比(A)、磷脂与胆固醇质量比(B)、水化温度(C)作为独立变量,各变量设计3个水平,以包封率(y1,EE)和载药量(y2,DL)为评价指标,利用Box-Behnken效应面法优化处方。因素与水平见表1,实验方案与结果见表2。
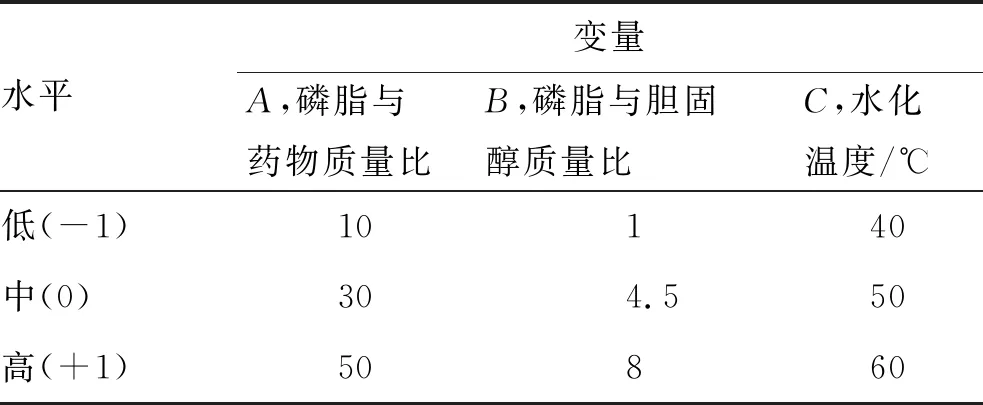
表1 Box-Behnken实验设计中的因素与水平

表2 实验方案与结果
2.3.1二次回归模型的建立 利用Design Expert 10软件进行回归分析,得到二次多元回归方程。
EE=89.96+11.81A+1.96B-0.36C-2.45AB-0.37AC+2.27BC-19.61A2-10.36B2-4.37C2(R2=0.963 4)
DL=2.40-1.31A+0.60B-0.001 25C-0.40AB-0.013AC-0.050BC+0.36A2-0.59B2-0.070C2(R2=0.996 0)
回归方程系数显著性检验结果见表3。
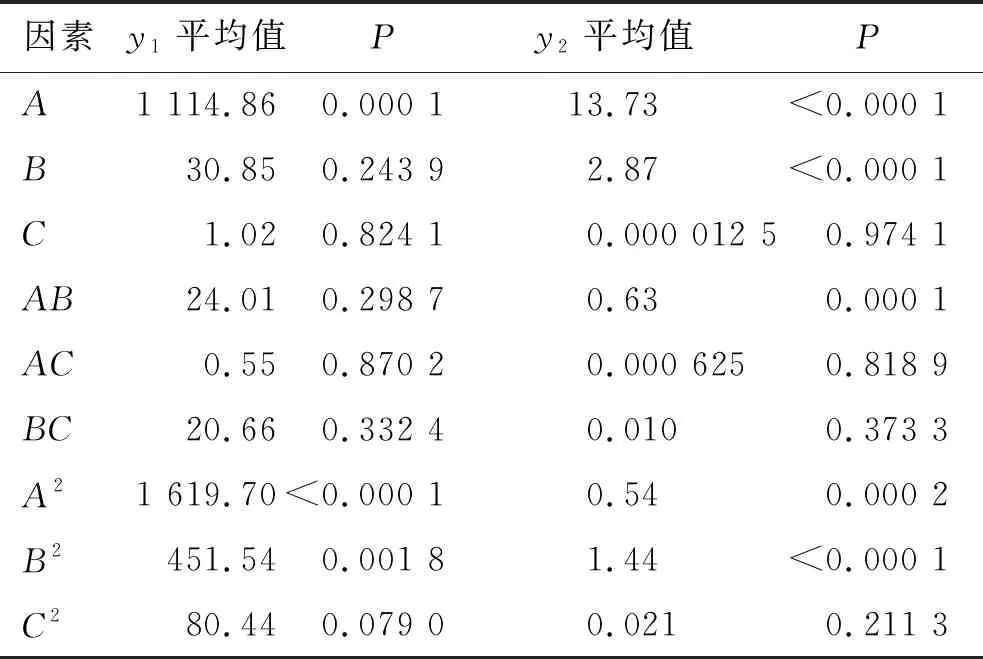
表3 回归方程中系数的显著性检验
2.3.2方差分析和显著性检验 2个拟合方程相关系数的显著性检验结果表明二次多项式回归拟合程度良好,由表3中的回归系数显著性检验P值可知,模型1中A(P=0.000 1)﹑A2(P<0.000 1)、B2(P=0.001 8)极显著, 其他项不显著, 且失拟差(lack of fit)不显著(P=0.088 0>0.05);模型2中A(P<0.000 1)、B(P<0.000 1)、AB(P=0.000 1)、A2(P=0.000 2)、B2(P<0.000 1)极显著,其他项不显著,且失拟差也不显著(P=0.115 1>0.05)。表明自变量与EE、DL之间的线性关系显著,可利用此模型预测TAM-LIPs的EE和DL。
2.3.3效应面优化与验证 用Design Expert 10软件绘制各指标与3个自变量的三维效应面图,见图1和图2,效应面图更好地表征了不同因素间的交互作用对响应值的影响,并得到同时使EE和DL均较高的处方和工艺:A为22.988,B为5.781,C为50.9 ℃。由图1和图2可见,优化目标(EE和DL)受3个因素之间交互作用的影响较显著,这与方差分析的结果一致。

图2 不同因素对TAM-LIPs载药量(y2)影响的效应面图
按最佳处方和工艺重复3次实验,得到平均包封率、平均载药量分别为84.131%、3.059%,实测值与模型预测值接近,表明该模型可准确预测EE、DL。结果见表4。

表4 模型验证实验的预测值和实测值
2.3.4TAM-LIPs表征 用激光粒径分析仪测定TAM-LIPs的粒径和Zeta电位,用透射电镜观察粒子的微观形态[15-16]。
取用最佳处方和工艺条件制备的TAM-LIPs混悬液适量并稀释,用马尔文激光粒度仪对TAM-LIPs混悬液的粒径与Zeta电位平行测定3次,结果见图3。TAM-LIPs的平均粒径为(141.5±2.3) nm,PDI为(0.248±0.031),Zeta电位为(-21.9±0.42) mV。

注:A.TAM-LIPs混悬液的粒径分布;B.TAM-LIPs混悬液的Zeta电位。
将TAM-LIPs混悬液稀释10倍后,吸取10 μL滴在覆有支持膜的铜网上,室温静置5 min后用滤纸吸干,滴加体积分数为1%的磷钨酸溶液染色5 min,于透射电镜下观察,结果见图4。由图4可见,TAM-LIPs为球形或类球形,粒径分布在130~170 nm范围内。

图4 TAM-LIPs混悬液的透射电镜图
2.3.5稳定性考察 通过测定脂质体在4 ℃放置时的渗漏率来评价其稳定性[17]。测定TAM-LIPs混悬液在4 ℃放置1、2、3、5、7、10、15 d的渗漏率,结果见图5。由图5可见,TAM-LIPs在15 d内,包载药物TAM的渗漏率低于15%,较稳定。
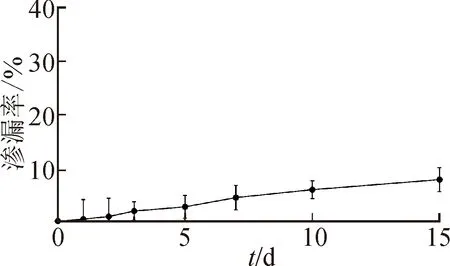
图5 TAM-LIPs混悬液在4 ℃放置15 d的渗漏曲线(n=3)
2.3.6体外释放研究 用透析法[18]研究TAM混悬液(以水为溶剂)与TAM-LIPs混悬液的体外释放行为。分别精密量取适量TAM混悬液与TAM-LIPs混悬液,分别装于透析袋中,置于装有PBS缓冲液的50 mL锥形瓶中,于37 ℃恒温振荡。分别在0.5、l、2、4、6、8、10、12、24、36、48 h吸取1 mL释放介质,同时补充等体积空白介质,测定TAM的释放量,计算TAM的累积释放度,见图6。由图6可见,TAM-LIPs中TAM的释放速度比TAM混悬液慢,具有一定的缓释作用。

图6 TAM-LIPs混悬液及TAM混悬液的释放曲线(n=3)
2.3.7体外细胞毒性评价 用MTT法评价TAM原料药、BLANK-LIPs及TAM-LIPs的体外细胞毒性[19]。分别用无血清高糖DMEM培养液稀释,配制质量浓度为0.74、1.86、3.72、5.57、7.43、11.15、18.58、37.16 μg·mL-1的系列TAM溶液(溶剂为DMSO)及TAM-LIPs混悬液。以5×103个·孔-1的密度将MCF-7细胞接种于96孔板中,在体积分数5%CO2、37 ℃培养12 h,于每孔中加入200 μL各系列质量浓度的TAM溶液、BLANK-LIPs及TAM-LIPs,各质量浓度均设置3个复孔,继续培养48 h,加入20 μL MTT溶液,培养4 h,弃去溶液,于各孔中加入150 μL DMSO溶解,用微量振荡器振荡10 min使结晶紫完全溶解,测定490 nm处的吸光度值(A),计算细胞存活率和IC50值,结果见图7。

图7 不同质量浓度的TAM溶液、BLANK-LIPs混悬液、TAM-LIPs混悬液对MCF-7细胞的细胞毒性(n=3)
由图7可见,BLANK-LIPs对MCF-7细胞几乎无抑制作用,而TAM溶液、TAM-LIPs对MCF-7细胞显示出一定的抑制作用,其IC50值分别为5.36、4.36 μg·mL-1。
3 讨论
TAM作为雌激素受体调节剂,常用于乳腺癌和卵巢癌的治疗,也可用于肝癌[20]、胰腺癌[21]、脑癌[22]等其他癌种的治疗,其化学结构与胆固醇相似,可降低脂质双层膜的流动性和灭活P-170糖蛋白外排泵[23],或通过下调ABCB1的水平和上调烯醇化酶1的水平[24]逆转癌细胞的多药耐药。
本实验用薄膜分散法制备TAM-LIPs,用Box-Behnken效应面法优化得到TAM-LIPs的最优处方和工艺(磷脂与药物的质量比为22.988,磷脂与胆固醇的质量比为5.781,水化温度为50.9 ℃)。用最优处方制得的TAM-LIPs的EE和DL分别为84.131%、3.059%,与预测值接近。由效应面图可知,对EE和DL影响的主次顺序为A>B>C。
用最优处方和工艺制得的TAM-LIPs的粒径为(141.5±2.3) nm,且分布均匀,在体液pH条件下稳定性良好。TAM-LIPs对MCF-7细胞的体外抑制作用略优于TAM原料药,生物相容性好,可提高生物利用度,降低药物毒性,而且具有逆转肿瘤细胞多药耐药的作用,在提高乳腺癌治疗效果的同时,也可为多种癌症的多药联合治疗提供新的选择。
