颅内动脉瘤患者术后并发脑血管痉挛的影响因素分析
2023-09-12薛志向
薛志向
(商丘市长征人民医院神经外科,河南 商丘 476000)
颅内动脉瘤是临床常见的脑血管疾病,多因脑动脉管壁局部的先天性缺陷和腔内压力增高的基础上引起囊性膨出,是造成蛛网膜下腔出血的首位病因。
绝大多数的病人没有明显的症状和体征,只有极少数病人,因动脉瘤影响到邻近神经或脑部结构而产生特殊的表现,甚至导致患者死亡[1]。临床治疗颅内动脉瘤多采用夹闭术、介入栓塞术等手术治疗,可去除脑部动脉瘤,阻断颅内动脉瘤和脑内循环,及时清理颅内动脉瘤,临床疗效确切[1]。但有研究指出,部分颅内动脉瘤患者接受手术治疗后,易出现多种术后并发症,其中脑血管痉挛较为常见[2]。而该病患者一旦确诊发生脑血管痉挛,可导致患者病情进一步恶化,增加患者病死、残疾的发生风险,不利于患者预后。
但目前有关颅内动脉瘤患者术后并发脑血管的相关因素尚未完全明确,因此为有效降低颅内动脉瘤患者术后脑血管痉挛发生风险,本研究旨在探析颅内动脉瘤患者术后并发脑血管痉挛的相关因素,以便能结合患者的实际情况提前做好相关的预防干预措施。
1 资料与方法
1.1 一般资料
本研究经本院伦理委员会批准,选取2021 年1 月-2022 年8 月于本院接受手术治疗的颅内动脉瘤患者159 例作为研究对象。患者及家属均签署知情同意书。
纳入标准:符合《颅内动脉瘤诊断标准[3];接受夹闭术或介入栓塞术治疗,且进程顺利;首次发病。排除标准:存在既往脑部手术史;存在颅脑创伤史;肝、肾功能障碍;合并颅内感染。
159 例患者中男75 例,女84 例;年龄40-70岁,平均年龄(61.32±4.32)岁;吸烟史66 例。
1.2 方法
1.2.1 脑血管痉挛判定及分组
术后随访3 m,脑血管痉挛诊断标准[4]:①患者出现意识状态恶化,出现偏瘫、感觉障碍、意识障碍等症状;②经CT 血管成像确诊患者脑血流速增快、颅内压增高。符合上述标准,并排除其他疾病后可确诊为脑血管痉挛。
根据患者是否发生脑血管痉挛,将患者分为发生组和未发生组。
1.2.2 基线资料调查方法
由研究人员设计基线资料表,包括性别、年龄、发病至就医时间、吸烟史、动脉瘤家族病史、高血压[5]、糖尿病[6]、动脉瘤位置、动脉瘤破灭次数、Hunt-Hess 分级(Ⅰ级:患者临床症状较为轻微,存在轻度颈强直;Ⅱ级:患者存在中-重度头痛,除却颅神经麻痹外,并无其他神经功能丧失;Ⅲ级:患者存在倦睡、意识模糊,轻微神经功能缺失;Ⅳ级:木僵,中或重度偏侧不全麻痹,神经系统障碍;Ⅴ级:深度昏迷,去大脑强直,处于濒死状态)。
1.2.3 实验室指标
采集静脉血3 mL,离心取血清,应用全自动生化分析仪(中生(苏州)医疗仪器有限公司,型号:ZS-820),采用酶联吸附法测定患者血清白蛋白(Albumin,ALB)、高密度脂蛋白胆固醇(High density liptein cholesterol,HDL-C)、低密度脂蛋白胆固醇(Low Density Lipoproteincholesterol,LDL-C)水平。
1.3 观察指标
(1)颅内动脉瘤患者术后脑血管痉挛发生情况;(2)发生组和未发生组的基线资料比较;(3)颅内动脉瘤患者术后并发脑血管痉挛的相关因素的Logistic 回归分析。
1.4 统计学方法
采用SPSS 25.0 统计学软件,全部计量资料均经Shapiro-Wilk 正态性检验,符合正态分布用±SD 表示,组间用独立样本t检验;百分比表示计数资料,用χ2检验;采用Logistic 多元回归分析检验颅内动脉瘤患者术后并发脑血管痉挛的相关因素,P<0.05 为差异具有统计学意义。
2 结果
2.1 颅内动脉瘤患者术后脑血管痉挛发生情况
159 例颅内动脉瘤患者术后发生脑血管痉挛40 例,占比25.16%(40/159),未发生脑血管痉挛119 例,占比74.84%(119/159)。
2.2 发生组与未发生组基线资料比较
发生组高血压、动脉瘤位置、动脉瘤破灭次数、Hunt-Hess 分级>Ⅲ级与未发生组比较,差异有统计学意义(P<0.05)。
两组间性别、年龄、发病至就医时间、吸烟史、动脉瘤家族病史、糖尿病、ALB、HDL-C、LDL-C 比较,差异无统计学意义(P>0.05)。详见表1。
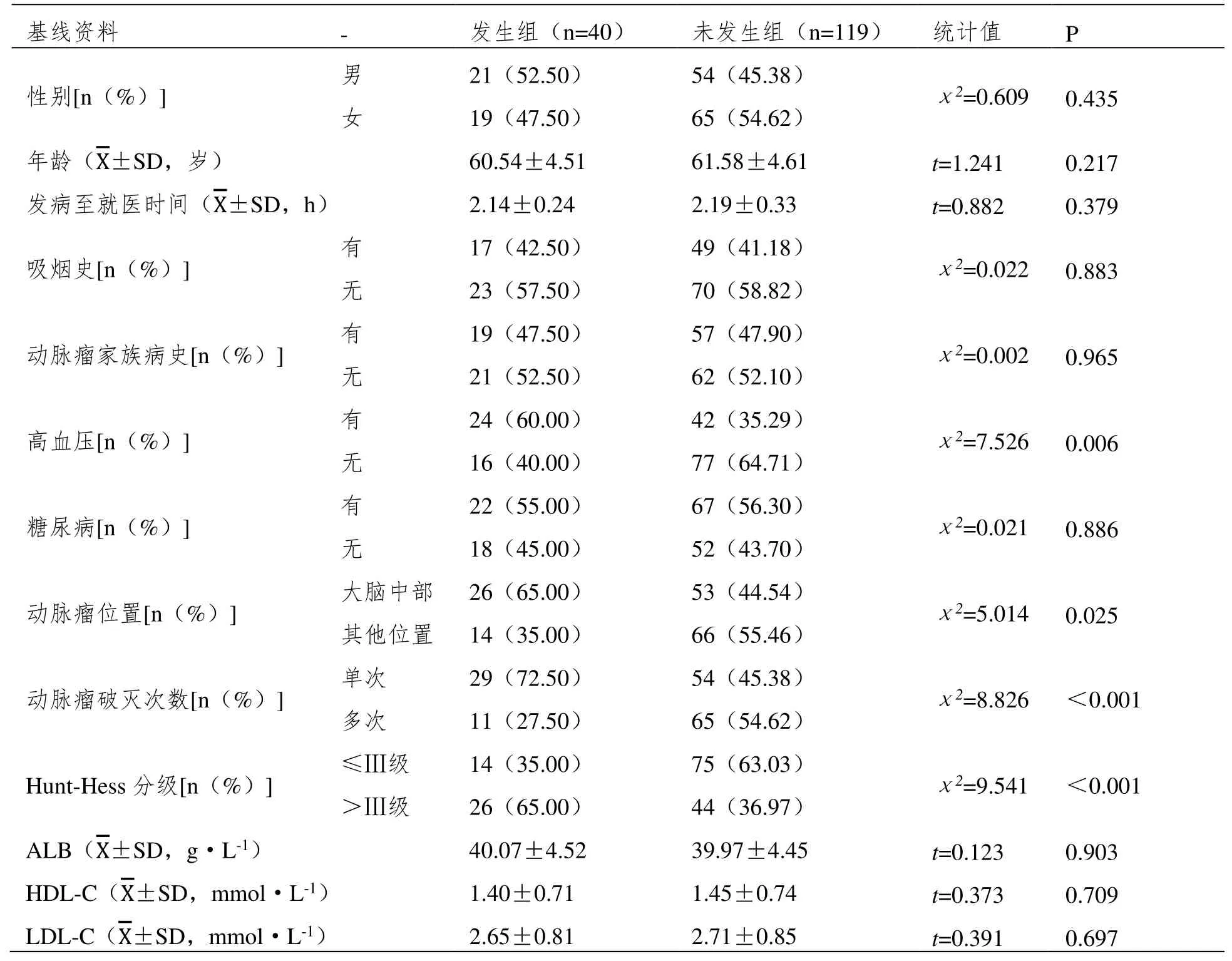
表1 两组基线资料、实验室资料比较
2.3 颅内动脉瘤患者术后并发脑血管痉挛的相关因素的Logistic 回归分析
将颅内动脉瘤患者术后并发脑血管痉挛的情况作为因变量,发生赋值为“1”,未发生赋值为“0”,将基线资料中P 值条件放宽至<0.2,纳入符合条件的变量(高血压、动脉瘤位置、动脉瘤破灭次数、Hunt-Hess 分级)作为自变量(变量赋值说明见表2-1),建立多元Logistic 回归模型。结果显示,高血压、动脉瘤位置大脑中部、动脉瘤破灭多次、Hunt-Hess 分级>Ⅲ级是颅内动脉瘤患者术后并发脑血管痉挛的相关因素(OR>1,P<0.05)。见表2-2。

表2 -1 自变量赋值情况
3 讨论
手术是现阶段治疗颅内动脉瘤患者的有效手段,但颅内动脉瘤患者接受手术治疗后,因脑部血流动力学发生改变,易引发多种并发症,其中以脑血管痉挛较为常见,可对患者部神经组织造成不可逆转的损伤,严重降低手术治疗效果,是患者病死、致残的主要危险因素之一[1,2]。因此,明确颅内动脉瘤患者术后脑血管痉挛发生的危险因素,及时采取干预措施,对改善其预后尤为重要。本研究结果显示,159 例颅内动脉瘤患者中有40 例发生术后脑血管痉挛,发生率为25.16%,略高于程宇宏等[7]研究结果。这可能与本研究对象年龄较大有关。本研究进一步经多元Logistic回归模型,结果显示,高血压、动脉瘤位置大脑中部、动脉瘤破灭多次、Hunt-Hess 分级>Ⅲ级是颅内动脉瘤患者术后并发脑血管痉挛的相关因素。分析原因在于:
高血压:合并高血压的患者,流动的血液对血管壁的压力持续高于正常值,致使合并高血压的颅内动脉瘤患者脑部血管负荷增加,进而增加脑血管痉挛的发生风险[1]。建议临床在进行手术治疗前,需完善对患者的身体指标检查,纠正患者高血压状态。
动脉瘤位置大脑中部:因大脑中部神经组织较多、血管组织较为密集,其手术治疗难度更大,并且对患者神经功能损伤程度较高[1,2,7]。建议临床可于手术前确定手术方案,并安排经验丰富的资深医生进行手术操作。动脉瘤破裂多次:可导致患者的脑内积血分布范围增加,导致颅内压升高,增加手术难度,并且患者动脉瘤发生破裂还会引发蛛网膜下腔出血,增加脑血管痉挛风险[2]。建议临床可于术前先行保守治疗,稳定患者病情,必要时可给予患者抗脑血管收缩类药物,降低脑血管痉挛的发生风险。
Hunt-Hess 分级>Ⅲ级:分级较高的患者,颅内出血量较多,神经功能损伤较重,导致患者预后较差[2]。对此建议,需尽快采取急救措施及早给予止血剂以及抗纤维蛋白酶制剂,降低术后脑血管痉挛发生风险。
综上所述,高血压、动脉瘤位置大脑中部、动脉瘤破灭多次、Hunt-Hess 分级>Ⅲ级是颅内动脉瘤患者术后并发脑血管痉挛的相关因素,临床可根据上述影响因素制定针对性干预措施,以降低脑血管痉挛发生风险。
