血清IL-35、AST 水平与脓毒症患者CRRT 治疗预后的关系研究
2023-09-12赵宇飞刘少华王高峰
赵宇飞、刘少华、王高峰
(登封嵩正中医院急诊科,河南 登封 452470)
脓毒症是指由感染引起的全身炎症反应综合征,且患者病情进展较快,易并发急性肾损伤,严重威胁患者的生命健康[1]。连续性肾脏替代疗法(CRRT)可以代替患者机体的肾脏功能,有效促进血流动力学稳定、改善氧合和组织代谢、缩短患者入住重症监护室的时间,是治疗脓毒症的有效方式。但在内外因素的影响下,仍有部分患者达不到预期治疗效果,病死率较高,不利于患者预后[1]。因此,明确影响脓毒症患者CRRT 治疗预后情况的风险指标十分必要。脓毒症演变属于复杂的免疫过程,多种炎症因子参与其中[1],其中白介素-35(ⅠL-35)是临床常见的免疫抑制细胞因子,主要由调节性T 细胞分泌,与机体免疫应答有密切的关系[2]。天门冬氨酸氨基转移酶(AST)是肝脏损伤的敏感标志物,而肝脏是脓毒症重要的靶器官,AST 参与脓毒症病情的发生与发展[3]。结合ⅠL-35、AST 与脓毒症的关系,初步推测二者可能对脓毒症患者CRRT 治疗预后存在一定关系。基于此,本研究分析血清ⅠL-35、AST 水平与脓毒症患者CRRT 治疗预后的关系,为改善患者预后提供参考。
1 资料与方法
1.1 一般资料
前瞻性选取2020 年1 月至2021 年12 月医院收治的120 例脓毒症患者作为研究对象。120例脓毒症患者中男59 例,女61 例;年龄35-45岁,平均年龄40.72±3.51 岁;体重指数23.2-25.56 kg·m-2,平均体重指数25.56±0.26 kg·m-2。
纳入标准:诊断符合《临床疾病诊断与疗效判断标准》中诊断标准中一般脓毒症或严重脓毒症[4];均进行CRRT 治疗;患者家属均签署知情同意书。排除标准:入组前接受糖皮质激素、免疫抑制剂及细胞毒性治疗;合并恶性肿瘤、急性心肌梗死、心肌炎、肝硬化等疾病;感染性疾病病程中转换为脓毒症;脓毒症休克。
1.2 方法
1.2.1 基线资料收集
设计基线资料调查表,内容包括患者年龄、性别、急性生理与慢性健康(APACHE)Ⅱ评分(该评分系统总分0-71 分,分数越高提示患者病情严重程度越高)[5]、合并糖尿病、合并高血压、合并高脂血症、病情程度。患者于入院时填写。
1.2.2 实验室指标测定
于CRRT 治疗前进行实验室指标检查,抽取脓毒症患者空腹状态下4-5 mL 外周静脉血,使用上海利鑫坚离心机有限公司H-1600R 型高速冷冻离心机离心分离出上层血清液待检。使用上海将来实业股份有限公司提供的试剂盒,以酶联免疫法测定血清ⅠL-35 水平;使用天津瑞德公司提供的试剂盒及Modular P800 型全自动生化分析仪(德国罗氏诊断有限公司),以放射免疫法测定血清白介素-8(Ⅰnterleukin-8,ⅠL-8)水平;使用中生北控生物科技有限公司提供的试剂盒及全自动生化分析仪,以胶乳免疫比浊法测定血清超敏C 反应蛋白(hypersensitive C-reactive protein,hs-CRP)水平;使用深圳市科润达生物工程有限公司提供的试剂盒,以酶联免疫吸附试验法测定肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)水平;使用日本日立株式会社7600 型全自动生化分析仪及其配套试剂盒测定血清AST 水平以及丙氨酸转氨酶(Alanine aminotransferase,ALT)水平。
1.2.3 CRRT 治疗
入院后进行抗感染、氧疗、早期液体复苏、加强引流、营养支持等常规治疗。然后予以CRRT常规处方:深静脉置管建立血管通路,采用Aquarius 血液净化系统,治疗模式: CⅤⅤH;聚砜膜:HF1200,膜面积1.2 m2,24 h 更换一次;置换液速度:2000 mL·h-1,1:1 前后稀释;超滤:0~300 mL·h-1;血流速度:200 mL·min-1,抗凝剂:普通肝素钠。
1.2.4 预后判定及分组
由CRRT 治疗开始,观察患者存活与病死情况,直至CRRT 治疗结束后28 d,统计患者存活及病死情况,将存活患者纳入存活组,将病死患者纳入病死组(包括治疗期间死亡的患者)。
1.3 统计学方法
采用SPSS 24.0统计学软件,计数资料以n(%)表示,组间比较采用χ2检验;计量资料采用±SD 表示,采用t检验;APACHEⅡ评分、脓毒症严重程度、血清ⅠL-35、AST水平与脓毒症患者CRRT治疗28d 生存状况关系采用Cox 比例风险模型(Cox 回归)分析检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 脓毒症患者CRRT 治疗预后情况
120 例脓毒症患者经CRRT 治疗后病死20 例,病死率为16.67%(20/120)。
2.2 基线资料比较
病死组入院时APACHEⅡ评分高于存活组,严重脓毒症占比高于存活组(P<0.05);组间其他基线资料比较差异无统计学意义(P>0.05)。表1。
表1 基线资料比较[±SD 或n(%)]
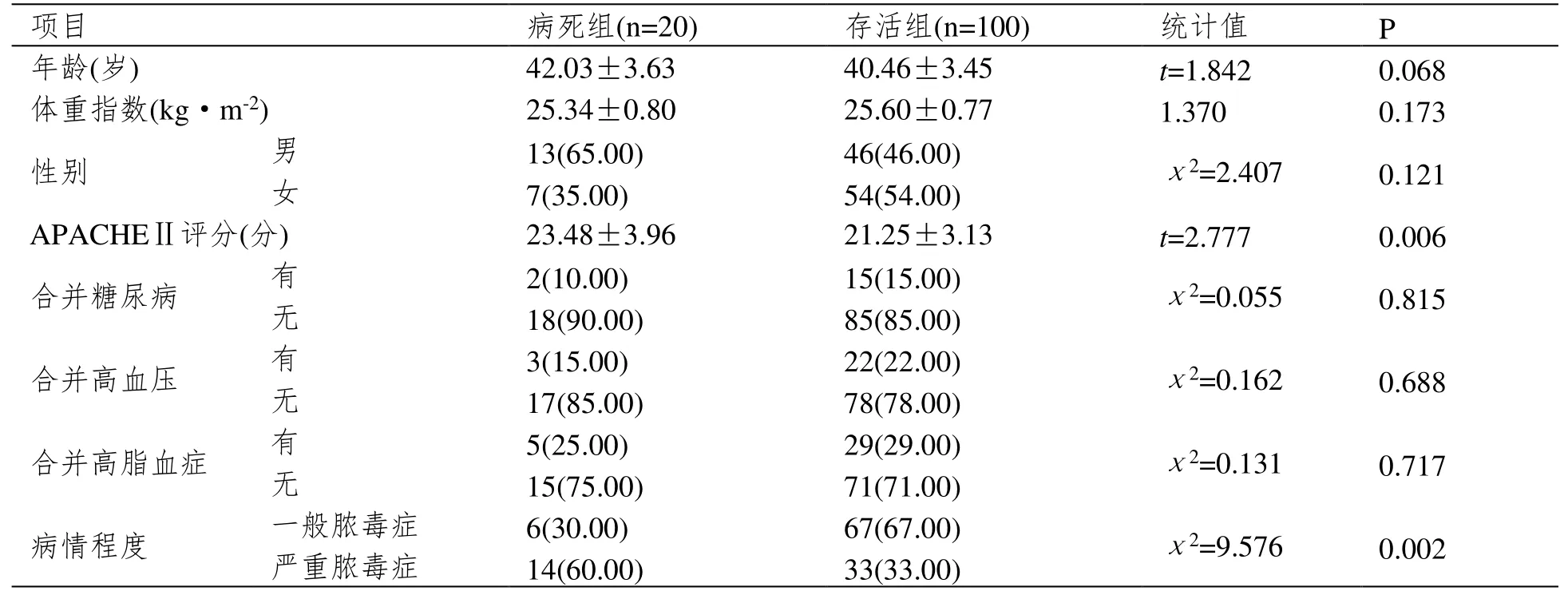
表1 基线资料比较[±SD 或n(%)]
?
2.3 实验室指标比较
CRRT 治疗前,病死组血清ⅠL-35、AST 水平高于存活组(P<0.05);组间其他指标比较无显著差异)。见表2。
表2 实验室指标比较(±SD)
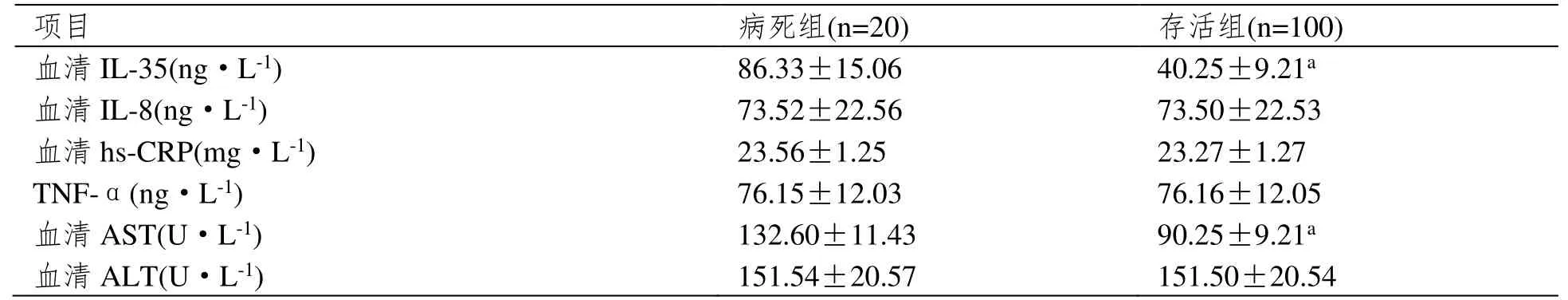
表2 实验室指标比较(±SD)
注:与病死组相比,aP<0.05。
?
2.4 各主要指标与脓毒症患者CRRT 治疗生存状况关系的Cox 分析
将脓毒症患者CRRT 治疗生存状况作为因变量(1=病死,0=存活),并将入院时APACHEⅡ评分、病情程度、CRRT 治疗前血清ⅠL-35、AST 水平纳入作为自变量,经Cox 生存回归分析结果显示,入院时APACHEⅡ评分高、严重脓毒症、CRRT治疗前血清ⅠL-35、AST 水平过表达与脓毒症患者CRRT 治疗生存状况有关,可作为脓毒症患者CRRT 治疗病死风险因子(P<0.05)。
见表3。
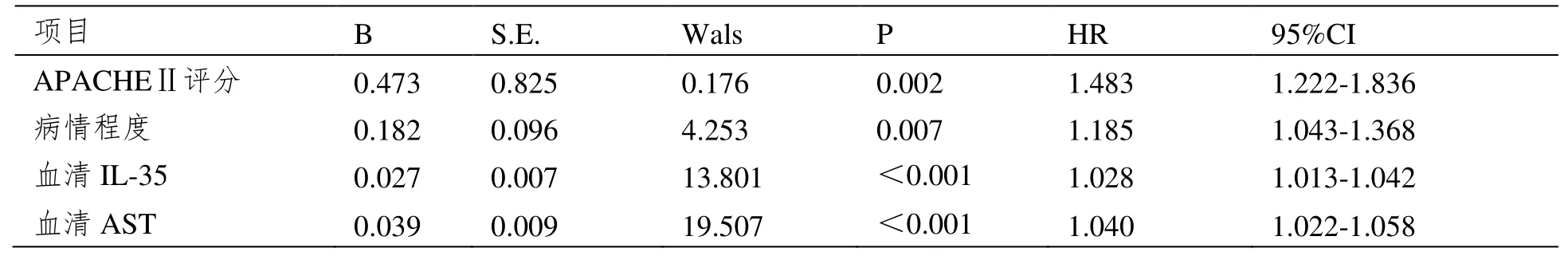
表3 各主要指标与脓毒症患者CRRT 治疗生存状况关系的Cox 分析
3 讨论
CRRT 作为一种体外循环支持治疗技术,能有效降低脓毒症患者病死率,但仍达不到预期治疗效果[1]。本研究中120 例脓毒症患者经CRRT治疗病死率为16.67%,略低于姜少雄等研究结果[6],但仍提示脓毒症患者病死风险高,预后差。ⅠL-35 由调节性T 细胞分泌,在脓毒症的发病、进展过程中参与免疫调节[7]。AST 作为肝脏损伤敏感指标被广泛应用于临床,而肝脏是脓毒症的靶器官[8]。结合ⅠL-35、AST 的作用机制,考虑二者可能与脓毒症患者CRRT 治疗预后有关。本研究结果显示,病死组CRRT 治疗前血清ⅠL-35、AST 水平高于存活组;经Cox 生存回归分析结果显示,CRRT 治疗前血清ⅠL-35、AST 水平过表达与患者生存状况有关,可作为脓毒症患者CRRT 治疗病死的风险因子。分析可能的原因:ⅠL-35 作为免疫抑制细胞因子,过表达可导致机体外周免疫耐受失衡,加剧免疫功能紊乱程度,诱发炎症级联反应,使病情不断发展,不利于预后。AST 水平过表达可影响肝脏机体能量代谢进程,加剧患者持续能量利用障碍严重程度,影响预后。同时,AST水平增加也降低肝脏正常的生理功能,影响体内毒性产物的代谢。因此临床可早期检测脓毒症患者ⅠL-35、AST 水平,及时采取有效的治疗措施,有利于提高患者生存率,改善患者预后。
综上所述,血清ⅠL-35、AST 水平过表达可增加脓毒症患者CRRT 治疗的病死风险,影响患者预后。
