细胞死亡诱导p53靶蛋白1—一种新型凋亡蛋白的功能研究进展*
2023-09-11白彩娟综述魏超君审校
孙 健,白彩娟 综述,魏超君△ 审校
1.甘肃中医药大学公共卫生学院,甘肃兰州,730000;2.国家卫健委胃肠肿瘤诊治重点实验室/甘肃省人民医院,甘肃兰州,730000
细胞凋亡是机体正常发育不可或缺的生物过程,通过清除陈旧或异常细胞发挥机体保护作用,是生物进化过程中有利的生物过程,其功能的失调涉及各种病理和生理过程,包括细胞内稳态、组织重塑及肿瘤等疾病的发生等[1]。细胞凋亡由促凋亡蛋白(Bax、Bak、Bim、Bim、Puma、Noxa、Bad等)和抗凋亡蛋白(Bcl-2、Bcl-xL、Mcl-1等)联合调控,最终由半胱天冬氨酸酶(Caspase) 3或Caspase 7在级联反应的末端杀死细胞[2]。近些年来,越来越多的研究将凋亡相关蛋白作为疾病诊断和药物治疗的靶标并取得突破性进展,如新型抗癌药维奈托克通过选择性抑制抗凋亡蛋白Bcl-2来治疗慢性淋巴细胞白血病[3],然而针对上述凋亡相关蛋白的靶向治疗药物开发受疾病异质性、脱靶效应等因素影响,基于细胞凋亡的相关药物在实际临床应用中的疗效仍不理想。近年来有研究发现,细胞死亡诱导p53靶蛋白1(CDIP1)可通过细胞凋亡多条通路参与细胞凋亡调控[4-6],有望成为新的细胞凋亡相关疾病的治疗靶标,但目前CDIP1与疾病的相关性及调控细胞凋亡的具体分子机制尚不完全明确。本文就促凋亡蛋白CDIP1的凋亡调控机制、与凋亡诱导因子的作用模式及与机体健康相关性研究进展等进行总结和讨论。
1 CDIP1概述
CDIP1也称为C16orf5,定位于16P13.3,由208个氨基酸组成,首次发现于一例癫痫合并发育迟缓患者的脑部,后经研究进一步鉴定为调控细胞外源性凋亡通路的新型凋亡蛋白[4]。CDIP1广泛表达于人体各组织器官,作为肿瘤蛋白P53调控的直接靶标,在Caspase 8活化的前提下,既能单独过表达导致细胞凋亡,也能够与B细胞受体相关蛋白31(BAP31)、凋亡相关基因2(ALG2)等蛋白分子相结合,共同促进细胞凋亡[5-6]。
p53作为DNA损伤反应的关键调节因子,可以动态调控BAX、FAS与Bcl-2的相对表达量,调控细胞凋亡[7-8]。有研究发现,CDIP1的启动子区域(1 618~1 639)包含4个潜在的p53结合位点,在细胞发生DNA损伤后,p53直接作用于CDIP1并促进其转录表达,介导细胞凋亡;在p53缺失的Saos2细胞中,CDIP1对DNA损伤的应答消失,表明CDIP1的功能发挥具有p53依赖性[4]。
在空间结构上,CDIP1主要由细胞质功能区和跨膜结构区组成(图1)[9]。其中,脯氨酸富集区位于CDIP1 N端胞质区,是CDIP1主要的促凋亡功能区域,包含多个促凋亡蛋白的结合位点,如ALG2、BAP31、TSG101等。C端跨膜区域的122~206氨基酸构成了LITAF结构域,该结构包含由22个氨基酸形成的疏水性膜锚定区域(HR),构成一个两亲性螺旋锌指结构,在嵌入膜中锚定蛋白的同时有利于诱导或支持细胞膜弯曲[10]。此外,C末端还有一个FFAT同源结构域,被认为是膜泡关联膜蛋白B(VAPB)的结合位点[11-13]。
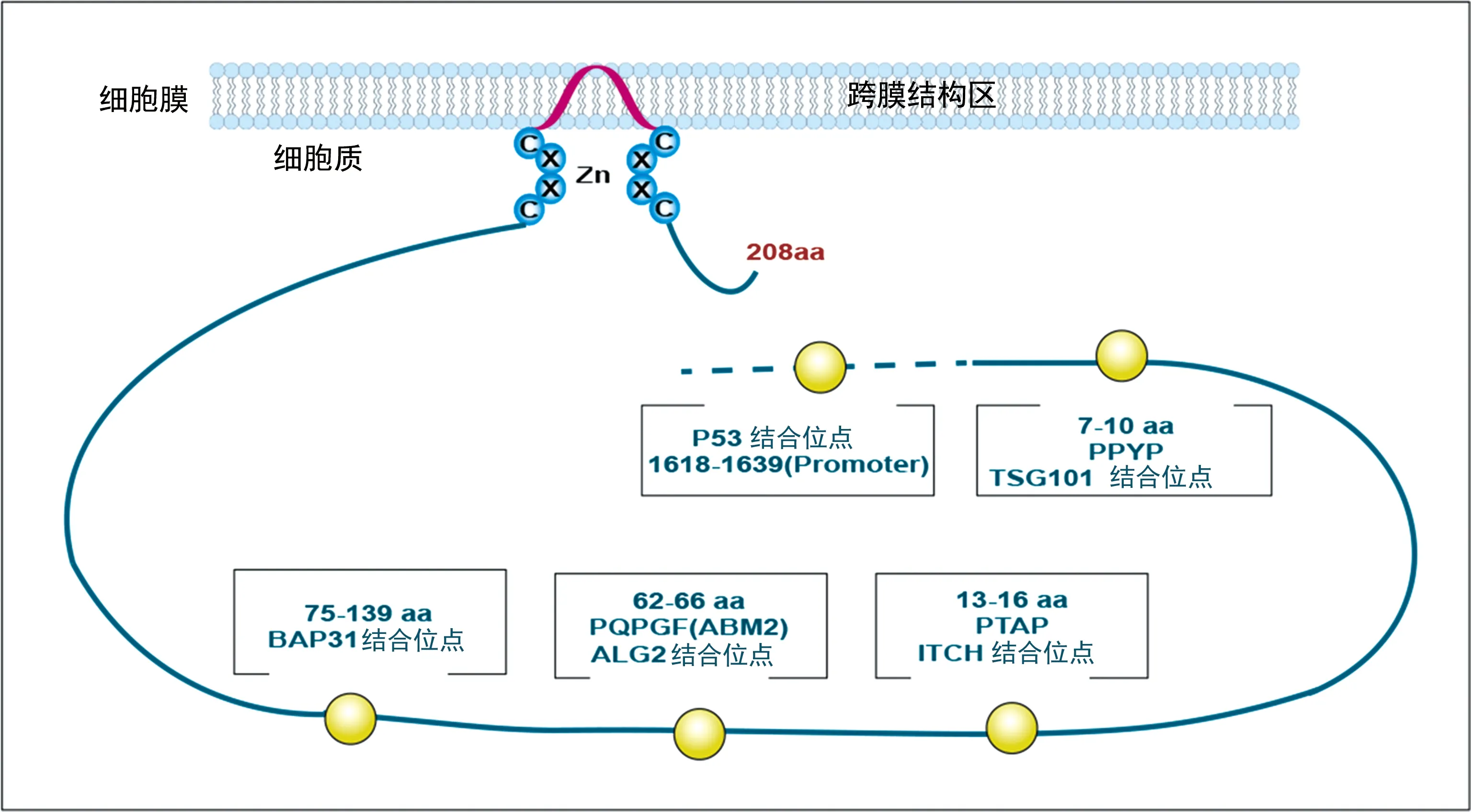
注:CDIP1细胞内定位,以及与TSG101、BAP31、ALG2、ITCH等凋亡相关蛋白的结合位点。
2 CDIP1在细胞凋亡通路中的调控作用
细胞程序性死亡(PCD)是维持体内平衡的基本生理过程,也是对有害刺激的异常病理反应[14]。根据级联反应起始Caspase的不同,将细胞凋亡分为依赖Caspase 8的外源性凋亡通路/死亡受体通路和依赖Caspase 9的内源性凋亡通路/线粒体凋亡通路[12-13]。
2.1CDIP1在外源性凋亡通路/死亡受体通路中的调节作用 在外源性凋亡通路中,外源性凋亡因子[肿瘤坏死因子(TNF)、肿瘤坏死因子配体超家族成员6(FasL)、肿瘤坏死因子-α(TNF-α)、肿瘤坏死因子相关凋亡诱导配体(TRAIL)等]与细胞膜上TNF受体家族中的死亡受体[肿瘤坏死因子受体超家族成员6(Fas)、转铁蛋白受体1(TFR-1)、TNF受体超家族成员(如TNFRSF25、TNFRSF10B)等]结合,招募具有相同结构域的促凋亡蛋白[FAS相关死亡结构域蛋白(FADD)、肿瘤坏死因子受体1相关死亡域蛋白(TRADD)等],水解活化pro-Caspase 8,进一步激活Caspase级联反应,诱导细胞死亡[15-18]。
TNF-α具有多种生物效应,既可以激活核因子κB(NF-κB)通路促进细胞生存,同时也可以激活应激活化蛋白激酶(JNK)、Caspase通路促进细胞凋亡[19]。JNK通路具有多重性,短暂的JNK激活促进细胞生存,相反,当JNK通路长期被激活后,JNK通路的晚期磷酸化促进细胞凋亡[20]。CDIP1可以直接与TNF-α的启动子结合(221~421),促进TNF-α的转录表达[1]。CDIP1诱导TNF-α表达,可以引起JNK晚期磷酸化,在单独使用TNF-α诱导时这种持续的磷酸化并未出现。使用JNK选择性抑制剂处理后,CDIP1-TNF-α-JNK通路介导的细胞凋亡几乎被完全阻断[21](图2)。同时CDIP1诱导的FLIP、SOD2表达下调,这提示CDIP1可能抑制了TNF-α下游的NF-κB促生存信号通路[2]。CDIP1引导的细胞凋亡依赖FADD和Caspase 8的存在,FADD或Caspase 8下调时,CDIP1介导的细胞凋亡均会受到显著抑制,这些证据表明CDIP1引导的细胞死亡主要通过外源性凋亡通路实现[1]。上述研究表明,CDIP1可通过TNF-α持续激活JNK参与外源性细胞凋亡的调控。
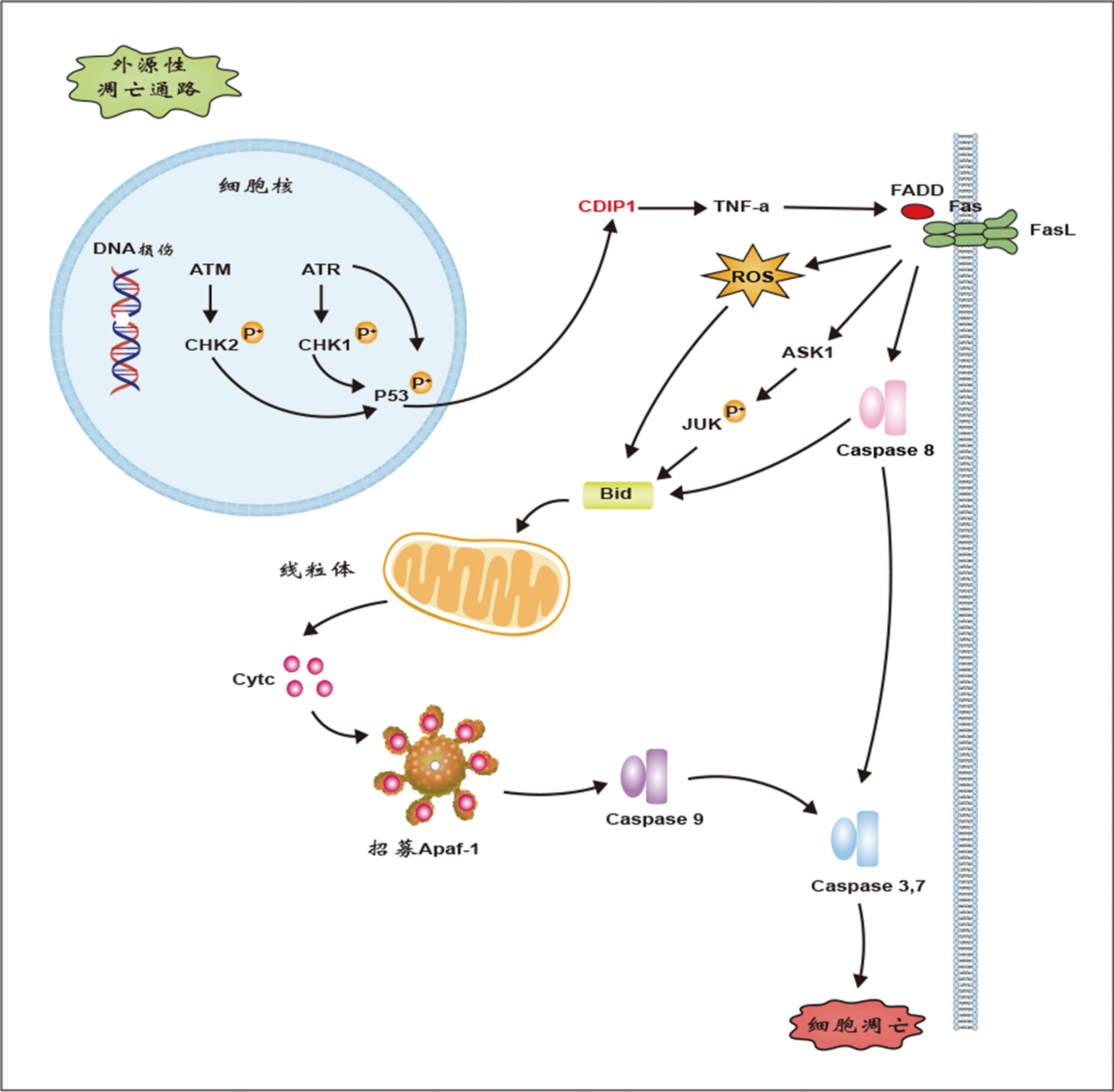
注:CDIP1受到p53转录调控,激活TNF-α下游的死亡受体通路/外源性凋亡通路。
2.2CDIP1在内源性凋亡通路/线粒体凋亡通路中的调节作用 内源性凋亡通路,也称线粒体凋亡通路,受Bcl蛋白家族调控。细胞质中促凋亡的BH3-only蛋白(Bim、Bid、Puma、Noxa、Hrk、Bmf和Bad)同线粒体膜上或膜外的凋亡效应蛋白(Bax和Bak)结合,导致后者发生寡聚化,诱导线粒体膜通透性改变,释放细胞色素C(Cytc)。Cytc与凋亡相关因子(Apaf 1)以dATP依赖的方式形成一个七聚体,募集细胞质中的Caspase 9,激活Caspase 3、7,最终导致细胞死亡[22-23]。
CDIP1在内质网应激后被激活,与内质网上的BAP31结合形成复合物,诱导内质网内的Ca2+转移至线粒体内,同时促凋亡的Bcl2蛋白(Bax、Bid等)被招募至线粒体膜表面并发生寡聚化,线粒体膜电位和膜通透性发生改变,使线粒体内的Cytc释放,激活Caspase 9下游级联反应,通过内源性凋亡通路诱导细胞凋亡。在CDIP1基因缺失的小鼠中,内质网应激引起的内源性凋亡基本消失[6]。
2.3CDIP1在细胞焦亡通路中的调节作用 细胞焦亡是由gasdermin D蛋白的裂解产物通过细胞膜产生非选择性气孔穿孔,伴随白细胞介素(IL)释放,最终导致细胞肿胀坏死的新型PCD模式[14]。革兰阳性病原菌蜡样芽孢杆菌产生的溶血素BL(HBL)能迅速溶解几乎所有哺乳动物宿主细胞,通过诱导钾外流并激活NLRP3炎症小体,导致细胞焦亡[24-25]。研究者利用CRISPR-Cas9全基因组筛选,将CDIP1和LITAF鉴定为哺乳动物HBL的表面受体。HBL通过靶向识别CDIP1和LITAF的共有结构域(SIMPLE结构域)结合到细胞膜上,形成孔洞,改变细胞膜的通透性,最终导致细胞焦亡。上述研究提示,CDIP1可作为细胞焦亡发生过程中关键因子LITAF的替代受体,参与调控细胞焦亡。
综上所述,CDIP1是外源性凋亡的重要调控因子,同时参与了内源性、外源性细胞凋亡通路及细胞焦亡发生的调控。虽然目前CDIP1促凋亡的机制尚不完全明确,但是参与多条凋亡通路特征为CDIP1赋予更高的研究价值,尤其在单一途径抗凋亡/促凋亡药物疗效欠佳时,CDIP1作为疾病治疗和药物开发的天然靶标前景可期。
3 CDIP1相关凋亡诱导因子
3.1凋亡相关基因-2(ALG2) ALG2又称PDCD6,其蛋白由191个氨基酸组成,相对分子质量21×103,由5个具有钙离子结合功能的EF-hand结构域和3个可供蛋白分子结合的疏水口袋结构构成[26]。在Ca2+存在的条件下,ALG2通过疏水口袋1、2与ALG2相关蛋白X(ALiX)结合,促进细胞凋亡;还可通过疏水口袋3与Sec31A结合,促进内质网的囊泡运输[27-28]。
ALG2最早被鉴定为凋亡蛋白,但后续研究发现,ALG2作为Ca2+依赖结合蛋白的适配器,与其他蛋白协同完成对各种生物学过程的调控[29]。ALG2以Ca2+依赖性的方式参与多种蛋白质调控:(1)与转运系统所需的内胚体分选复合体(ALiX、HD-PTP、TSG101、VPS37B、VPS37C、IST1)结合,参与内体的囊泡运输;(2)与Sec31A作用参与内质网到高尔基体囊泡转运的调节及RNA的加工;(3)与annexin A11、annexin A7、copine-4作用,在蛋白磷酸化方面发挥作用;(4)与PATL1、RBM22、CHERP作用,参与RNA的加工[30-35];(5)与ALiX、P53诱导的促凋亡蛋白Scotin及死亡相关蛋白激酶DAPK1等凋亡相关蛋白共同调节细胞凋亡过程[36-37]。
有研究表明,ALG2主要通过脯氨酸(PRO)富集区与多种蛋白结合,通过免疫共沉淀、融合蛋白沉降及DNA定点突变实验等,最终在PRO富集区中确定了3种ALG2结合基序(ABMs),分别是:ABM-1(PPYPXXXXYP)、ABM-2([PΦ]PX[PΦ]G[FW]Ω)和ABM-3(MP重复)及部分不依赖PRO的特殊结构域[38]。ABM-1可以与PLSCR3、CHERP、VPS37B、VPS37C及TSG10结合;ABM-2可以与PLSCR3、Sec31A结合;ABM-3可以与IST1结合。
在CDIP1的PRO富集区中存在62PQPGF,与ABM-2结构类似,可以在Ca2+依赖的条件下与ALG2结合,并作为内吞分类转运复合体-I(ESCRT-I)的配体,促进细胞死亡[11,39]。为了进一步明确CDIP1与ALG2的结合模式及结合位点,笔者通过分子对接软件Autodock Vina进行蛋白分子对接,成功构建了8种蛋白分子对接模型。然后笔者将数据导入分子图形软件PyMOL中,直观展示对接元件及信息,通过对接分数进行排序,获取最佳对接模型及关键氨基酸残基。结果显示,第2个对接模型可信度最高,同时61(MET)、63(GLN)和69(PRO)为关键氨基酸结合位点。这为CDIP1与ALG2的结合方式,以及CDIP1/ALG2轴的促凋亡机制的进一步深入研究提供了更加精确的靶标(图3)。
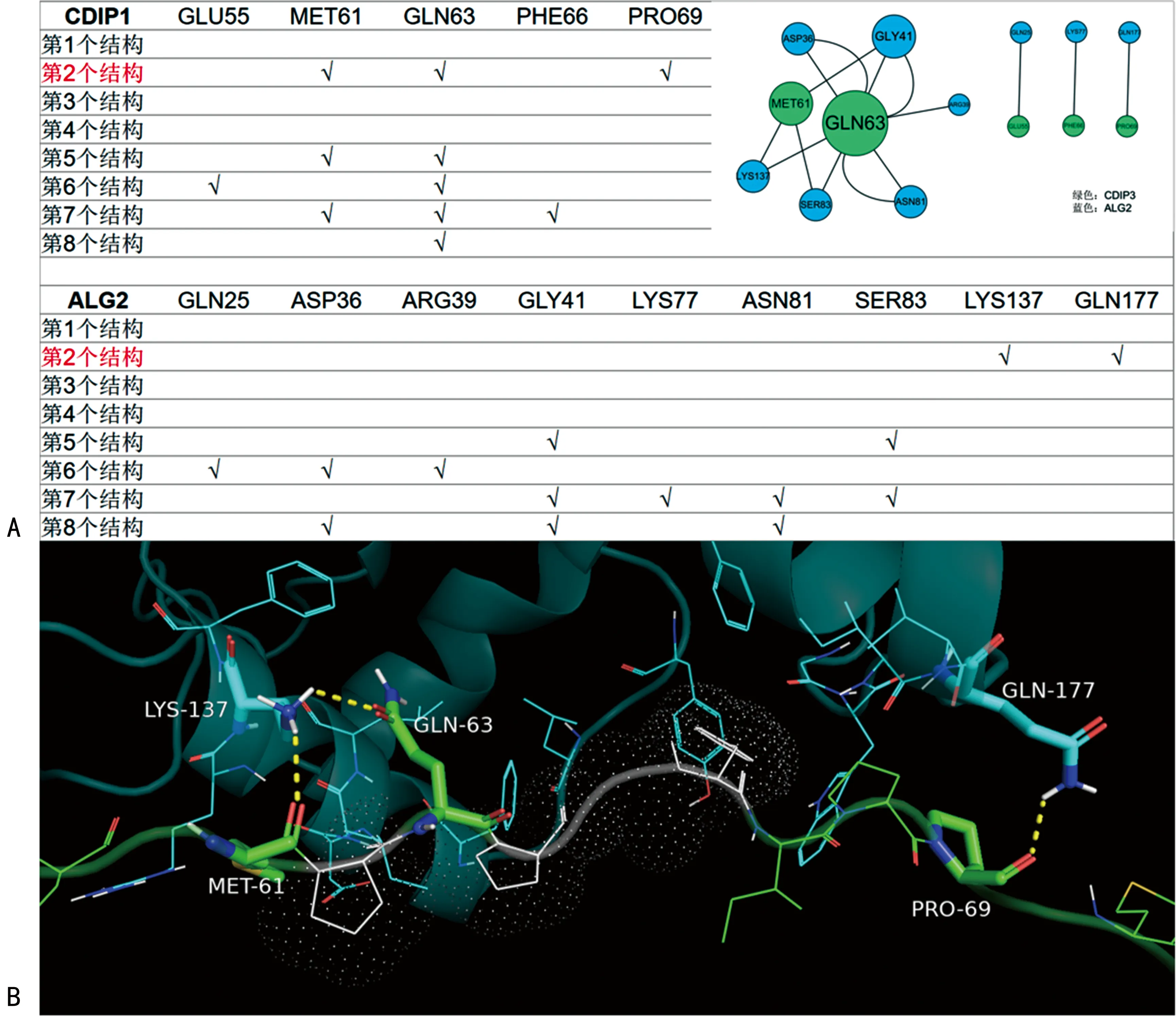
注:A为应用Autodock Vina软件构建 ALG2与CDIP1氨基酸残基相互作用的分子模型,获得8个分子对接模型,其中第2个结构模型被认定为最佳结合模型,同时MET61、GLN63和PRO69确认为ALG2与CDIP1的关键氨基酸结合位点;B为通过图形软件PyMOL对第2个结构模型进行可视化。
3.2B细胞受体相关蛋白31(BAP31) BAP31是一种广泛表达的跨膜蛋白,主要存在于内质网膜中,是某些跨膜蛋白的伴侣蛋白,同时也是细胞凋亡的调节因子[40]。BAP31的N端有2个Caspase 8切割位点,游离的p20BAP31片段可以诱导内质网释放Ca2+,进而引起线粒体凋亡[41]。
CDIP1的75~139氨基酸结构可以与BAP31的128~246氨基酸结构特异性结合。当内质网应激时,P53诱导CDIP1表达上调,被招募到内质网上与BAP31形成复合物CDIP1-BAP31。同时被招募过来的Caspase 8以CDIP1依赖的形式将BAP31切割成具有促凋亡作用的p20BAP31片段,导致内质网Ca2+释放,线粒体摄取细胞质中的Ca2+,Bax激活/寡聚并转移至线粒体膜,引起膜通透性改变[6,42-43](图4)。当CDIP1敲除时,p20BAP31片段的产生受到显著抑制,同时内质网应激介导的线粒体凋亡显著减少,这些表明BAP31裂解依赖于CDIP1的存在,CDIP1是内质网应激导致的内源性凋亡的关键桥梁蛋白。
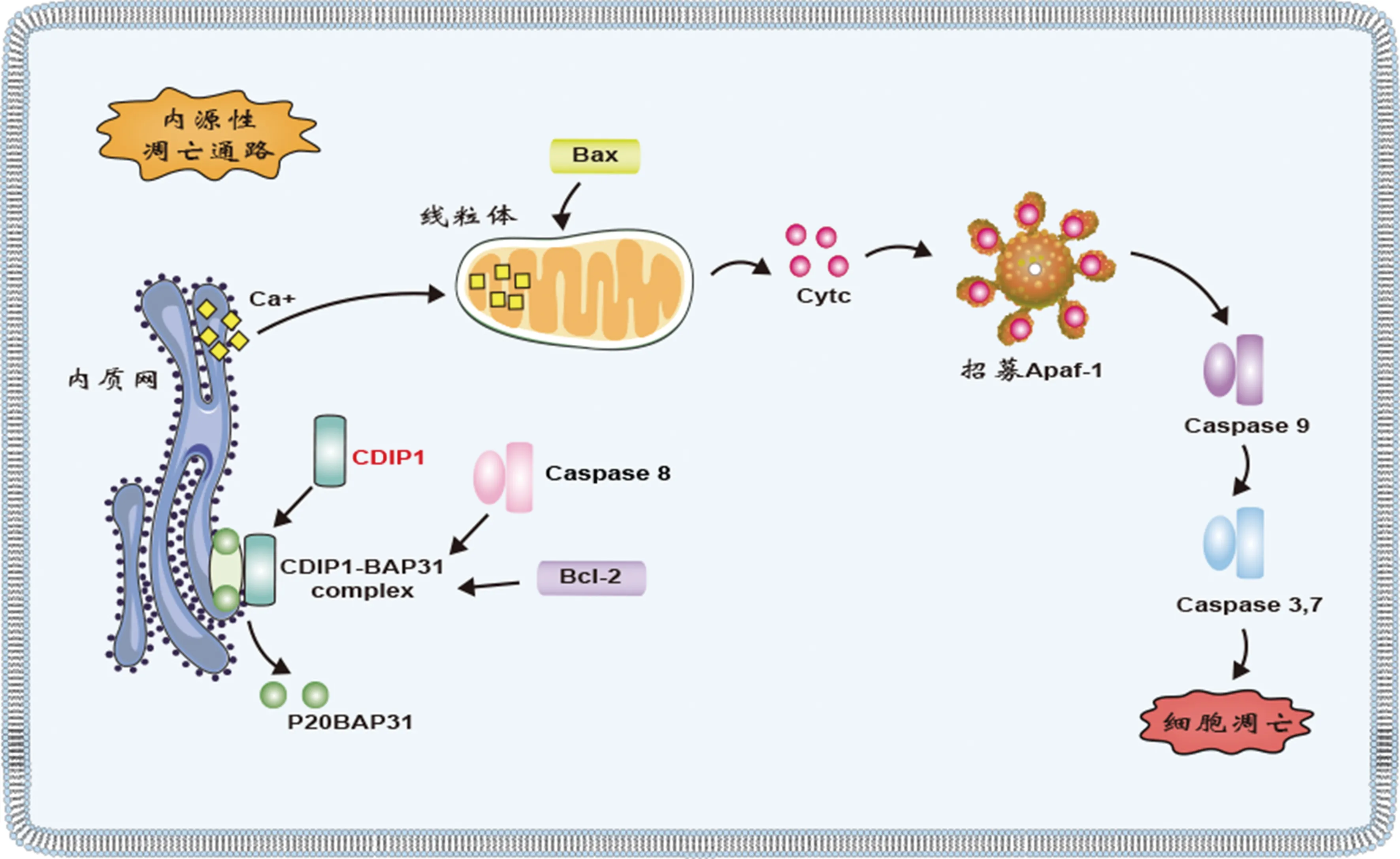
注:内质网应激后,诱导CDIP1表达并转移至内质网表面与BAP31形成复合物,BAP31被切割为具有凋亡作用的p20BAP31,诱导Ca2+由内质网转移至线粒体内,启动线粒体凋亡通路/内源性凋亡通路。
3.3囊泡关联膜蛋白关联蛋白A(VAP) VAP是内质网锚定膜蛋白,作为膜接触位点(MCS)的重要组成部分,与其他细胞器上的伴侣蛋白结合并发挥生物学作用。VAP通过与其他蛋白质中的FFAT(酸性道中的两个苯丙氨酸)肽基序相结合,可将这些含有FFAT基序的蛋白质招募到内质网表面,调节细胞的脂质运输、膜泡运输、微管重组及内质网未折叠蛋白反应[12,44]。CDIP1的C端有一个类似FFAT基序的片段,研究证实其可以与VAPA和VAPB相结合,且该区域是CDIP1促细胞凋亡重要的活性区域。在Ca2+参与下,VAPB、CDIP1和ALG-2形成三联复合物,可以增强CDIP1介导的细胞凋亡[11]。
综上所述,CDIP1通过PRO富集区可以与ALG2、BAP31及VAP 3种凋亡相关蛋白分子结合,发挥促细胞凋亡的作用。目前针对CDIP1的下游蛋白及其调控机理的相关研究报道尚少,与之结合并产生生物学作用的促凋亡蛋白亟待进一步挖掘。同时,CDIP1的上游调控因子及下游效应蛋白尚未深入研究,可结合蛋白的研究将对明确CDIP1调控细胞凋亡的机制,以及后续相关药物的研发奠定坚实基础。
4 CDIP1与疾病
4.1CDIP1在心血管疾病研究的进展 近年来,越来越多的研究者将直接或间接抑制CDIP1的表达作为心血管疾病治疗的新方向,并取得了显著的成果。众所周知,微小RNA(miRNA)是重要的负性调控因子。有研究发现,多种miRNA可与CDIP1 3′端非编码区特异性结合,抑制CDIP1蛋白翻译表达,进一步下调CDIP1凋亡通路下游效应分子Caspase 3的表达,从而抑制细胞凋亡[45-48]。在心肌梗死的小鼠模型中,研究人员通过沉默circNCX1,阻断环状RNA的海绵效应(竞争性吸附miRNA,调控下游蛋白表达),有效增加miR-133a-3p活性,抑制CDIP1蛋白的表达,从而保护心肌细胞免受缺血再灌注造成的损伤[45]。与环状RNA的海绵效应相似,小核仁RNA ZFAS1亦可通过竞争性吸附miRNA-761,增加CDIP1的蛋白表达。通过敲除RNA ZFAS1可以部分缓解小鼠心肌细胞受到缺血再灌注造成的伤害,而直接沉默CDIP1可以有效阻断心肌细胞缺血再灌注后的细胞凋亡[46]。在心肌缺血再灌注损伤期间,内皮细胞比心肌细胞更容易出现损伤。心脏间质特络细胞因其外泌体中含有大量的miRNA-21-5p,可以有效抑制CDIP1表达并改善心肌梗死后的血管生成和再生,其有望成为心脏细胞疗法的新靶标[47]。在病理性高血压中,血管紧张素Ⅱ诱导的线粒体凋亡和内质网应激与CDIP1表达密切相关,并受到miR-210-3p的靶向调控。过表达miR-210-3p可以显著抑制血管紧张素Ⅱ处理后脂肪干细胞内CDIP1的表达,同时抑制细胞内活性氧(ROS)的积累及线粒体膜表面促凋亡蛋白的激活,抵抗细胞凋亡[48]。综上所述,目前针对CDIP1与心血管疾病相关性的研究主要聚焦于通过miRNA干预CDIP1的表达、抑制细胞凋亡亢进引起的相关心血管疾病,CDIP1有望成为心肌细胞发生损伤凋亡的检测标志物。
4.2CDIP1在肿瘤研究的进展 细胞凋亡是清除肿瘤细胞和抑制肿瘤生长的关键生物学途径。随着肿瘤分子生物学的发展,肿瘤凋亡相关分子的靶向治疗已成为综合治疗的热点。CDIP1作为一种新型凋亡因子,在肿瘤学领域的研究尚属探索阶段。根据GEPIA(http://gepia.cancer-pku.cn/index.html)数据库显示,CDIP1在绝大多数肿瘤中呈低表达,推测肿瘤细胞通过抑制CDIP1达到抵抗细胞凋亡的作用,但具体机制亦不明确。目前,CDIP1已经成为肿瘤诊断和治疗的新靶标:在非小细胞肺癌中,IL-33可以调控miR-128-3p表达,靶向抑制CDIP1及下游蛋白Bax、Cleaved Caspase-3、Cytc及PARP的表达,增强Bcl-2表达,促进非小细胞肺癌细胞的增殖、迁移和侵袭[49]。CDIP1是内外源性凋亡通路及内质网通路的关键因子,同时也是细胞焦亡的重要调控因子。因此,CDIP1通过调控细胞凋亡参与肿瘤发生发展的研究有望为基于细胞凋亡干预的肿瘤治疗提供新靶标。
5 小 结
靶向细胞凋亡治疗是对抗凋亡相关疾病的有效策略,但是受疾病发病机制的复杂性等因素影响,针对单一凋亡通路的药物靶标往往效果局限。因此,发现新型、多凋亡通路的促凋亡因子及其结合蛋白成为了疾病治疗新靶标和新方向。CDIP1作为新型促凋亡蛋白,可通过外源性凋亡通路介导细胞凋亡;同时,可与BAP31联合调控内质网应激引起的内源性凋亡通路;其次,与ALG2协同其他促凋亡因子协同调控细胞凋亡;另外,在HBL介导的细胞焦亡中也充当重要的生物靶标。基于此,CDIP1是基于细胞凋亡干预药物研发的理想靶标。目前CDIP1促细胞凋亡的上下游机制尚不完全明确,其调控蛋白研究较少,在疾病中仍局限于作为细胞凋亡指标应用,其异常表达与疾病发生发展,以及与肿瘤细胞凋亡抵抗的相关性尚待深入研究和探讨。基于此,CDIP1及其调控的凋亡诱导因子在抗疾病药物靶标的研究及应用中具有良好的应用前景。
