MALAT1、HOTAIR、NEAT1 调控结直肠癌的研究进展*
2023-09-11李瑞娜李宁宁综述高小玲审校
李瑞娜,徐 辉,李宁宁 综述,高小玲△ 审校
1.甘肃省人民医院麻醉科,甘肃兰州 730000;2.海南省人民医院检验科,海南海口 5701003.兰州市妇幼保健院儿科,甘肃兰州 730000
结直肠癌(CRC)是全球第三大最常见的恶性肿瘤,也是第二大癌症死亡的原因[1]。2020年全球CRC新发病例约190万,死亡病例约 93.5万,遗传因素及不良饮食习惯和生活方式是导致CRC发病的主要原因[2]。全球CRC死亡率不断上升,尤其是发展中国家,2020年中国CRC发病人数占全球CRC发病人数的28.8%[2]。CRC发病率和死亡率持续上升的原因是缺乏早期诊断和有效治疗,目前内镜和手术切除、全身辅助化疗、放疗、靶向疗法和免疫治疗是CRC治疗的几种常见方法[3],然而,许多晚期患者对目前治疗疗效不佳,CRC患者的生存高度依赖于早期诊断和早期治疗,尽管靶向疗法最近取得了进展,但其临床疗效有限,无法治愈且负担不起,因此,更多的替代疗法和新的诊断方法对治疗CRC患者至关重要。
1 长链非编码RNA(lncRNA)作为竞争性内源性RNA的调控机制概述
lncRNA是一种长度大于200个碱基且没有开放阅读框的RNA分子,是RNA聚合酶Ⅱ的转录产物,但不具有蛋白编码能力[4]。最开始lncRNA被认为是基因组转录的“垃圾”,不具有生物学功能[5]。随着高通量测序的发展,有研究发现lncRNA参与基因调控的许多生物学过程,包括X染色体沉默、转录激活、染色质修饰及核内物质的运输等过程[6],lncRNA被认为是多种癌基因和肿瘤抑制因子的增强子、支架或分子诱饵[7]。在CRC中lncRNA的上调或下调,影响了CRC细胞增殖、侵袭、迁移及耐药,可作为CRC诊断及预后的生物标志物[8]。有研究发现,这些生物学作用大多数与lncRNA作为竞争性内源性RNA(ceRNA)网络机制有关,可作为ceRNA的lncRNA、环状RNA(cirRNA)、假基因,可以通过miRNAs反应元件(MREs)竞争性结合miRNA,抑制 miRNA与靶mRNA的3′UTR端结合,促使miRNA下游靶基因的表达,形成ceRNA调控网络[9-10]。ceRNA调控网络作为肿瘤的一种作用机制备受关注,参与了许多生物学过程,包括增殖、迁移、侵袭和凋亡以及化疗耐药[10],深入探讨ceRNA调控网络机制,对于癌症进展的诊断、预后相关生物标志物的发现,以及药物靶向治疗都是至关重要的。
2 lncRNA通过ceRNA参与CRC的增殖、侵袭、迁移、凋亡以及耐药
许多lncRNA作为ceRNA,含有多种类型和数量的miRNA特异性结合位点,与CRC的各种生物学功能都有关系,其中肺腺癌转移相关转录因子1(MALAT1)、HOX反义基因间RNA(HOTAIR)、核富集转录本1(NEAT1)这3个lncRNA作为促癌基因,在CRC中促进增殖、侵袭、迁移、凋亡以及耐药,本文对这3个lncRNA作为ceRNA的调控机制做了详细地总结。
2.1MALAT1 MALAT1,也称作核富集常染色体转录物-2 (NEAT-2),位于11q13.1染色体上,长约8.1 kb[11]。MALAT1最早在小细胞肺癌中被发现,后来在多种癌症中被发现具有生物学作用,包括胃癌[12]、肝癌[13]、乳腺癌[14]、胰腺癌[15]、CRC[16]等。研究表明MALAT1作为ceRNA在 CRC 中显著上调,调控CRC细胞的增殖、侵袭和转移(图1)。SUN等[17]研究发现Yes相关蛋白1(YAPl)敲低下调结肠癌细胞中MALAT1致癌基因的表达,YAP1通过MALAT1调控结肠癌细胞增殖和转移,YAP1与β-连环蛋白(β-catenin)/T细胞第四因子(TCF4)形成的复物,通过竞争性结合miR-126-5p,在转录后水平增强了血管生长因子(VEGFA)、锌指结构转录因子(SLUG)和碱性螺旋环螺旋转录因子(TWIST)的表达,促进了CRC的增殖、侵袭、迁移。MALAT1还可通过组蛋白甲基化修饰,增强β-连环蛋白(β-catenin)信号传导途径的活性,促进CRC增殖、侵袭和转移。WU等[18]研究发现,十字形结构域蛋白 2C(JMJD2C)在CRC肿瘤组织中过表达,JMJD2C作为MALAT1的上游调控靶标,可以直接结合到MALAT1启动子区域,即三甲基化组蛋白H3赖氨酸9(H3K9me3)和三甲基化组蛋白H3赖氨酸36(H3K36me3)的位点上,降低组蛋白甲基化水平,促进CRC增殖、侵袭和转移,因此,MALAT1可能是预防和治疗CRC转移的有用靶点。另外有研究报道,MALAT1可以与一种抑制癌基因表达的肿瘤抑制蛋白结合——聚嘧啶束结合蛋白(PTB)相关剪接因子Q(SFPQ), MALAT1表达的上调可导致SFPQ蛋白表达的增加,MALAT1可以与SFPQ竞争性结合,使PTBP2从SFPQ/聚嘧啶束结合蛋白复合体(PTBP2)中释放,释放后的PTBP2促进CRC细胞增殖、侵袭和迁移[19]。此外,MALAT1可以通过激活PI3K/Akt/mTOR信号通路,增强FUT4相关岩藻糖基化和磷酸化水平,促进CRC的增殖、侵袭、迁移[20]。FUT4是岩藻糖基化的关键酶,据先前的报道,FUT4与CRC患者对西妥昔单抗或贝伐单抗耐药性相关。XU等[20]研究报道,MALAT1通过抑制miR-26a/26b来调节岩藻糖基转移酶4(FUT4)的表达,使CRC细胞侵袭性增强。RAB14是RAS癌基因家族的一个小GTPase成员,包含170多个成员,分为5个亚家族——RAS、RAB、RHO、ARF和RAN。有研究发现MALAT1通过充当ceRNA抑制了miR-508-5p的表达,RAB14作为miR-508-5p的下游靶标,促进CRC发展,这为CRC治疗提供了治疗靶点[21]。有研究发现,表达上调的MALAT1促进CRC细胞的增殖与自噬激活有关,体外实验证明了MALAT1与微管相关蛋白轻链3Ⅱ(LC3-Ⅱ)表达水平呈正相关,MALAT1通过激活自噬和抑制CRC细胞系中miR-101的表达促进细胞增殖[22]。此外,在CRC组织中MALAT1表达上调,抑制miR-619-5p的表达,与TNM分期、转移、无病生存时间和总生存时间相关,被认为是Ⅱ期或Ⅲ期CRC患者诊断和预后因素的生物标志物[23]。上述的研究表明,MALAT1通过ceRNA机制在CRC的发生发展中发挥重要的作用,深入研究MALAT1的ceRNA机制,有助于理解CRC复发和转移的可能分子机制,并为CRC患者提供更多的治疗靶点。
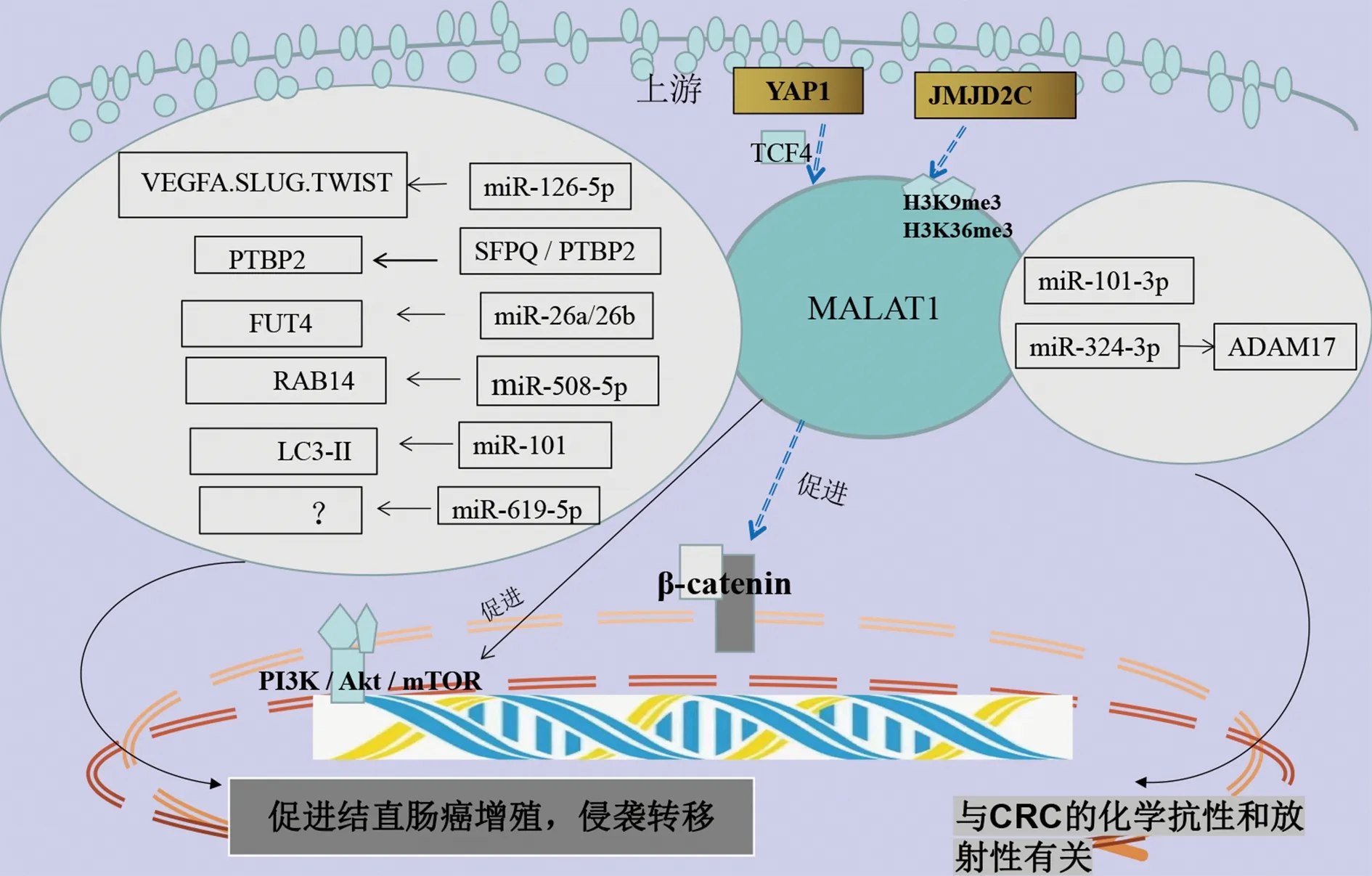
注:图的左边是MALAT作为ceRNA,在CRC中促进癌细胞的增殖、侵袭和转移相关的micRNA/mRNA,图的中间是MALAT的上游调控靶标及相关的信号通路,图的右边是MALAT与放射敏感性和化疗耐药性相关其的micRNA和靶向的mRNA。
MALAT1异常升高还可导致CRC细胞产生放射抵抗性与化疗耐药现象,其具体机制仍待进一步研究。有研究发现MALAT1调控miR-101-3p、miR-324-3p的表达,与CRC放射抵抗性、化疗药物奥沙利铂的耐药相关[24-25](图1)。其中GUO等[24]的研究发现,MALAT1/miR-101-3p轴调节CRC的放射抵抗性,这可能在不久的将来是放疗抵抗的一个前瞻性的治疗方法,然而,这项研究并未发现miR-101-3p作用的下游靶标,可以继续深入研究,这将为CRC放疗提供新的潜在增敏靶点。MALAT1在耐奥沙利铂的CRC组织和细胞中显著上调,通过与 miR-324-3p竞争性结合,使整合素-金属蛋白酶17(ADAM17)的表达增加,MALAT1通过miR-324-3p/ADAM17轴,在CRC中发挥促奥沙利铂耐药的作用[25]。总之,MALAT1介导的ceRNA网络调控可能成为 CRC潜在的诊断及治疗的靶点。
2.2HOX反义基因间RNA(HOTAIR) HOTAIR 是位于12 q13.13染色体的HOXC基因簇,由2 158个核苷酸和6个外显子组成的聚腺苷酸化RNA[26]。lncRNA HOX转录反义RNA(HOTAIR)通过募集染色质修饰因子来抑制同型盒基因D簇(HOXD)的表达[26]。有研究发现,在CRC中与相应的正常结肠上皮细胞(FHC)相比,HOTAIR在CRC细胞系和CRC组织中的表达显著增加,与CRC转移及不良预后相关[27]。临床CRC标本中HOTAIR水平的升高与TNM分期、pT分期、远处转移和较差的总生存期相关[27],促进了CRC细胞的进展。据报道,HOTAIR和不同miRNA之间的串扰,激活下游Wnt/β-catenin、PI3K/AKT、JAK/STAT等信号通路,可以控制癌症进展(图2)。HOTAIR通过直接海绵miR-206,下调miR-206的表达,miR-206激活下游CC趋化因子配体2(CCL2)的功能,在CRC中发挥促癌基因的作用,诱导CRC增殖和侵袭,HOTAIR/miR-206/CCL2轴将是CRC新的治疗靶点,有趣的是,该项研究在动物实验中发现,CCL2激活了下游Wnt/β-catenin信号通路,促进了CRC肝转移[28]。XIAO等[29]研究发现在CRC细胞系中,HOTAIR敲低和miR-203a-3p过表达均可抑制细胞增殖,β-catenin和GRG5是miR-203a-3p的抑制靶点,miR-203a-3p通过抑制β-catenin和GRG5的表达,从而抑制Wnt/β-catenin信号通路,HOTAIR通过miR-203a-3p介导的Wnt/β-catenin信号通路,促进CRC细胞增殖。PAN等[30]的研究证明了HOTAIR作为ceRNA与miR-326的“海绵”,靶向下游的岩藻糖基转移酶6(FUT6),FUT6调节下游CRC细胞表面的α 1,3聚焦的CD44糖蛋白的表达,激活了磷脂酰肌醇3-激酶(PI3K)蛋白激酶B(AKT)信号通路,调节CRC进展,这项研究的结果为CRC提供了新的治疗靶点和预后指标。ST6GAL1是一种修饰间质表皮转化因子(c-Met)的潜在酶,LIU等[31]研究证明,在CRC进展期ST6-β半乳糖胺α-2,6唾液酸转移酶1(ST6GAL1)上调,HOTAIR和miR-214可以有效调节ST6GAL1的表达水平,形成调节性 HOTAIR/miR-214/ST6GAL1轴,激活下游的JAK-STAT信号通路,促进CRC进展,为CRC的早期诊断和治疗靶点提供了有价值的信息(图2)[31]。
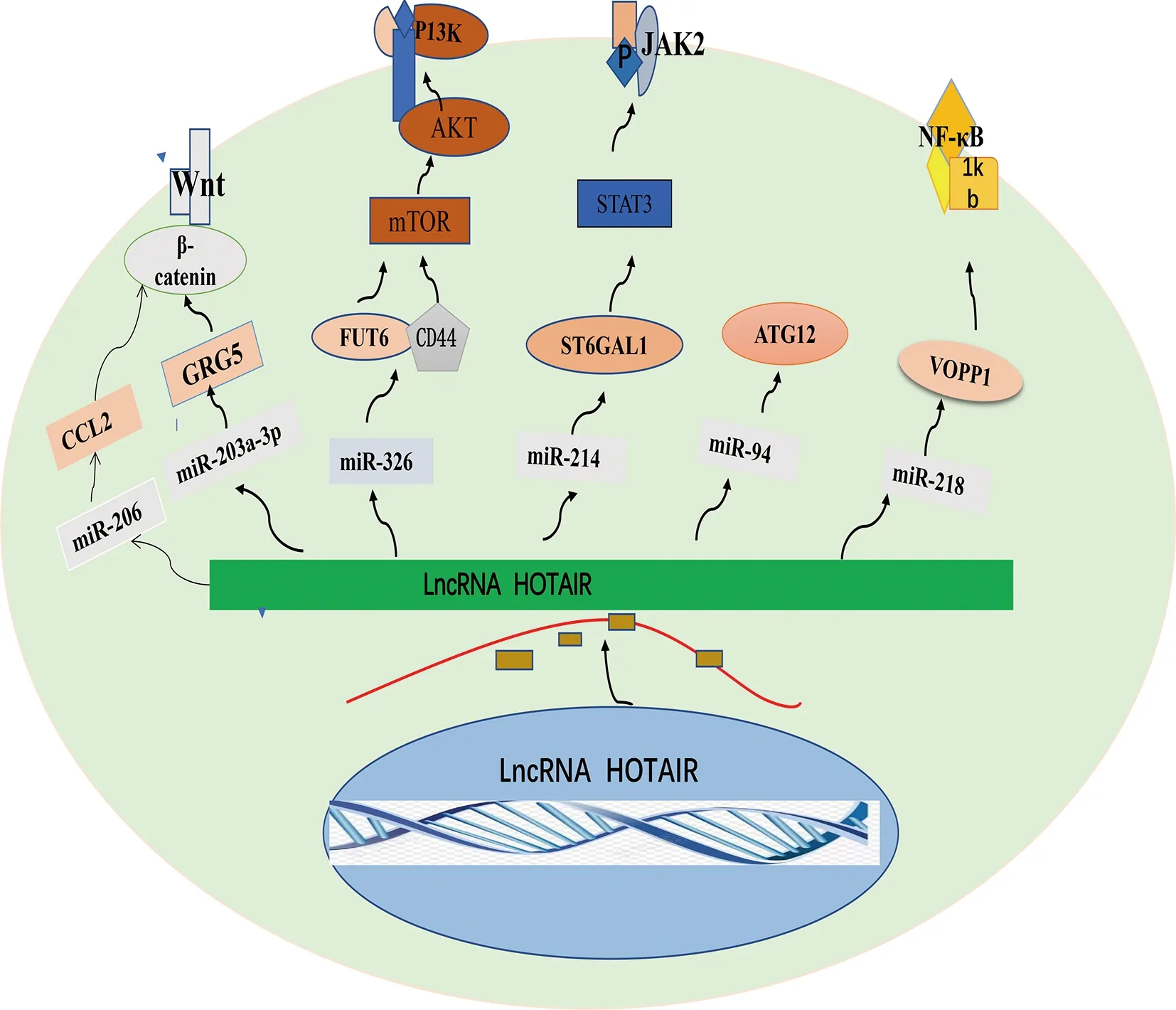
图2 HOTAIR在CRC中作为ceRNA,调控的micRNA/mRNA信号通路
此外,有研究证明HOTAIR在CRC中与放射敏感性和化疗耐药性相关。研究发现,放疗后CRC患者的血浆和细胞中的HOTAIR表达明显上调,通过诱导细胞凋亡,抑制细胞自噬,增强了CRC细胞的放射敏感性,HOTAIR敲低可通过调控CRC中miR-93/ATG12轴,增强放射敏感性[27]。晚期CRC治疗失败的一个主要原因是对氟嘧啶(FU)的化疗产生耐药性,HOTAIR通过促进胸苷酸合成酶的表达,抑制5-FU诱导的CRC细胞毒性,XIAO等[29]证明HOTAIR/miR-203a-3p/Wnt/β-catenin轴,促进CRC细胞的增殖和CRC细胞的耐药性。5-FU是转移性CRC化疗方案的主要手段之一,LI等[32]研究发现,HOTAIR通过抑制miR-218的表达和激活NF-κB/TS信号通路,促进CRC细胞对5-FU的化学抗性,VOPP1被证明是miR-218的功能靶点,HOTAIR直接招募EZH2,并通过结合其启动子抑制miR-218的表达,这为CRC中VOPP1的异常激活提供了机制基础。因此,抑制HOTAIR可能是增强5-FU化疗敏感性的未来方向(图2)[33]。
2.3核富集转录本1(NEAT1) NEAT1位于11号染色体上,长约3.1 Kb,是一种广泛表达于多种哺乳动物细胞的lncRNA[33]。越来越多的研究表明, NEAT1在许多人类恶性肿瘤中表达上调,包括乳腺癌[34]、肺癌[35]、食管癌[36]、胃癌[37]和CRC[38]。其中NEAT1在CRC中过表达,并发挥致癌作用,在多种生物学和病理学过程中发挥关键作用,了解其表达如何被调控以及其调控的靶基因是非常重要的,研究发现NEAT1有多个与miRNA结合的靶位点,如miR-216b、miR-193a-3p、miR-205-5p等,在CRC中作为促癌基因,促进细胞增殖、迁移和侵袭、抑制细胞周期的停滞和凋亡[39-41]。ZHU等[39]的研究发现NEAT1作为CRC的致癌基因,通过直接海绵miR-216b,激活YY1的表达,从而促进CRC细胞的凋亡和侵袭能力。Kirsten大鼠肉瘤病毒癌基因同源物(KARS),是一种小GTP酶,它属于RAS超蛋白家族,ZHU等[40]的研究揭示了敲除NEAT1可通过调节miR-193a-3p/KRAS,抑制CRC细胞的增殖、侵袭。另外一项研究结果显示,NEAT1通过抑制miR-196a-5p,进而上调胶质细胞源性神经营养因子(GDNF)的表达,促进CRC细胞的增殖和迁移的潜能[41]。NEAT1还可调节血管内皮生长因子(VEGFA)的表达,LIU等[42]得出结论,抑制NEAT1的表达或miR-205-5p过表达,可以抑制VEGFA的表达。NEAT1还可激活Wnt/β-catenin通路,ZHANG等[43]的研究证明了NEAT1直接与DEAD-box RNA解旋酶5(DDX5)结合,激活Wnt信号传导,NEAT1和DDX5联合使用可能是CRC的重要预后指标。另外有研究证明了NEAT1与CRC患者的生存期相关,高表达者总生存期较低,NEAT1靶向miR-195-5p并抑制miR-195-5p的表达,中心体蛋白55(CEP55)是miR-195-5p的下游调控靶标,NEAT1通过吸附miR-195-5p,调控CEP55的表达,抑制CRC细胞增殖、迁移、侵袭、促进细胞凋亡[44]。从以上的研究中可以看出NEAT1在促进CRC细胞的增殖和迁移潜能中发挥了关键作用,可以为CRC的诊断和治疗进展提供新的见解(图3)。
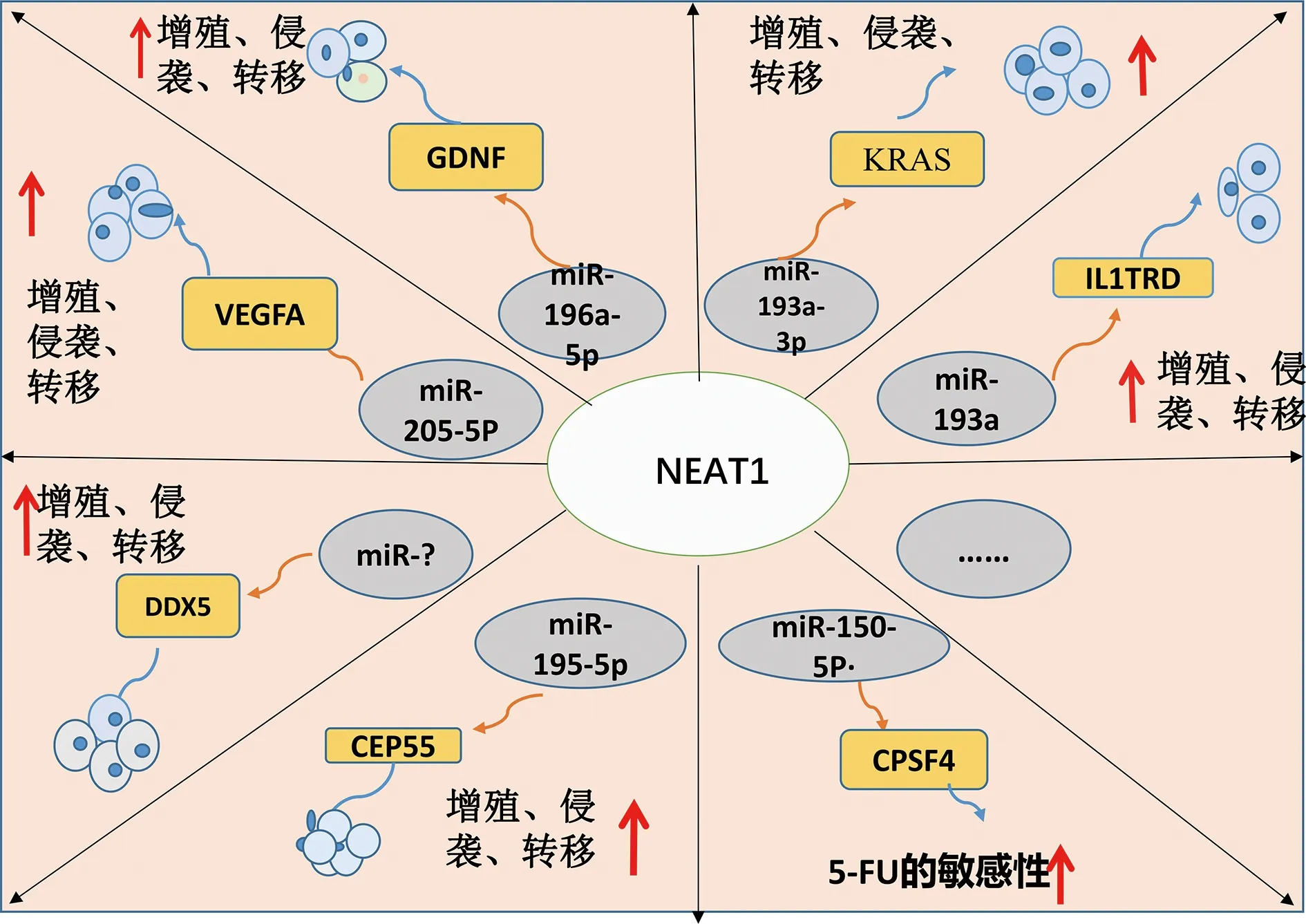
注:NEAT1作为ceRNA相关的miRNA及mRNA,促进CRC的增殖、侵袭和转移,以及化学抵抗性;↑表示促进。
NEAT1还与结肠癌中的5-FU耐药性相关,WANG等[45]的研究证明了NEAT1敲除可促进5-FU敏感性,增强细胞凋亡、抑制CRC细胞侵袭,CPSF4是miR-150-5p的下游靶点,CPSF4的表达受NEAT1和miR-150-5p的调控NEAT1/miR-150-5p/CPSF4轴为CRC的治疗提供了另一新的靶点。另外有研究发现,NEAT1影响CRC的耐药性是通过调节CRC细胞的细胞干性,下调的NEAT1降低了干性因子的表达,主要是通过影响染色质重塑,导致乙醛脱氢酶1(ALDH1)和c-Myc蛋白启动子区域的乙酰化水平增加,从而增强了CRC细胞的干性,促进CRC对5-FU耐药性(图3)[38]。
3 总结和展望
lncRNA在基因转录、表观遗传和转录后水平调控靶基因的表达能力,miRNAs作为致癌基因或肿瘤抑制因子调节细胞增殖和分化的功能,lncRNA和miRNAs之间的串扰控制癌症进展,lncRNA的ceRNA调控网络机制及其参与CRC的发病机制等方面越来越受到研究者的关注。
MALAT1作为一种新发现的lncRNA,其异常表达会抑制miRNA表达,从而促进下游癌基因的表达,它作为致癌 lncRNA 在各种人类恶性肿瘤中上调,并与不良预后相关。多项研究显示HOTAIR在CRC中异常高表达,通过激活Wnt /β-catenin、NF-κB信号通路,促进CRC的进展以及对5-FU的耐药性,这些研究证实了lncRNA在CRC中作为生物标志物的作用,它们在癌症的诊断和预后中均具有重要意义,可被视为CRC的治疗新靶标。综上所述,lncRNA作为重要的转录调控物,可多方面影响CRC的发生与发展,可以用作CRC患者的预测和治疗的靶标。
总之,lncRNA的失调与CRC的进展与预后密切相关,但是,这个领域充满了未解决的问题,未来的研究工作应关注lncRNA在促进CRC进程中的功能和分子模式在临床中的应用,而不只是在实验中证明lncRNA的作用机制,这对于开发lncRNA作为新的生物标志物和获得具有高特异度和灵敏度的治疗方法是极为必要的,这将会成为CRC患者治疗的一大突破点。
