联合IMRT 和化疗对比单独IMRT 在老年鼻咽癌患者治疗中的疗效及毒副反应*
2023-09-11李雅琦熊婷婷周杰路顺
李雅琦,熊婷婷,周杰,路顺
610041 成都,电子科技大学 医学院(李雅琦、熊婷婷);610041 成都,四川省肿瘤临床医学研究中心,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学附属肿瘤医院 头颈放疗科(周杰、路顺)
鼻咽癌(nasopharyngeal carcinoma,NPC)好发于东亚和东南亚,全球有70%的病例都在这两处。由于病灶处于特殊的解剖位置,放射治疗是主要的治疗方式。对于晚期疾病患者,推荐放疗与化疗相结合。老年人NPC 的治疗尤其具有挑战性。与年轻患者相比,老年患者由于合并症、营养状况、器官功能和/或社会支持不佳,抗癌治疗的毒性风险更高[1-3]。因此,本研究为了评估在三维调强放疗(intensity-modulated radiation therapy,IMRT)时代,老年(年龄≥70 岁)NPC 患者接受单独IMRT 与IMRT 联合化疗的治疗效果及毒副反应,对比两者之间是否存在差异,以期为临床提供治疗依据。
1 资料与方法
1.1 一般资料
将2011 年1 月至2020 年11 月在四川省肿瘤医院首次诊断为NPC 的患者纳入本研究,纳入标准:(1)临床资料未缺失;(2)年龄≥70 岁;(3)经活检确认为NPC;(4)所有患者均在治疗前进行一系列检查以确保无转移;(5)因一般状况、社会支持等原因仅接受单独IMRT 或IMRT 联合化疗治疗。排除标准:(1)初诊时即发现有远处转移的患者;(2)因心、肺、肾等严重合并症而无法进行根治性放疗的患者;(3)合并其余恶性肿瘤;(4)临床资料不完整。根据第8 版AJCC/UICC[4]对所有入组患者进行重新分期,并通过成人共存疾病评价指数ACE-27 评分标准[5]对所有患者进行并发症评分。
1.2 方法
1.2.1 放疗方法及照射 所有患者均接受了根治性IMRT,靶区勾画及处方剂量参照RTOG0225[6]和RTOG0615[7]。肿瘤靶区(gross tumor volume,GTV)为68~76 Gy;高危临床靶区(clinical target volume 1,CTV1)为60~66 Gy;低危临床靶区(clinical target volume 2,CTV2)为50~54 Gy。阳性淋巴结GTVnd 为 66~70 Gy,双侧颈部淋巴引流区 CTVln为50~54 Gy。所有治疗计划应保证正常组织受照射剂量尽可能在危及器官的耐受剂量标准的70%以下。每天照射1 次,每周进行5 次,每次2~2.2 Gy。每位患者均按计划完成治疗,且未出现因并发症而导致放疗暂停或终止的情况。具体放疗技术方法参考本中心其他放疗相关研究[8]。
1.2.2 化学治疗 本研究中所收集的患者所行化疗方案可分为:诱导化疗、同步化疗以及辅助化疗,最常用以铂类为基础的化疗方案。若患者首次顺铂化疗后出现较重的消化道反应、骨髓抑制等各类不良反应,后续更换为替代铂衍生物如奈达铂或卡铂为基础的治疗。将顺铂累计剂量大于200 mg/m2视为完成化疗[9-11],所有联合IMRT 和化疗组患者均完成化疗。化疗前均预防性止吐、护胃等治疗,放化疗期间出现如白细胞减少、血小板减少、肝功能异常等血象、生化异常,均积极给予支持对症治疗,出现严重不良反应时暂停治疗。
1.3 疗效及毒副反应评价
采用RECIST 1.1 版[12]评估肿瘤反应率,分别为完全缓解(complete remission,CR),定义为所有靶病灶完全消失;部分缓解(partial remission,PR),定义为靶病变最大径之和缩小≥30%;稳定(stable disease,SD),定义为变化处于部分缓解和进展之间;疾病进展(progressive disease,PD),定义为靶病变最大径之和增大≥20%或出现新病灶。以CR+PR计算总有效率。远期疗效评估指标主要包括总体生存率(overall survival,OS)和疾病无进展生存率(progression-free survival,PFS),根据不良事件通用术语标准(CTCAE 4.0 版)[13]评估不良事件;并使用放射治疗肿瘤协作组的放射病率评分标准(RTOG/EORTC)[14]评估与放疗相关的毒性。
1.4 随访
治疗结束后前2 年需每3 个月进行1 次全面复查,采用MRI、计算机断层扫描、鼻咽镜以诊断局部复发,行胸部计算机断层扫描和腹部超声扫描或骨扫描以诊断远处转移,之后的第2~4 年内频率可降至每半年复查1 次,第5 年可每年只复查1 次。本研究主要研究终点为OS,定义为从确诊之日起到患者因任何原因死亡或末次随访日期。次要研究终点为PFS,定义为从确诊之日起到患者发生疾病进展或因任何原因死亡或末次随访日期。随访时间自治疗开始之日起至患者死亡日期或最后一次随访日期。
1.5 统计学方法
应用SPSS 27.0 统计软件分析数据,年龄用均数±标准差表示, 采用t检验;性别、吸烟史、饮酒史、T 分期、N 分期、临床分期、铂总剂量采用卡方检验计算组间差异。采用 Kaplan-Meier 法模拟生存曲线,组间差异采用Log-rank 检验,基于双侧检验,P< 0.05 为差异具有统计学意义。
2 结 果
2.1 患者一般资料
本研究共纳入54 名符合纳入标准的患者。其中包括35 名男性和19 名女性,年龄在70~80 岁之间,中位年龄为74 岁。依据WHO NPC 病理分型,I型角化型鳞癌共7 例,Ⅱ型分化型非角化型癌共36例,III 型未分化型非角化型癌11 例;所有患者均根据 AJCC/UICC 第八版分期标准进行再分期,I 期和II 患者所占比例为0%和7.4%;大部分为局部晚期患者,III 期和IV 期患者分别达总人数的46.3%和46.3%;既往吸烟史18 例;饮酒史5 例,合并其他系统疾病患者22 例。依据患者是否联合化疗将患者分为单独IMRT 组与IMRT 联合化疗组,其中行诱导化疗的患者共23 人,行同步放化疗及辅助化疗的患者共33 人(表1)。
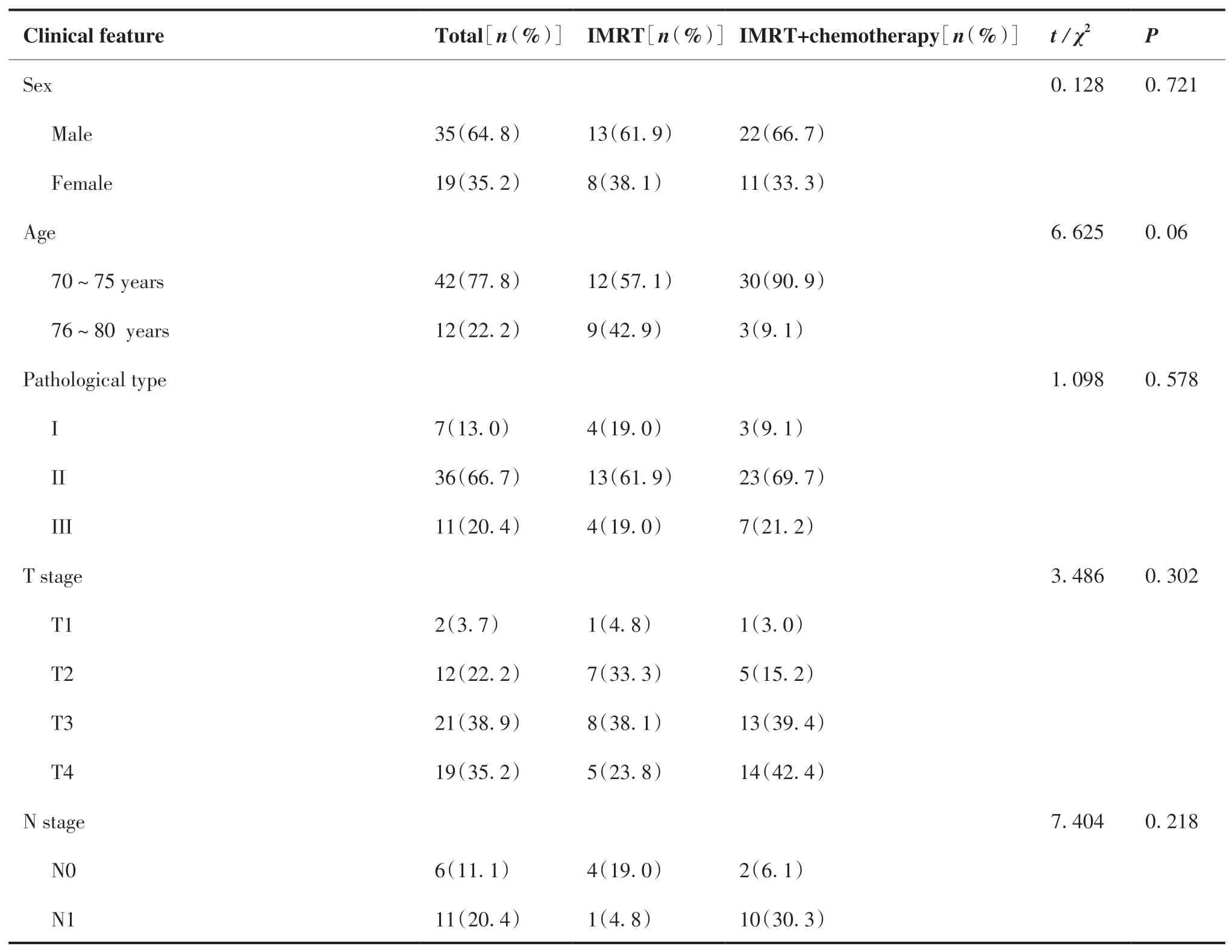
表1 患者一般资料Table 1.General Information of Patients
2.2 近期疗效
治疗结束后,所有患者总缓解率为100%,其中行单独IMRT 组和IMRT 联合化疗组的患者鼻咽部CR 分别为85.7%和90.9%,淋巴结CR 为66.7%和87.0%。IMRT 与IMRT 联合化疗相比,近期疗效呈下降趋势,但差异无统计学意义(P> 0.05;表2)。

表2 两组患者近期疗效比较Table 2.Short-Term Curative Effects in two groups in Patients with Nasopharyngeal Carcinoma
2.3 远期疗效
在所有患者后续随访中,其中死亡15 例(27.78%),局部复发4 例(7.41%),远处转移12 例(22.22%)。中位死亡时间为38 个月(8~80 个月),中位复发时间为 33. 5 个月(7~55 个月),中位远处转移时间为26 个月(3~87 个月)。最常见的转移部位为肺(7 例,58.33%),其次为肝(3 例,25.00%),骨 (2 例,16.67%),脑(1 例,8.33%),纵膈淋巴结(1例,8.33%),2 例(16.67%)转移到多个部位。
2.4 急性不良反应
两组患者中,最常出现的治疗相关毒副反应为血液毒性,其中IMRT 组与IMRT 联合化疗组相比,出现3~4 级白细胞减少的病例数分别为3 例(14.3%)和10 例(30.3%),出现中重度贫血的病例数分别为1 例(4.8%)和3 例(9.1%),出现中重度血小板减少的人数分别是0 例和6 例(18.2%),以上毒副反应人数所占比例差异均无统计学意义(均P> 0.05)。IMRT 联合化疗组与单独IMRT 组中出现重度皮肤黏膜反应的患者有13 例(39.4%)与13例(61.9%),差异无统计学意义(P> 0.05;表3)。
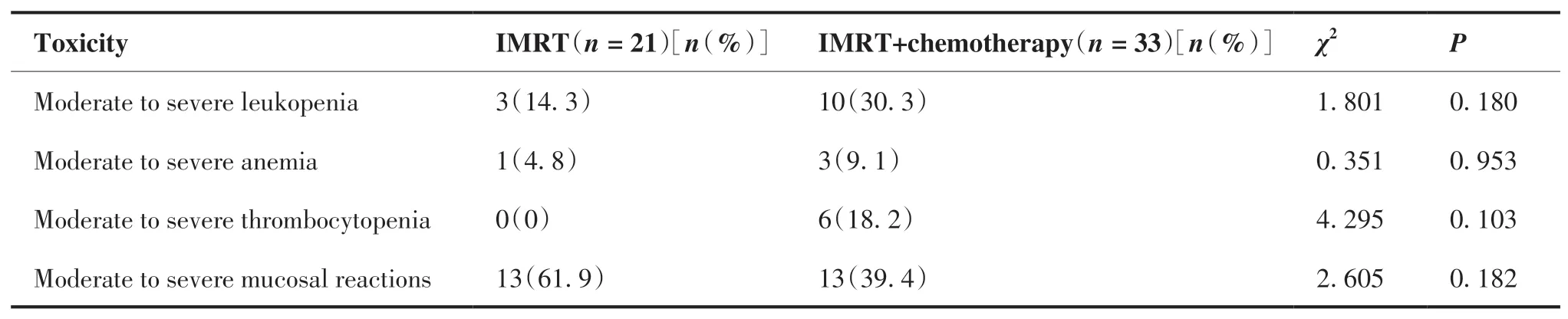
表3 两组患者急性不良反应比较Table 3.Acute Adverse Reactions
2.5 生存情况
本研究随访日期截至 2022 年11 月30 日,中位随访54 个月。IMRT 组与IMRT 联合化疗组的2 年、3 年、5 年OS 分别为85.71%、71.42%、19.04% 和93.93%、84.84%、21.21%。2 年PFS 分别为76.19%和90.90%,虽然IMRT 联合化疗组在远期疗效上OS 与PFS 较单独IMRT 组有上升趋势,但差异没有统计学意义(HR:1.645,95%CI= 0.562~4.814,P= 0.359;HR:1.459,95%CI= 0.501~4.250,P= 0.483;图1、2)。
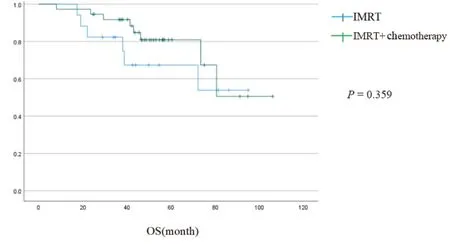
图1 IMRT/联合化疗组与单独IMRT 组OS 分析Figure 1.Overall Survival in IMRT + Chemotherapy Group and IMRT Alone Group

图2 IMRT/联合化疗组与单独IMRT 组PFS 分析Figure 2.Progression-Free Survival in IMRT + Chemotherapy Group and IMRT Alone Group
3 讨 论
临床研究通常会选择一般状况较好的参与者,70 岁及以上的患者常常由于合并症、器官功能下降等因素而被排除在临床研究之外。在一项荟萃分析中,年龄≥60 岁的人群仅占总队列的13%[15]。因此老年患者(≥70 岁)的最佳治疗方法仍不清楚。
多项研究中显示与年轻患者相比,老年患者通常不能耐受与年轻患者相同的治疗剂量而导致治疗中断[16-18]。然而,一些文献也支持老年患者可以承受与年轻人相同的治疗剂量,并取得相似的治疗效果[19]。Huang 等[20]则认为尽管年龄是NPC 癌症特异性生存率(cancer specific survival,CSS)的重要预后因素,但依然没有证据表明老年患者不能耐受根治性放疗或联合放化疗。在本研究中,所有患者均能接受完整的根治性放疗,肿瘤靶区剂量至少达68 Gy。
Cao 等[21]的一项研究中,52 名(≥65 岁)接受IMRT 和化疗的NPC 患者最常出现的不良反应为血液毒性和皮肤黏膜损伤。同时,Zeng 等[22]研究结果显示在二维放疗时代,对于≥60 岁NPC 患者来说,诱导化疗联合放疗组的不良反应发生率显著低于同步放化疗组。这些研究结果表明,同步放化疗可能会增加不良反应的发生风险。本研究中,单独IMRT与IMRT 联合化疗两组中最常出现的毒副反应也为血液毒性,其中IMRT 与IMRT 联合化疗相比,出现3~4 级白细胞减少的病例数分别为3 例(14.3%)和10 例(30.3%),急性毒副反应发生率较低,但差异无统计学意义(P> 0.05)。单独IMRT 是否联合化疗并不影响急性不良反应的出现率。
Wen 等[23]在对局部晚期NPC 的老年(≥70 岁)患者研究中发现单独IMRT 与IMRT 联合化疗治疗相比,CSS 无明显统计学差异。既往研究也表明,老年NPC 的治疗方案选择上,与IMRT 联合化疗相比,单独IMRT 并未显示出更差的生存预后[23-25]。这些发现表明,在IMRT 中加入化疗可能并不能改善局部晚期NPC 老年患者的生存结果。本研究中单独IMRT 和IMRT 联合化疗的患者鼻咽部CR 分别为85.7%和90.9%,淋巴结CR 为66.7%和87.0%,IMRT 联合化疗与单独IMRT 的近期疗效相比呈上升趋势,但差异无统计学意义;IMRT 组与IMRT 联合化疗组的2 年、3 年、5 年OS 分别为85.71%、71.42%、19.04%和93.93%、84.84%、21.21%,2 年PFS 分别为76.19%和90.90%,远期疗效上IMRT 联合化疗组OS 与PFS 较单独IMRT 组来说有上升趋势,但没有统计学意义,与上述研究吻合。这其中可能存在的原因有:(1)IMRT 能够同时兼顾靶区的适形度和平均照射剂量、有效地提高了治疗增益比,更好地防止肿瘤治疗出现局部失败,而化疗在此基础上提升的治疗效果有限;(2)老年患者由于器官功能等方面较青年患者来说有不同程度的下降,许多患者还合并其他系统疾病,导致患者对药物的耐受性及代谢下降,因此主治医师通常会依据患者身体状况适当减低化疗剂量,而化疗的有效性通常与药物总剂量密切相关;(3)患者对于化疗的敏感性也存在个体性差异,虽然目前铂类药物的耐药机制尚未明确。
Mi 等[24]认为对于老年( > 65 岁)NPC 患者来说,单独IMRT 与IMRT 联合化疗相比,可以在获得相似的生存预后的基础上,降低3 级毒性反应的发生率。尹文晶等[25]结果显示在调强模式下,化疗并不能改善≥70 岁局部晚期NPC 患者的预后(P> 0.05),且血液学毒性发生率显著高于非化疗组(P< 0.05)。本研究结果显示联合根治性IMRT 和化疗对比单独IMRT,疗效无显著差异,毒副反应也并未增加。但Jin 等[5]研究表明对于年龄≥ 70 岁的NPC 患者,IMRT 是否联合化疗都可带来长期生存,与本研究结果相符。
综上所示,本研究通过对54 例年龄≥70 岁老年非转移性NPC 患者进行预后及毒性分析,发现IMRT联合化疗与单独IMRT 相比,预后及毒性反应差异无统计学意义。因此笔者建议,对于年龄≥70 岁的非转移性NPC,临床综合评估患者肿瘤、一般状况、合并症等方面后,可适当考虑行单独IMRT,以期在不降低患者治疗效果及生存质量的基础上,提高老年患者的治疗意愿及依从性。同时,我们也期待有前瞻性多中心大样本量的临床研究能提供更多的证据。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
