基于阳性淋巴结/原发灶体积比分型的上行型和下行型鼻咽癌的外周血淋巴细胞亚群比较及预后分析*
2023-09-11何姗珊陈思皓刘刈王丹邵世龙杨牧张石川
何姗珊,陈思皓,刘刈,王丹,邵世龙,杨牧,张石川
610041 成都,四川省肿瘤临床医学研究中心,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学附属肿瘤医院 放射肿瘤学四川省重点实验室(何姗珊、刘刈、王丹、邵世龙、张石川),肿瘤基础研究中心(杨牧);646000 四川 泸州,西南医科大学 临床医学院(何姗珊、陈思皓、刘刈、王丹、张石川);610041 成都,电子科技大学 医学院(邵世龙)
尽管进入调强放疗(intensity-modulated radiotherapy, IMRT)时代后,鼻咽癌的治疗效果有了很大提高,但仍有约15%的患者在接受标准治疗后发生远处转移,10%出现局部区域复发[1-2]。如何早期识别这些患者并优化其治疗策略,是进一步提高鼻咽癌总体生存率的主要挑战。
在鼻咽癌高发区,人们很早就注意到鼻咽癌具有不同的进展模式:部分鼻咽癌原发灶较局限,但伴随广泛的颈部淋巴结转移(下行型);而另有部分鼻咽癌表现为原发灶广泛侵袭,但没有或较少淋巴结转移(上行型)[3-4](典型病例如图1 所示)。有证据表明,两者的治疗失败模式也截然不同:上行型多见局部复发,而下行型则较易发生远处转移[5-6]。因此,对这两种鼻咽癌进行比较研究,可能为研究鼻咽癌转移和复发机制提供线索。

图1 上行型和下行型鼻咽癌的典型病例Figure 1.Typical Cases of Ascending and Descending Nasopharyngeal Carcinoma
在既往的研究中,免疫系统对肿瘤进展模式的潜在影响较少受到关注。鼻咽和淋巴结均为次级淋巴器官。宿主的免疫背景和肿瘤内的免疫微环境可能是影响肿瘤进展的重要因素[7-9]。从2017 年开始,我院部分鼻咽癌患者接受了基于流式细胞仪的外周血淋巴细胞亚群定量检测。本研究拟利用这部分患者,比较上行型和下行型肿瘤外周血淋巴细胞亚群差异,探讨宿主免疫背景与肿瘤进展之间可能存在的相关性。
既往研究一般根据T、N 分期进行上行/下行的定义:T3-4N01为上行型,T1-2N2-3为下行型,T3-4N2-3为混合型[10]。在本研究中,我们尝试以阳性淋巴结体积(gross tumor volume of neck lymph nodes,GTV-N)与原发肿瘤体积(gross tumor volume of primary tumor,GTV-T)比(GTV-N to GTV-T ratio,NTR)定义上行型(低NTR)和下行型(高NTR),并验证这个新的分型方式是否较传统的TN 分型方法更准确地反映肿瘤的特点和预后。
1 资料和方法
1.1 纳入与排除标准
本研究经四川省肿瘤医院医院伦理委员会批准(审批号:SCCHEC-02-2019-10) 。病例纳入标准:(1)组织学证实为非角化性癌,EBER(EBV-encoded RNA)原位杂交阳性;(2) AJCC 第8 版分期为III 和IVa 期;(3)有治疗前头颈部增强磁共振图像;(4)治疗前接受过流式细胞术分析外周血淋巴细胞亚群;(5)已完成根治性放疗或放化疗;(6)至少随访12个月。排除标准:(1)完成治疗后6 个月内早期复发;(2)因IMRT 靶区勾画缺陷导致局部或区域复发;(3)既往有自身免疫性疾病或活动性疾病;(4)有需要使用免疫抑制剂的合并症;(5)需要药物治疗的活动性感染。
1.2 放化疗方案
入组患者均接受以IMRT 为基础的根治性放(化)疗。原发灶和转移淋巴结GTV 剂量70~72.6Gy/32~33f。预防照射CTV 剂量 50~60Gy/28~33f。治疗期间给予化疗的方式包括同步放化疗、诱导化疗联合同步放化疗、序贯放化疗等。诱导化疗的方案为含铂双药方案或三药方案,主要包括紫杉醇/吉西他滨/多西他赛+顺铂、紫杉醇+卡铂/奈达铂/洛铂、紫杉醇/多西他赛+顺铂+氟尿嘧啶。序贯化疗方案同诱导化疗。同步化疗药物多为单药顺铂或紫杉醇/多西他赛+顺铂或单药奈达铂/卡铂。
1.3 阳性淋巴结与原发肿瘤体积比的计算
采用MIM 7.0 软件在治疗前MRI 图像上勾画原发灶和颈部阳性淋巴结的GTV。所有勾画均由两名具有高级职称的头颈放疗医生讨论决定。对于咽后淋巴结与原发肿瘤发生融合的情况,另加一名影像科专家参与确定分界线,以区分属于原发灶和淋巴结的部分。NTR 的计算方法为阳性淋巴结体积除以原发肿瘤体积。
1.4 外周血淋巴细胞亚群分析
对入组患者治疗前的外周血样本进行处理,并用荧光素标记的抗体(BD Multitest 试剂盒)进行染色。采用多通道流式细胞仪(BD FACS Canto)计数CD3、CD4、CD8、CD45、CD19、CD16、CD56 染色阳性的免疫细胞百分比(%)和绝对值(cells/μL)。采用Flowjo 软件(Flowjo v10.6.1)对结果进行分析。
1.5 终点
主要终点为无局部复发生存(local recurrence-free survival,LRFS)和无远处转移生存(distant metastasisfree survival,DMFS)。复发被定义为根治性放(化)疗后临床肿瘤全部消退,治疗结束6 个月以后原发部位再次出现与原肿瘤病理类型相同的肿瘤;LRFS 为治疗开始第1 天至发现原发肿瘤复发的时间;DMFS 定义为治疗开始第1 天至检测到肿瘤转移的时间。复发应经组织学证实。诊断骨和肝转移需要至少两种不同的影像学方法的证据,并同时具有转移前和转移后的记录。诊断肺转移需要有转移前后胸部CT对比。由于复发和转移均对总生存(overall survival,OS)和疾病无进展生存(progression-free survival,PFS)产生影响,且本研究初步分析显示不同分型之间OS 及PFS 均无差异,因此本研究终点不包括OS和PFS。此外,由于仅有2 例出现颈部复发,区域无进展生存未做分析。随访方式包括门诊或住院复查以及电话随访等。
1.6 统计学方法
采用SPSS 26.0 软件进行生存分析和COX 回归模型分析。分别以复发和转移作为结局事件采用ROC 曲线选取曲线下最大面积(area under the curve,AUC)所对应的数值作为NTR 划分的临界值,以此分为上行型、下行型和混合型。并采用X-tile 分析确定各淋巴细胞亚群百分比与绝对值的最佳截断值。不同生存曲线的比较采用Log-rank 检验。使用Graph Pad Prism 9.0 版软件绘制图表。所有检验均为双尾检验,P< 0.05 差异有统计学意义。
2 结 果
2.1 患者基本特征
从2017 年11 月至2021 年11 月,共252 例初诊患者接受外周血淋巴细胞亚群分析。排除I/II 期患者40 例,IVb 期患者33 例,放弃治疗患者4 例,失访患者5 例,死于非鼻咽癌疾病患者2 例,无治疗前图像患者4 例。最终纳入164 例患者。入组患者的临床特征见表1。

表1 164 例鼻咽癌患者的一般临床特征Table 1. Clinical Characteristics of the 164 Patients with Nasopharyngeal Carcinoma
2.2 治疗结果
截至2022 年11 月,19 例(11.6%)发生远处转移,其中骨转移3 例,肝转移7 例,肺转移5 例,肺和骨同时转移1 例,肝和骨同时转移2 例,肝和肺同时转移1 例。9 例局部复发,通过随访MRI 图像与IMRT 计划的融合确定,所有复发均发生在GTV覆盖区域。2 例出现淋巴结复发。全组患者的3 年OS、DMFS、LRFS、PFS 分别为88.2%、87.5%、94.0%、77.8%。
2.3 根据阳性淋巴结/原发肿瘤体积比对患者重新分型
164 例鼻咽癌患者中,阳性淋巴结体积中位数为14.02 mL(0~212.82 mL),原发肿瘤体积中位数为18.20 mL(3.32~130.49 mL)。为了确定由NTR将鼻咽癌分为上行型、下行型和混合型的最佳截断值,我们分别以远处转移和局部复发为状态变量进行ROC 分析获取临界值(图2)。上行型、下行型和混合型肿瘤最终被定义为NTR < 0.4、NTR > 2.0 和0.4 ≤NTR ≤2.0 (图3)。采用NTR 重分型后,共67 名鼻咽癌患者(40.85%)的临床分型发生了变化:11 例(22.92%)TN 上行型肿瘤被重新分为NTR混合型,22 例(42.31%)TN 下行型肿瘤被归为NTR混合型,33 例(51.56%)TN 混合型肿瘤归为NTR上行型(22 例)和下行型(11 例),另外有1 例患者由TN 下行型归为NTR 上行型。

图2 ROC 曲线获取LRFS(A)和DMFS(B)的NTR 临界值Figure 2.ROC Curves Used to Obtain the NTR Cut-off Values for LRFS (A) and DMFS (B)

图3 164 例患者原发肿瘤体积和阳性淋巴结体积分布图Figure 3.Distribution of GTV-T and GTV-N of 164 Patients
2.4 NTR 分型较TN 分型更能预测局部复发和远处转移
在NTR 定义的上行型鼻咽癌患者中,7 例发生局部复发(占所有局部复发的77.8%),4 例发生远处转移(占所有远处转移的21.1%);而在TN 分期定义的上行型鼻咽癌患者中,相应的计数为4 例发生复发(占所有局部复发的44.4%),4 例发生转移(占远处转移的21.1%)。NTR 定义的下行型鼻咽癌患者中,远处转移10 例(占全部远处转移的52.6%),局部复发1 例(占全部局部复发的11.1%);TN 分型定义的下行型鼻咽癌患者中,远处转移9 例(占全部远处转移的47.4%),局部复发1例(占全部局部复发的11.1%)。ROC 分析显示,对于LRFS 和DMFS, NTR 分型的ROC 曲线下面积均大于TN 分型(图4)。对于非上行型(包括下行型和混合型,两组之间的LRFS 差异无统计学意义)和上行型鼻咽癌,NTR 分型的3 年LRFS 分别为97.2%和88.5%(P= 0.006),TN 分型的3 年LRFS 分别为94.8%和91.9%(P= 0.385);非下行型(包括上行型和混合型,两组之间的DMFS 差异无统计学意义)和下行型鼻咽癌的3 年DMFS 在NTR 分型中分别为91.1%和77.0%(P= 0.004),在TN 分型中分别为89.4%和83.0%(P= 0.137)(图5)。 NTR 分型法在对预测局部晚期鼻咽癌局部复发和远处转移方面优于传统的TN 分型。
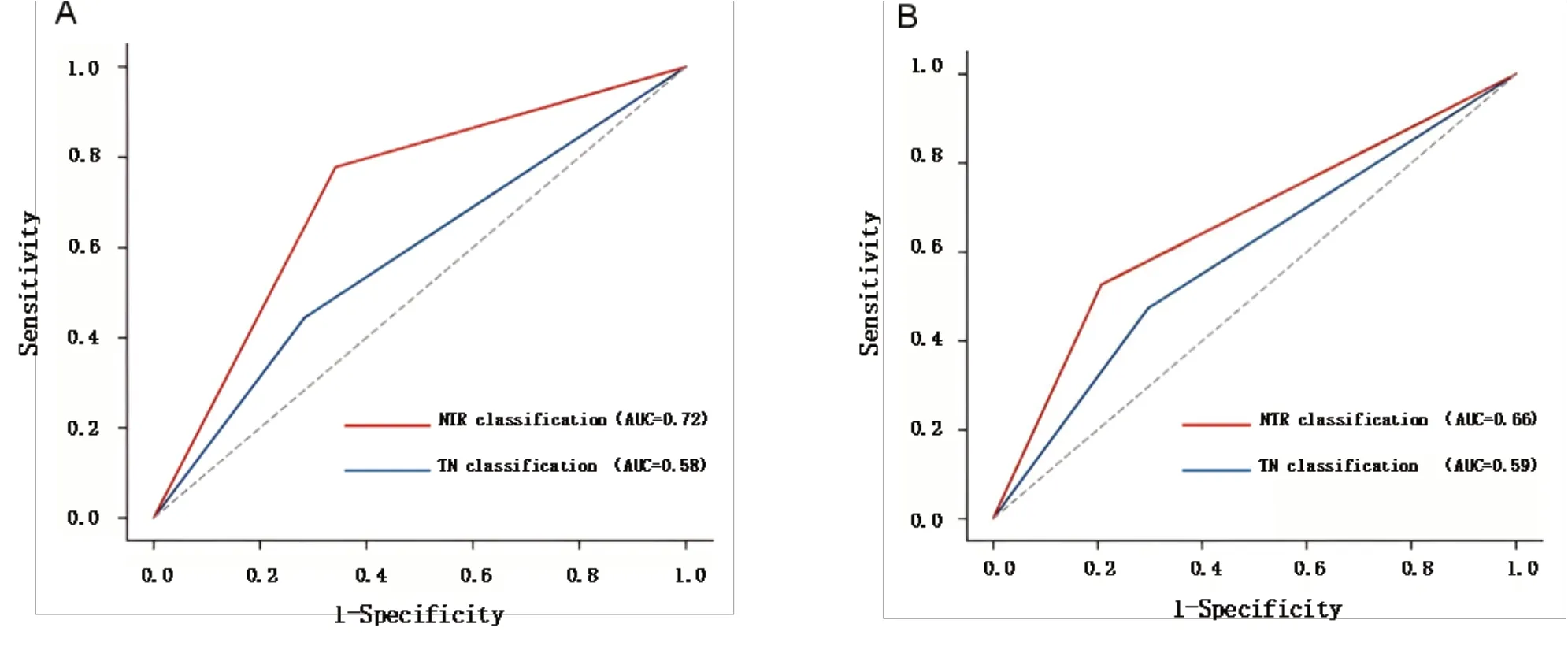
图4 NTR 分型和TN 分型预测LRFS 和DMFS 的ROC 曲线Figure 4.ROC Curves of NTR and TN Classifications for Predicting LRFS and DMFS

图5 上行型和非上行型鼻咽癌之间LRFS 的Kaplan-Meier 曲线比较,NTR 分型(A),TN 分型(B);下行型和非下行型鼻咽癌之间DMFS 的Kaplan-Meier 曲线比较,NTR 分型(C),TN 分型(D)Figure 5.Kaplan-Meier Curves of LRFS and DMFS in Different Types by NTR Classification and TN Classification
2.5 下行型鼻咽癌患者CD3+CD4+T 淋巴细胞明显升高
为了回答不同进展模式的肿瘤是否存在宿主免疫背景的差异,比较上行型、下行型和混合型鼻咽癌患者外周血中CD3+T、CD3+CD4+T、CD3+CD8+T、CD19+B和CD(16+56)+NK/T亚群的差异。我们发现,CD3+CD4+T 淋巴细胞的百分比和绝对计数在下行型鼻咽癌患者中显著升高,引起CD3+T淋巴细胞亚群的绝对值也相应升高。而其他亚群在下行型和其他分型之间差异无统计学意义,提示CD3+CD4+T 淋巴细胞亚群可能与肿瘤进展模式相关(图6)。

图6 不同NTR 分型之间各淋巴细胞亚群的差异比较Figure 6.Comparison of Lymphocyte Subsets in Three Types of Nasopharyngeal Carcinoma by NTR Classification
2.6 NTR 定义的临床分型是影响患者LRFS 和DMFS 的独立预后因素
对LRFS 和DMFS 进行COX 回归分析,进一步探讨临床分型和宿主免疫背景与治疗结果的相关性。在LRFS 的单因素分析中,NTR 分型(P= 0.006)和顺铂累积剂量(P= 0.039,非铂类化疗均按顺铂低剂量计算)与局部控制率相关,而在多因素分析中,只有NTR 分型是LRFS 的独立预后因素(HR= 6.779,95%CI1.406~32.695,P= 0.017)。在DMFS 的分析中,单因素分析显示N 分期(P= 0.006)、CD3+CD8+T 细胞百分比(P= 0.044)和NTR 定义的临床分型(P= 0.004)与远处转移显著相关,但多因素分析显示只有NTR 临床分型是DMFS 的独立预后因素(HR= 3.409, 95%CI1.384~8.396,P= 0.008;表2、3)。

表2 164 例鼻咽癌LRFS 的单因素和多因素分析Table 2.Univariate Analysis and Multivariate Analysis of LRFS of 164 NPC Patients

表3 164 例鼻咽癌DMFS 的单因素和多因素分析Table 3.Univariate Analysis and Multivariate Analysis of the DMFS of 164 NPC Patients
3 讨 论
鼻咽癌原发灶与颈部淋巴结的不平衡发展是一个值得研究的临床现象,本研究从两方面就此进行了探讨:一是针对既往定义的模糊性,提出一种新的定量方法来定义上行型/下行型鼻咽癌;二是基于患者外周血淋巴细胞亚群百分比和计数,探讨不同临床分型与宿主免疫背景的可能关系。
既往研究一般根据TN 分期定义上行型/下行型,但这种分型法某些情况并未真实反映肿瘤负荷。例如,一个T3N3 肿瘤有多个淋巴结转移,原发灶较小,但因为颅底骨结构受侵(如斜坡受侵)而分为T3,根据TN 分型应为混合型,但从原发灶和淋巴结肿瘤负荷看,分为下行型肿瘤更为合理。在本研究中,我们引入了一种新的定义方法,即阳性淋巴结与原发肿瘤体积比,并根据其对局部复发和远处转移的预测能力,提出了定义上行型/下行型鼻咽癌的临界值。生存分析结果显示,NTR 分型上行型预测局部复发的能力强于TN 分型上行型,而NTR 分型下行型预测远处转移的能力强于TN 分型下行型。
TN 分期反映了肿瘤侵袭的范围,而原发肿瘤[11]或阳性淋巴结[12]的肿瘤负荷也可能是影响鼻咽癌生存的独立预后因素。一般来说,肿瘤原发灶进展与颈部淋巴结转移呈线性相关[13],但部分肿瘤,如鼻咽癌,原发灶进展与颈部淋巴结转移呈明显的多样性。这种差异可能反映了肿瘤的生物学行为,并可能与治疗反应和结局相关。已有研究提出,原发肿瘤和淋巴结之间的代谢差异(淋巴结与原发肿瘤18F-氟脱氧葡萄糖摄取的比值)是乳腺癌[14]和肺癌[15]的预后因素。Hung 等[16]对鼻咽癌也进行了类似的研究,发现阳性淋巴结与原发灶之间相对最大标准化摄取值比值是鼻咽癌远处转移的独立预测因素(HR= 2.20,P= 0.011),这与我们的观察结果类似。与代谢成像相比,MR 图像可以获得精确的肿瘤体积,且有更好的经济性和可及性,值得今后扩大样本,进行多中心研究进一步验证NTR 分型作为鼻咽癌预后因素的有效性。
本研究同时探讨了宿主免疫背景与临床分型之间的关系,以及免疫因素对鼻咽癌预后的影响。导致肿瘤原发灶和区域淋巴结不均衡进展的因素尚不清楚,由于鼻咽属于结外淋巴组织,且鼻咽癌组织中存在大量的免疫细胞,因此免疫系统在肿瘤进展中可能起着重要作用。本研究发现,与鼻咽癌其他分型相比,NTR 下行型鼻咽癌外周血CD3+CD4+T 淋巴细胞水平显著升高,下行型鼻咽癌患者中CD3+T淋巴细胞绝对值的升高与CD3+CD4+T 淋巴细胞的升高相关。但包括CD3+CD4+T 亚群在内的免疫细胞亚群均不是影响预后的独立因素。在另一项关于鼻咽癌的独立研究中,CD3+CD4+T 淋巴细胞计数的减少被发现与较差的无远处转移生存率相关[17]。在非小细胞肺癌患者中,外周血CD3+CD4+T 细胞计数升高预示着更长的生存期[18]。因此,外周血CD3+CD4+T 淋巴细胞计数增高可能只是下行型鼻咽癌的伴随改变,而并不是其出现较多远处转移的内在因素。免疫系统如何参与鼻咽癌的发展及如何影响治疗反应还需进一步结合免疫动态变化及肿瘤内免疫微环境因素进行更深入的讨论[19-20]。
综上所述,本研究提出了一种新的鼻咽癌临床分型方法(NTR 分型)。证明了这种新的分型法在预测临床终点方面相较TN 分型法的优越性。这一新定义使我们能够更客观地分析导致肿瘤原发灶和淋巴结不平衡生长的机制,为解决肿瘤复发、淋巴结转移以及远处转移提供新的思路。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
