LncRNA OIP5-AS1 对膀胱癌细胞增殖、迁移及侵袭的影响*
2023-09-11丁上书高文胜赵华才
丁上书,高文胜,赵华才
710068 西安,陕西省人民医院 泌尿外科(丁上书、赵华才);710021 西安,西安医学院 研究生处(高文胜)
膀胱癌(bladder cancer,BCa)是泌尿系统中最常见的恶性肿瘤,可分为非肌肉浸润性BCa 和肌肉浸润性BCa,肌肉浸润性BCa 更具侵略性[1-2]。大于3 cm 的肿瘤是其复发和进展的危险因素[3]。尽管BCa 的早期检测取得了较大进展,但BCa 患者的死亡率并没有明显改变[4]。因此,有必要研究参与BCa 进展的分子机制,以寻找潜在的诊断标志物及治疗靶标。长链非编码RNAs(long non-coding RNAs,lncRNAs)是含有200 个核苷酸的功能性RNA 分子,可在不同层面发挥重要功能,包括X 染色体失活、染色质重塑和转录抑制[5-6]。OIP5-AS1 是多种癌症的癌基因,如肺癌[7]、胃癌[8]和宫颈癌[9]。在BCa 中,OIP5-AS1 可以调节细胞的增殖和凋亡,并与不良预后相关[10]。然而,对OIP5-AS1 调控机制的研究仍然有限。本课题组前期体外实验研究发现 lncRNA OIP5-AS1 可以作为预测BCa 临床疾病进展和预后不良的有效生物标志物[11]。因此,本研究拟利用BCa细胞样本,确定lncRNA OIP5-AS1 对BCa 细胞行为的影响,以期为BCa 的治疗提供治疗靶点。
1 材料与方法
1.1 主要试剂及仪器
DMEM 培养基(货号:PM150710)购自武汉Procell;胰酶(+EDTA,货号:BL512A)购自广州Biosharp;胎牛血清(货号:C04001)购自上海Vica Cell;LipofectamineTM2000(货号:11668019)购自美国Invitrogen 公司;CCK-8(货号:BS350A)购自广州Biosharp;结晶紫(货号:JC3913)购自合肥BOMEI;Matrigel(基底胶,货号:356234)、Transwell 小室(货号:3422)购自上海CORNING;PrimeScrip ™RT 试剂盒(货号RE-03014)购自上海锐博;Vimentin 兔克隆抗体(货号:A19607)、E-cadherin 兔克隆抗体(货号:A20798)、β-actin 兔克隆抗体(货号:AC026)购自武汉abclonal;生物素化山羊抗兔IgG(H+L)(货号:S0001)购自武汉affinity;倒置生物显微镜(型号DMI1)购自LEICA;酶标仪(型号spectra max PLUS 384)购自Molecular Devices;实时荧光定量(RT-PCR)仪(型号QuantStudio TM3)由美国ThermoFisher 仪器有限公司生产;电泳仪(型号JY200C)购自北京君意东方电泳设备有限公司。
1.2 细胞培养
人类正常膀胱细胞系(SV-HUC-1,货号:iCell-h208)和BCa 细胞系(EJ、T24、BIU87,货号:iCell-h208-001b)购自赛百慷(上海)生物技术股份有限公司,细胞在含有1%青霉素-链霉素溶液和10%胎牛血清的DMEM 培养基中,于37℃、5% CO2湿化培养箱中培养。
1.3 细胞转染
接种T24 细胞至6 孔板,细胞汇合度达到70%时,使用LipofectamineTM2000 分别将siRNA-NC(阴性对照)、siRNA-OIP5-AS1(敲低)、Vector(空载体)、OIP5-AS1(过表达)转染OIP5-AS1 表达最高的膀胱癌细胞,记为siRNA-NC 组、siRNA-OIP5-AS1 组、Vector 组、OIP5-AS1 组,control 组只转染LipofectamineTM2000 试剂,转染后48 h Real-time PCR 评价转染效率。序列如下:siRNA-NC:UACCGACUGGCAAU UCAUG;siRNA-OIP5-AS1:GGCAGUAGAAUCACUUAAA;OIP5-AS1 过表达质粒、空载体由上海吉玛生物科技有限公司合成。
1.4 CCK-8 检测细胞增殖
按1.3 项下分组,细胞转染48 h 后,吸弃上清,无血清培养基1∶10 稀释CCK-8 试剂,加入已稀释CCK-8 工作液10 μL/孔,并轻轻晃动培养板数次,37℃、5% CO2恒温继续培养2 h。使用酶标仪在450 nm 波长处测定各孔的吸光值,每组4 次重复。
1.5 划痕实验检测细胞迁移
记号笔在6 孔板背后,用直尺均匀的划横线,按1.3 项下分组,细胞转染48 h 后,吸除上清液,200 μL 移液枪枪头比着直尺,垂直于背后横线划痕,PBS 轻轻洗涤2 次,放入37℃ 、5% CO2培养箱培养。按0、24 h 时间点取样,50 倍镜下在各水平直线标记处跟踪拍摄各孔细胞划痕状态。划痕愈合距离△d =0h 划痕宽度- 24 h 划痕宽度。
1.6 Transwell 实验检测细胞侵袭
预铺Matrigel 胶至Transwell 上室,放置于培养箱中孵育4 h 使其干成胶状,取出孔板,在上室加入100 μL 预温的无血清培养基,室温下静置20 min,使基质胶再水化,吸去剩余培养液。在Transwell 小室中加入200 μL 的细胞悬液,放于孵箱中继续培养48 h,0.5%的结晶紫溶液染色,显微镜下观察并计数进入膜下的细胞数。
1.7 Real-time PCR 检测细胞lncRNA OIP5-AS1的表达
使用TRIzol®试剂从细胞中提取总RNA,并使用PrimeScripTMRT 试剂盒反转录,采用SYBR®Pre-Mix Ex TaqTM 分析lncRNA OIP5-AS1 的基因表达,以U6 表达水平作为内参。引物序列:LncRNA OIP5-AS1:F:TGCGAAGATGGCGGAGTAAG(5’-3’),R:TAGTTCCTCTCCTCTGGCCG(5’-3’);U6:F:CTCGCTTCGGCAGCACA(5’-3’),R:AACGCTTCACGAATTTGCGT(5’-3’)。根据RT-qPCR 反应条件反应40 个循环,记录CT 值,采用2-ΔΔCT定量lncRNA OIP5-AS1 的表达。
1.8 Western blot检测细胞Vimentin、E-Cadherin蛋白表达
细胞用预冷的PBS 缓冲液洗涤两次,后在4℃下3 000 r/min 离心5 min,用全细胞裂解缓冲液在冰上裂解30 min,然后将裂解液在4℃下3 500 r/min离心20 min,收集上清液,BCA 法检测蛋白浓度,用10% SDS-PAGE 分离蛋白质样品,并将其电泳转移到聚偏氟乙烯膜,用5%脱脂牛奶室温封闭2 h。然后将膜与下列一级抗体在4℃下孵育过夜:抗Vimentin(1∶2 000)、E-cadherin(1∶1 000)、抗β-actin(1∶10 000)。然后加入生物素化山羊抗兔IgG,室温下孵育1.5 h,洗涤,ECL 显色。采用Image Pro Plus软件分析各蛋白条带的灰度值,计算蛋白相对表达量。
1.9 统计学方法
采用SPSS 22.0 软件进行数据统计分析,数据以均数±标准差(±s)表示,两组间比较采用配对t检验分析,多组间比较采用单因素方差分析,P< 0.05 表示差异有统计学意义。
2 结 果
2.1 LncRNA OIP5-AS1 在Bca 细胞中的表达
与SV-HUC-1 细胞株相比,Bca 细胞系(EJ、T24、BIU87)lncRNA OIP5-AS1 的表达明显升高(P< 0.05),其中,T24 细胞中lncRNA OIP5-AS1 的表达较高(表1),后续实验采用T24 细胞进行。

表1 细胞LncRNA OIP5-AS1 的表达Table 1.Expression of LncRNA OIP5-AS1 in Cells
2.2 LncRNA OIP5-AS1 敲低或过表达对癌细胞生物学行为的影响
qPCR 结果显示,与control 组相比,siRNA-OIP5-AS1 组lncRNA OIP5-AS1 的表达明显降低,OIP5-AS1组lncRNA OIP5-AS1 的表达明显升高(P< 0.05;图1C)。CCK-8 检测结果显示,与control 组相比,siRNA-OIP5-AS1 组细胞增殖明显降低,OIP5-AS1 组细胞增殖明显升高(P< 0.01;图1D)。划痕实验结果表明,与control 组相比,siRNA-OIP5-AS1 组细胞迁移能力明显降低,OIP5-AS1 组细胞迁移能力明显升高(P< 0.01;图1A、E)。Transwell 小室实验结果显示,与control 组相比,siRNA-OIP5-AS1 组细胞穿膜数明显降低,OIP5-AS1 组细胞穿膜数明显升高(P< 0.01;图1B、F)。

图1 各组细胞生物学行为变化Figure 1. Changes in Biological Behaviors of Cells in Each Group
2.3 LncRNA OIP5-AS1 敲低或过表达对癌细胞上皮间质转化的影响
与control 组相比,siRNA-OIP5-AS1 组Vimentin蛋白表达明显降低,E-Cadherin 蛋白表达明显升高(P< 0.05),OIP5-AS1 组Vimentin 蛋白表达明显升高,E-Cadherin 蛋白表达明显降低(P< 0.05;图2)。
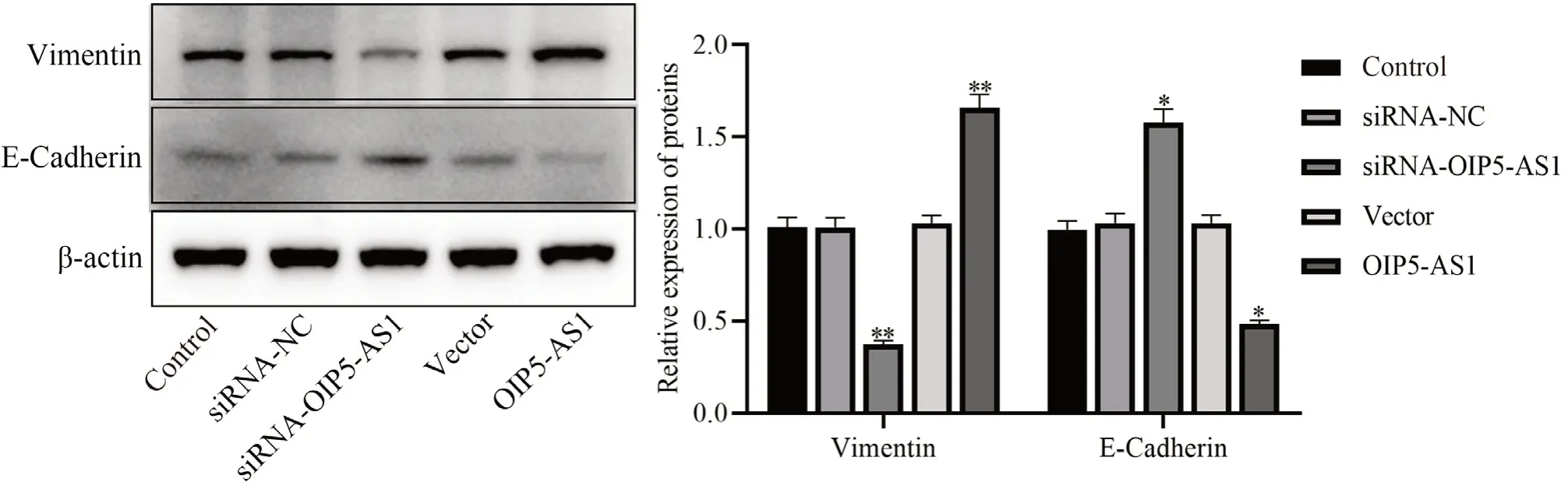
图2 各组细胞Vimentin、E-Cadherin 的蛋白表达Figure 2.Expression of Vimentin and E-Cadherin Proteins in Each Group
3 讨 论
BCa 的发病率位于全球恶性肿瘤的第9 位,同时也是发病率位居男性泌尿系肿瘤首位的肿瘤[12]。近年来,随着分子生物学技术的发展,靶向治疗已成为BCa 的重要辅助治疗手段[13]。寻找有效的BCa分子治疗靶点对改善患者的预后有重要的临床意义。研究表明,lncRNA 在肿瘤组织中有明显的异常表达,并广泛参与调节肿瘤细胞的分化、增殖、侵袭、凋亡,与临床分期和患者的预后相关[14]。与lncRNA 在BCa 诊断中的应用相比,目前对lncRNA在BCa 中的研究还不够充分,因此,需要进一步评估lncRNA 在BCa 中作用。
LncRNAs 在BCa 的发生发展中起重要作用,其影响细胞增殖、凋亡、侵袭、迁移及肿瘤抗性,这为BCa 的临床诊治和预后提供新的途径[15]。OIP5-AS1 位于15q15.1 染色体上,在多种癌症中起致癌作用[16]。如在肺腺癌中,OIP5-AS1 调节miR-448/Bcl-2 轴,促进其进展[17]。另外,OIP5-AS1 通过抑制miR-223 上调CDK14,加速骨肉瘤的发生[18]。本研究结果表明人BCa 细胞中OIP5-AS1 的表达显著上调,提示其可能影响BCa 的进展。抑制肿瘤细胞增殖是肿瘤治疗的主要方式之一,研究显示OIP5-AS1 敲除通过miR-217/MTDH 轴抑制人BCa 细胞的增殖[10]。在本研究中,OIP5-AS1 过表达促进了T24 细胞增殖,OIP5-AS1 沉默则显著抑制T24 细胞增殖,与上述研究结果一致。此外,肿瘤的发展往往伴随着肿瘤的转移,这会导致治疗失败、肿瘤复发甚至死亡[19]。OIP5-AS1 可通过调节miR-410/Wnt-7b影响胶质瘤细胞的侵袭和迁移[20]。在本研究中,过表达OIP5-AS1 促进了T24 细胞迁移和侵袭,OIP5-AS1 低表达则显著抑制T24 细胞的迁移和侵袭,表明OIP5-AS1 低表达可能发挥抑制BCa 进展的作用。
研究证实上皮源性的肿瘤细胞在发生侵袭迁移的过程中常发生上皮间质转化(epithlial-mesenchymal transition,EMT)现象,即上皮来源的肿瘤细胞通过EMT 过程丢失上皮表型,获得间质细胞的表型,在此过程中获得了高侵袭转移能力[21]。研究表明EMT在多种肿瘤(前列腺癌、结肠癌、乳腺癌和肺癌等)的恶性转化中发挥着关键作用[22]。Liang 等[23]指出lncRNA H19 通过作为竞争性的内源性RNA 来调控参与EMT 的多个基因的表达。下调OIP5-AS1 的表达能抑制卵巢癌细胞的EMT、迁移和侵袭[24]。因此,我们研究了OIP5-AS1 对BCa 细胞EMT 的影响,结果发现沉默OIP5-AS1 显著降低了EMT 标记物Vimentin、E-Cadherin 的表达,提示OIP5-AS1 低表达可能通过BCa 细胞EMT 特征发挥抑癌功能。
综上所述,lncRNA OIP5-AS1 在BCa 细胞系中高表达,沉默OIP5-AS1 可抑制BCa 细胞增殖、迁移和侵袭,并抑制细胞EMT 能力。LncRNA OIP5-AS1有望成为一种BCa 治疗靶点。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
