桦褐孔菌醇提取物抗胃癌作用机制研究*
2023-09-11乔羽郭亚迪周忠光刘旭董霏雪
乔羽,郭亚迪,周忠光,刘旭,董霏雪
150040 哈尔滨,黑龙江中医药大学 基础医学院(乔羽、郭亚迪、周忠光),实验实训中心(刘旭);
150040 哈尔滨,黑龙江中医药大学附属第一医院 眼科(董霏雪)
胃癌是临床常见的恶性消化道肿瘤,据2020年数据显示,我国胃癌新发病例占全球总数量的43.9%,中国已然成为全球胃癌高发地之一[1]。如何攻克此类恶疾,是当今医学界亟待解决的重要课题。真菌入药在我国历史悠久,药用真菌的抗肿瘤活性也日益受到临床医者青睐。桦褐孔菌作为一种珍贵的药用真菌,现有研究已证实其抗肿瘤潜力巨大,对多种癌细胞均有较强的细胞毒性,可诱导癌细胞凋亡,但其抑癌作用机制尚待进一步揭示[2]。本研究通过建立胃癌荷瘤裸鼠模型,从细胞凋亡及氧化应激的角度探讨桦褐孔菌醇提取物的抑瘤作用机制,以期为探寻胃癌的临床治疗新路径提供一定的理论依据。
1 材料与方法
1.1 动物与试剂
49 只裸鼠(由黑龙江中医药大学实验动物中心提供),雄性,实验动物质量合格证号:SCXK(京)
2016-0006。
桦褐孔菌提取物:按照醇提法常规操作,取桦褐孔菌1kg,加70%乙醇10 L,加盖常温浸泡24 小时,100℃加热回流1 小时提取得到滤液1,残渣再加70%乙醇,加热回流1 小时提取得到滤液2,合并滤液1 与滤液2,水浴箱蒸干,成干膏,打粉。人胃癌细胞株BGC-823(中科院上海细胞所)、卡培他滨片(江苏恒瑞医药股份有限公司)、GSH-PX 检测试剂盒、SOD 检测试剂盒及MDA 检测试剂盒购自上海素尔生物科技有限公司、Caspase-9 抗体、P53 抗体、Bcl-2 抗体和Bax 抗体购自爱必信(上海)生物科技有限公司。
1.2 分组及制备模型
49 只裸鼠随机分为空白组(正常裸鼠)、模型组(植瘤鼠)、阴性对照组(只灌胃溶剂)、西药组(只灌卡培他滨)、桦褐孔菌醇提取液高剂量组、中剂量组和低剂量组,共计7 组,每组7 只。
除空白组外,在每只裸鼠腋下皮肤接种0.2 mL BGC-823 细胞 (2×107个/mL),每天观察肿瘤形成情况,第7 日开始可于皮下触及粟粒样肿瘤,所有裸鼠模型均制备成功。
1.3 给药及取材
空白组和模型组不给药。西药组每只裸鼠灌胃给药卡培他滨片0.5 mg/g,按照桦褐孔菌临床给药量和桦褐孔菌醇提取物的浓度,经人与小鼠换算公式确定[3],高剂量组灌胃给药1.56 mg/g,中剂量组灌胃给药0.78 mg/g,低剂量组灌胃给药0.39 mg/g,试剂体积0.1 mL/10g,阴性对照组灌胃给药0.3 %羧甲基纤维素钠0.4 mL/10g。植瘤后第7 日于皮下可触及粟粒样肿瘤时开始给药,每天一次,连续21 天。
实验第22 天,裸鼠摘眼球取血,3 000 rpm 离心10 min,取血清-20℃冻存。处死裸鼠,称重,摘取瘤块,用生理盐水洗涤,然后用滤纸吸干称重。部分瘤体多聚甲醛溶液固定。
1.4 观察指标
1.4.1 抑瘤率 肉眼观察并测量瘤体大小,称重,根据公式计算抑瘤率:抑瘤率=(对照组平均瘤质量-给药组平均瘤质量)/对照组平均瘤质量×100%。
1.4.2 HE 染色观察肿瘤细胞形态 取裸鼠瘤块组织,用10%甲醛固定 1 周,通过常规脱水、石蜡包埋、切片(厚度 4 μm)、HE 染色,对裸鼠瘤块组织进行病理学观察。
1.4.3 免疫组化法检测蛋白表达 将肿瘤组织切片,65℃烘干2 h,脱蜡、水化,滴加H2O2,抗原修复,滴加山羊血清封闭10 min,滴加一抗[Caspase-9 抗体(1∶200)、P53 抗体(1∶100)、Bcl-2 抗体(1∶100)、Bax抗体(1∶100)],装入湿盒,冰箱4℃过夜,次日37℃复温,滴加二抗,37℃孵育15 min,加DAB试剂显色,PBS 冲洗、苏木素复染,镜下观察Caspase-9、P53、Bcl-2 及Bax 的表达情况。
1.4.4 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法检测蛋白含量 将血清按照ELISA 试剂盒说明书进行操作,采用酶标仪在450 nm 处测定各孔的光密度(optical density,OD)值。以所测标准品的OD 值为横坐标,标准品的浓度值为纵坐标,绘制标准曲线,并得到直线回归方程,将样品的OD 值代入方程,计算出样品的浓度。
1.5 统计学方法
采用SPSS 26.0 软件进行统计学处理,多组间连续变量采用单因素方差分析 ,数据均以±s表示,以P< 0. 05 为差异有统计学意义。
2 结 果
2.1 桦褐孔菌醇提取物对荷瘤裸鼠肿瘤的抑制作用
通过肉眼观察,模型组和阴性对照组瘤体最大,10 mm 左右,西药组和高剂量组瘤体最小,约5~7 mm(图1)。

图1 各组瘤体照片Figure 1.Tumors in Different Groups
各组瘤重呈正态性分布,应用方差分析六组之间瘤重,差异有统计学意义(F= 14.308,P< 0.01)。应用最小显著差异法进行两两比较(表1),与模型组瘤重相比,阴性对照组和低剂量组的瘤重差异均无统计学意义(P> 0.05),西药组、高剂量组和中剂量组的瘤重差异有统计学意义(P< 0.05)。高剂量组的抑瘤率最高,其次是西药组、中剂量组、阴性对照组和低剂量组。
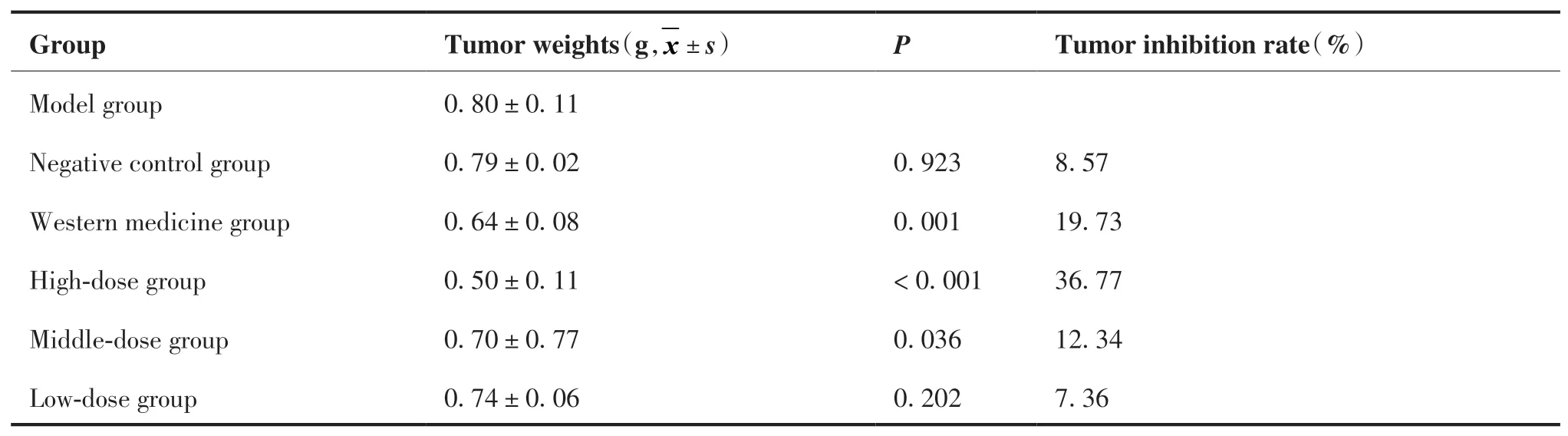
表1 桦褐孔菌醇提取物抗BGC-823 荷瘤裸鼠的抑瘤率(N = 7)Table 1.Inhibitory Rate of Ethanol Extract of Inonotus obliquus on BGC-823 Tumor-Bearing Nude Mice(N = 7)
2.2 各组肿瘤组织HE 染色结果
HE 染色结果(图2)可见:模型组肿瘤细胞形态正常,体积较小,呈圆形或梭形,胞浆稀少,核形态规则,浓染,未见细胞变性、坏死;阴性对照组肿瘤细胞形态正常,未见细胞变性、坏死;西药组肿瘤组织大面积细胞凝固坏死,部分肿瘤细胞水肿明显,有新生血管生成,可见炎症细胞浸润;高剂量组大量细胞水肿坏死,细胞核破碎消失,肿瘤间质血管丰富,坏死细胞周围可见炎细胞浸润;中剂量组细胞坏死区域明显,大量间质血管分布,坏死区有炎症浸润;低剂量组部分区域细胞出现水肿坏死,有炎症浸润。

图2 光学显微镜下各组肿瘤组织病理结构变化(HE 染色,×400)Figure 2.Pathological Changes in Tumors in Different Groups under Optical Microscope (HE Staining, ×400)
2.3 桦褐孔菌醇提取物对肿瘤相关因子的影响
免疫组化图片可见,Caspase-9 和P53 在西药组和高、中、低剂量组蛋白染色为棕黄色,细胞质和细胞核着色深、表达多,但中、低剂量组蛋白表达有减弱趋势,模型组和阴性对照组着色浅,弱阳性或阴性表达(图3、4);Bax 在西药组和高、中、低剂量组蛋白染色为棕黄色,细胞质和细胞核着色深、表达多,模型组和阴性对照组着色浅,弱阳性表达(图5);高、中、低剂量组和西药组Bcl-2 蛋白表达弱阳性,模型组和阴性对照组蛋白染色深、表达多(图6)。

图3 免疫组化染色示桦褐孔菌醇提取物对Caspase-9 的作用(间接标记法,×400)Figure 3.Immunohistochemical Staining Showing the Effect of Ethanol Extract of Inonotus obliquus on Caspase-9(Indirect Labeling Method, ×400)

图4 免疫组化染色示桦褐孔菌醇提取物对P53 的作用(间接标记法,×400)Figure 4.Immunohistochemical Staining Showing the Effect of Ethanol Extract of Inonotus obliquus on P53 (Indirect Labeling Method, ×400)

图5 免疫组化染色示桦褐孔菌醇提取物对Bax 的作用(间接标记法,×400)Figure 5.Immunohistochemical Staining Showing the Effect of Ethanol Extract of Inonotus obliquus on BAX (Indirect Labeling Method, ×400)

图6 免疫组化染色示桦褐孔菌醇提取物对Bcl-2 的作用(间接标记法,×400)Figure 6.Immunohistochemical Staining Showing the Effect of Ethanol Extract of Inonotus obliquus on Bcl-2 (Indirect Labeling Method, ×400)
从图7 可知,Caspase-9、Bax 和P53 在西药组和高、中、低剂量组蛋白表达上调,与模型组比较差异具有统计学意义(P< 0.05),而在高、中、低剂量组中,三种蛋白表达逐渐减弱;高、中、低剂量组和西药组Bcl-2 表达下调,与模型组比较差异具有统计学意义(P< 0.05),高、中、低剂量组中Bcl-2 蛋白表达呈递增趋势。

图7 免疫组织化学法测桦褐孔菌醇提取物对四种蛋白的细胞平均光密度值Figure 7.Average Optical Density of the Ethanol Extract of Inonotus obliquus on Four Proteins Measured by Immunohistochemistry
2.4 桦褐孔菌醇提取物对荷瘤裸鼠氧化相关细胞因子的影响
与空白组比较,模型组和阴性对照组血清中MDA 含量明显升高;与模型组比较,西药组和桦褐孔菌醇提取物各组MDA 表达下降。与空白组比较,模型组和阴性对照组血清中SOD、GSH-PX 含量显著下降;与模型组比较,西药组和桦褐孔菌醇提取物各组SOD、GSH-PX 含量均增加,但低剂量组SOD 含量增加的差异无统计学意义(表2)。

表2 桦褐孔菌醇提取物对BGC-823 荷瘤裸鼠氧化相关细胞因子的影响(X ±S,N = 6)Table 2.Effects of Inonotus obliquus on Oxidation-Related Cytokines in BGC-823 Tumor-Bearing Nude Mice(X ±S,N = 6)
3 讨 论
桦褐孔菌为多孔菌科褐色卧孔菌属,是一种多寄生于寒冷地区白桦树上的药食两用型真菌[4]。自16 世纪,东欧部分国家就将其视为民间珍药,至今仍广泛应用于胃癌、肠癌、心脏病、糖尿病等疾病的治疗[5],在俄罗斯更是有“西伯利亚灵芝”的美誉。现有研究发现桦褐孔菌醇提取物可抑制胃癌BGC-823、MGC-803 细胞的增殖及荷瘤裸鼠肿瘤的生长速度[6]。此外,桦褐孔菌乙酸乙酯部位的化学成分对人胃癌 SGC-7901 细胞也有较好的抑制作用[7]。本研究以此为基础建立BGC-823 胃癌荷瘤裸鼠模型,探究桦褐孔菌醇提取物的抑瘤作用机制。
HE 染色法是病理学中组织切片最常用的染色方法,可以显示对比正常与病变组织结构形态异同。通过计算抑瘤率可以从数值上更直观反映药物的抑瘤效果。本研究结果显示,桦褐孔菌醇提取物能有效破坏肿瘤细胞形态,促使其变性、坏死,且抑瘤率随其剂量的上升同步增大,进一步证实了桦褐孔菌醇提取物的抗胃癌作用。
细胞凋亡对癌症的发生起负调控作用,是目前公认的肿瘤抑制机制之一,受Bcl-2 家族、半胱氨酸蛋白酶(Caspase)家族、P53 等多种蛋白的调控[8]。Bcl-2 家族是内源性的线粒体凋亡途径的关键调控因子,Bcl-2 和Bax 分别为典型的抗凋亡与促凋亡成员,可通过调节线粒体功能以调控细胞凋亡[9]。Bax加速细胞凋亡[10],而Bcl-2 作用相反,可抑制细胞凋亡[11]。此外,二者任意一方的高表达均可抑制对方基因表达从而影响细胞凋亡[12]。Bax/Bcl-2 比率变化影响线粒体膜的通透性,释放凋亡效应因子,进而激活Caspase-9。Caspase-9 在内源性凋亡途径中起关键作用,位于Caspase 瀑布式活化及家族级酶联反应顶端,是凋亡蛋白家族主要成员[13]。活化的Caspase-9 随即激活下游Caspase,从而加快细胞凋亡进程[14]。P53基因是一种典型抑癌基因,与线粒体凋亡直接相关,DNA 损伤或致癌因素刺激会激活P53,从而诱导肿瘤细胞生长停滞或诱导细胞凋亡[15]。Bax 和Bcl-2 同为P53 的重要转录靶点,P53表达上调可引起Bax 表达上调和Bcl-2 表达下调,继而促使Caspase-9 表达,诱导肿瘤细胞凋亡[16]。本研究结果显示,桦褐孔菌醇提取物高、中、低剂量组干预调控的BGC-823 胃癌细胞P53、Bax、Caspase-9表达均明显上调,Bcl-2 表达下调,Bax/Bcl-2 比率增大,提示桦褐孔菌醇提取物可能通过改变线粒体膜通透性,活化凋亡蛋白诱导胃癌细胞凋亡从而发挥抗肿瘤作用。
有研究证实肿瘤的发生发展与宿主自由基水平关系密切[17]。因此,采用能适当清除自由基的药物或调节自由基机制来预防及治疗胃癌具有广阔的探究空间。SOD 作为一种过氧化物分解酶,是抗氧化的关键防御物质,机体内自由基清除速率与该酶活性呈正相关性,随其升高而加快[18]。GSH-PX 是广泛存在的内源性抗氧化酶,对维持细胞膜结构与功能的完整性具有重要意义,是衡量机体抗氧化能力指标之一[19]。MDA 是脂质过氧化的最终分解产物,其水平升高标志细胞氧化损伤程度加重[20]。在机体稳态下,SOD、GSH-PX 等抗氧化物酶共同参与机体的氧自由基酶防御体系构建,维持机体氧化与抗氧化动态平衡[21]。当平衡被打破,抗氧化防御体系出现异常时,MDA 等脂质过氧化产物将迅速生成并大量累积,造成细胞氧化损伤,进而推动肿瘤发生与发展进程[22]。因此桦褐孔菌醇提取物的抗氧化应激作用可以通过检测SOD、GSH-PX 和MDA 的含量来间接反映。本研究结果显示,经桦褐孔菌醇提取物干预后,胃癌裸鼠模型中SOD、GSH-PX表达上调,MDA 表达下调,表明桦褐孔菌醇提取物可能通过提高胃癌裸鼠抗氧化酶活性、抑制脂质过氧化反应及清除自由基等方式抵抗胃癌裸鼠体内氧化应激,进而发挥抗肿瘤作用。
综上所述,桦褐孔菌醇提取物对胃癌模型有明显的抑制作用,其发挥抗胃癌作用的机制可能与调控细胞凋亡蛋白表达及抗氧化应激相关。该研究为桦褐孔菌醇提取物未来有望成为临床治疗胃癌新药提供了一定的理论支持,但其作用机制还需深入发掘,多角度,深层次进一步开展相关实验,以期为开展临床应用提供更多证据支持。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
