镇江香醋醋酸发酵阶段细菌的垂直分布与富集培养
2023-09-10崔运来李玉龙罗少波宁雪悦田佳蓓
崔运来,张 徽,李玉龙,罗少波,宁雪悦,田佳蓓,韩 冬
(江苏科技大学粮食学院,江苏镇江 212100)
镇江香醋作为中国四大名醋之一,具有“酸而不涩,香而微甜、色浓味解”特色[1],富含氨基酸、多种有机酸[2],含有四甲基吡嗪等功能成分[3],受到了大众的喜爱。镇江香醋是以糯米、麸皮和大糠为主要原料,经过糖化、酒精发酵、固态分层的醋酸发酵、封醅、加炒米色淋醋等特殊工艺制作,经陶坛密封陈酿而成的食醋[4]。醋酸发酵阶段以酒精度约为7%的酒醪、麸皮和大糠为原料[5],选用发酵第7 d 醋醅进行接种[6],发酵周期约21 d。每天翻醅,发酵前7 d,每日翻醅深度为7~10 cm,使接种于表层的种醅逐层扩培,发酵7 d 后,每天翻醅到缸底,俗称“露底”,此时醋醅中的微生物组成与接种的种醅高度相似[7]。翻醅工序是将各种微生物充分混匀,以控制发酵醅温和混入氧气[8],有利于的好氧微生物生长和乙醇氧化生产乙酸[9]。当卤水酸度不再升高,代表醋酸发酵阶段结束,用食盐和塑料薄膜将醋醅封实,隔绝空气,防止部分醋酸菌进一步将醋酸过氧化,影响得率,同时封醅有利于食醋风味品质的提高[10]。
镇江香醋的酿造方式是开放型混合多菌种分层发酵,由于复杂多样的微生物群落,在不同微环境的发酵作用,使酿制的香醋风味独特[11]。近年来高通量测序技术作为良好的微生物群落研究手段,受到广泛应用[12-13]。许多研究者以高通量测序技术对不同食醋发酵过程中的微生物群落的结构以及演变规律进行研究,揭示了不同微生物类群与食醋风味之间的关系。在对镇江香醋的研究中,Wang 等[14]通过扩增子测序研究了镇江香醋中与风味相关的核心微生物,Wu 等[15]通过宏基因测序建立了镇江香醋微生物物种相关的风味代谢网络,并通过功能微生物的原位强化用于提高乙偶姻含量,Huang 等[16]通过扩增子测序探究了发酵剂和环境变量对镇江香醋发酵微生物和香醋风味的影响,并指出细菌是醋醅的优势微生物。我国其他特色酿造食醋的微生物区系也有报道,如山西老陈醋、四川麸醋、凉州熏醋、浙江玫瑰醋等[17-22]。但是以制醋缸中醋醅的垂直结构分类的微生物的分布还未见报道。在固态醋酸发酵中,由于醋醅原料属于非均相状态,不仅随发酵时间微生物存在群落演替,在空间上也存在微生物分布差异,现有研究鲜有从空间分布角度对发酵微生物分布的揭示。
本研究以传统手工工艺制作镇江香醋为研究对象,通过高通量测序,揭示醋醅垂直结构细菌群落区系组成,并比较了菌株富集和分离有效培养基。本研究可为固态食醋醋酸发酵中的垂直结构的细菌分布和变化提供理论支撑,从而完善不同空间分布的微生物的发酵机理,进而有利于发酵过程的精准控制,指导翻醅工艺。同时为分离醋醅中特定种属微生物,提供采样来源和培养基的选择参考。
1 材料与方法
1.1 材料与仪器
醋醅样品 以传统工艺发酵镇江香醋;土壤DNA 提取试剂盒 广州美基生物科技有限公司;PCR 扩增引物 上海生工生物工程技术服务有限公司;培养基所用试剂 国药集团。
H3-18KR 台式高速冷冻离心机 湖南可成仪器设备有限公司;DW-HL340 超低温冰箱 中科美菱低温科技股份有限公司;BJ-1CD 净化工作台 上海博讯医疗生物仪器股份有限公司;sQ810C 立式压力蒸汽灭菌器 雅马拓科技贸易有限公司;THZ-98A恒温振荡器 上海一恒科学仪器有限公司;T100 PCR 仪 美国伯乐。
1.2 实验方法
1.2.1 样品采集 在发酵缸(总容积为350 kg)五点取样法(即四个顶点以及中心位置)自上而下取出距顶部10 cm,30 cm 以及发酵缸底部10 cm 的醋醅并分层充分混匀,然后通过四分法舍去多余的醋醅,在3 个平行的发酵缸中分别取发酵第7 d 醋醅样品,等质量混合,分别记为BC、ZC 和DC;种醅(ZP)则为发酵第7 d 时,醋醅自上而下的混合醋醅。
1.2.2 样品中基因组DNA 提取 使用土壤DNA 提取试剂盒,取0.5 g 混合均匀的醋醅样本在2.0 mL厚壁离心管中,加入0.1~0.6 mm 的玻璃微珠和裂解液进行匀浆裂解。90 ℃水浴进一步裂解10 min,裂解后的样本通过高速离心去除固体杂质。最后利用醇沉法以及硅胶柱纯化技术对澄清的裂解液进行过柱、洗涤等操作,最后用无菌水洗脱从而获取高产量高纯度的总DNA。
1.2.3 PCR 扩增及纯化 扩增细菌的16S rDNA 的V3~V4 可变区,总扩增体系为25 μL,以提取的醋醅中总DNA 为模板(1 μL),使用TransStart Fastpfu DNA 聚合酶(0.5 μL),引物341F(CCTAYGGGRB GCASCAG)和806R(GGACTACHVGGGTWTCT AAT)(各1 μL),2.5 mmol/L dNTPs 2 μL,5X Trans-Start Fastpfu Buffer 5 μL。PCR 条件,95 ℃ 2 min,变性95 ℃ 20 s,退火55 ℃ 30 s,延伸72 ℃ 30 s,最终延伸72 ℃ 5 min,保持30 个循环。PCR 扩增产物使用1%琼脂糖凝胶电泳检测,合格样品使用磁珠纯化。
1.2.4 Illumina HiSeq 平台测序 构建测序文库主要用的试剂盒是Illumina 公司的TruSeq Nano DNA LT Library Prep Kit。在上机测序前用Agilent High Sensitivity DNA Kit 对文库进行质量检验,使用Illumina NovaSeq 6000 测序仪上进行双端测序,由上海融享生物科技有限公司完成。
1.2.5 样品富集培养 分别称取5 g 种醅样品,无菌接种于装有100 mL 寡营养液体培养基(蛋白胨 0.5 g,酸水解酪蛋白0.5 g,酵母浸粉0.5 g,可溶性淀粉0.5 g,葡萄糖0.5 g,丙酮酸钠0.3 g,乙酸钠0.2 g,磷酸氢二钾2 g,硫酸镁0.2 g,硫酸锰0.05 g,调节pH至7.0)和富营养液体培养基(MRS 培养基pH7.0)的三角瓶中,振荡混匀,置于恒温箱内30 ℃静置培养48 h。培养混合物经离心(4 ℃,10000 r/min,10 min),沉淀物用于基因组提取和高通量测序。种醅样品记为ZP,经寡营养培养基富集物记为GY,经富营养培养基富集物记为FY。
1.3 数据处理
二代数据处理流程:首先使用Trimmomatic(version 0.33)质量过滤原始数据,用Cutadapt(version 1.9.1)进行引物序列的识别与去除,其后使用FLASH(version 1.2.11)对双端reads 进行拼接并去除嵌合体(UCHIME,version 8.1),最终得到高质量的序列用于后续分析。
测序序列利用HiSeq 平台对16S 的V3~V4 区域测序并按照中间overlap 方式进行拼接,使用USEARCH(version 10.0)序列分析软件把序列的以97%的相似性进行OTU 注释,与参考数据库比对,将测序序列数的0.005%作为过滤OTUs 的阈值。使用QIIME 软件进行Alpha 指数、Beta 多样性分析[23]。使用R 语言和Graphpad 7 软件做进一步的可视化展示。
2 结果与分析
2.1 镇江香醋不同深度发酵醋醅细菌多样性
2.1.1 OTU 分布 通过高通量测序分析手工发酵镇江香醋不同发酵深度细菌多样性,测序共获得185413 条有效读长序列,共计118 个OTU,其中样品BC 的OTU 数目为66 个,样品DC 的OTU 数目为111 个,样品ZC 的OTU 数目为76 个。各OTU在样品中分布见图1,BC 与DC 共有62 个OTU,BC 与ZC 共有59 个OTU,ZC 与DC 共有71 个OTU,三者共有OTU 数目为57 个,占总OTU 个数的48.31%。而不同深度的醋醅中各含有特有OTU,数目分别为,BC 2 个,ZC3 个,DC 含有最多的特有OTU 数量为35 个。这表明不同深度醋醅中细菌的物种组成部分相似性,但不同深度微环境中含有特有的一些细菌类群,底层醋醅微生物种类最高。
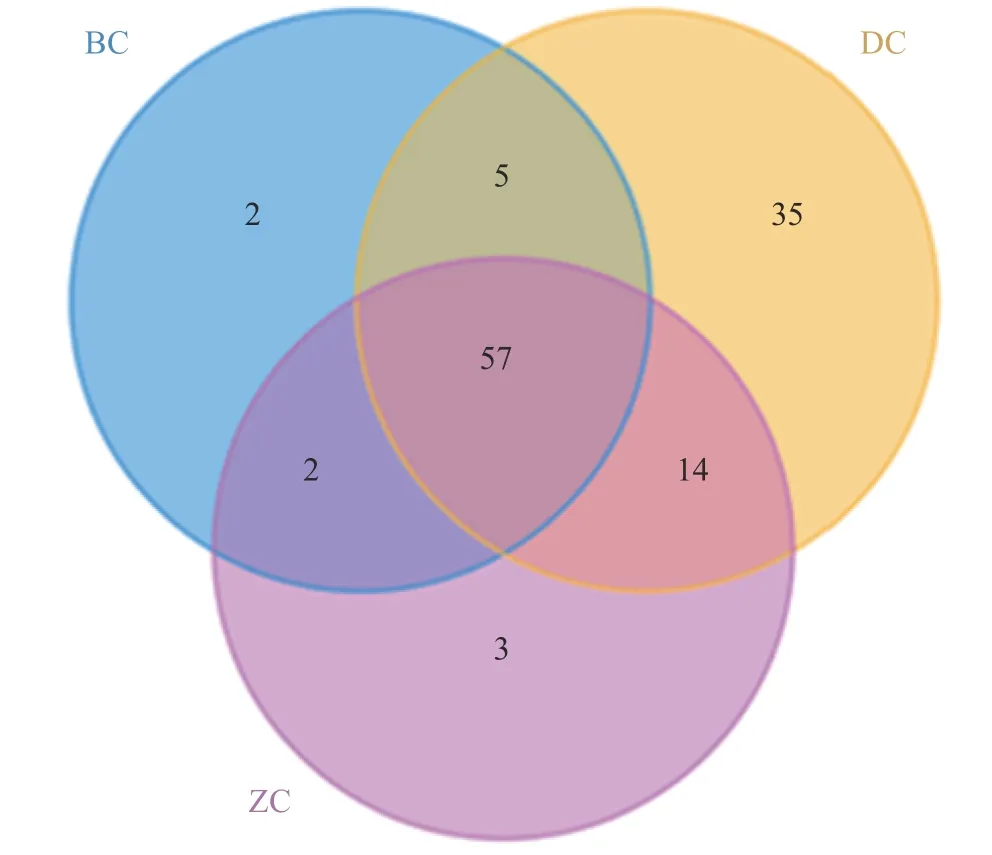
图1 不同深度发酵醋醅样品细菌的OTU 分布图Fig.1 OTU distribution of bacteria in Cupei fermented at different depths
将测序序列经物种注释后,各样品的不同分类学水平下物种数量见表1。从门、纲、目、科、属级分类水平上都是随着醋醅自上而下深度的增加物种数量越多。

表1 不同深度醋醅中各分类水平下物种统计结果Table 1 Distribution of bacteria in Cupei fermented at different depths by different taxonomic level
镇江香醋醋醅中细菌在门水平上主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteriota)、疣微杆菌门(Verrucomicrobiota)、浮霉菌门(Planctomycetota)、异常球菌门(Deinococcota)、弯曲杆菌门(Campilobacterota)组成,其中变形菌门(Proteobacteria)在样品BC 中含量最高,平均相对丰度百分比为79.80%;样品ZC 和DC 中厚壁菌门(Firmicutes)为优势菌门,丰度分别为64.42%和50.17%。
镇江香醋醋醅中细菌在属水平分布如图2 所示,醋醅中主要包含乳杆菌属(Lactobacillus)、醋酸杆菌属(Acetobacter)、土壤杆菌属(Agrobacterium)、黄单胞菌属(Xanthomonas)、鞘氨醇单胞菌属(Sphingomonas)、泛生菌属(Pantoea)、短杆菌属(Curtobacterium)、甲基杆菌属(Methylobacterium)、假单孢菌属(Pseudomonas)、新鞘脂菌属(Novosphingobium)的细菌。黄婷[7]在对镇江香醋(恒顺制醋车间2018~2019)发酵阶段细菌的扩增子测序发现平均丰度超过10%为醋酸乳杆菌属(Acetilactobacillus)、醋酸杆菌属(Acetobacter)、不动杆菌属(Acinetobacter)、气单胞菌属(Aeromonas)、乳酸杆菌属(Lactobacillus)和假单胞菌属(Pseudomonas)[7];王宗敏[24]在对镇江香醋(恒顺制醋车间2014)发酵阶段细菌的扩增子测序发现151 个OTU 参与发酵过程,乳杆菌属(Lactobacillus)和醋酸杆菌属(Acetobacter)占绝对优势,乳球菌属(Lactococcus)、葡糖醋杆菌属(Gluconacetobacter)、肠球菌属(Enterococcus)、黄单胞菌属(Xanthomonas)和芽孢杆菌属(Bacillus)也存在于发酵过程。本研究中镇江香醋的细菌类群与制醋工厂生产发酵的主要细菌类群相似,也与其他固态发酵的食醋,如赤水晒醋[25]、山西老陈醋[26]、岐山醋[27]等主要细菌类群相似。
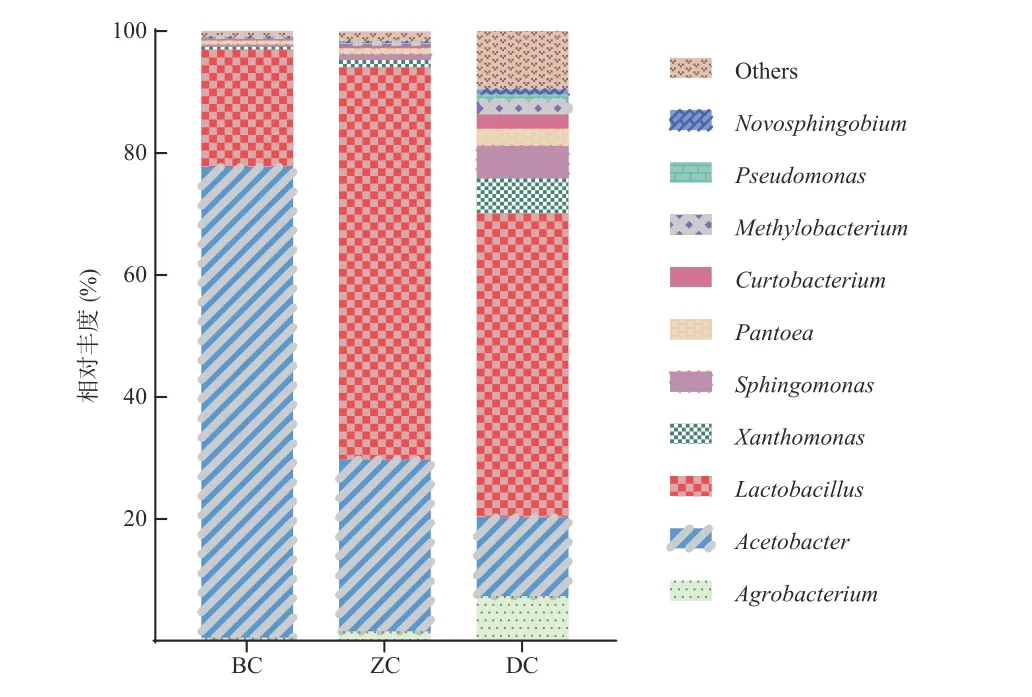
图2 不同深度醋醅中细菌属水平TOP10 群落结构分布Fig.2 Distribution of TOP10 bacterial at different depths in Cupei at genus level
BC 中醋酸杆菌属(Acetobacter)相对丰度最高(77.22%),乳杆菌属(Lactobacillus)丰度仅次于醋酸杆菌属(Acetobacter)的含量,占19.24%。ZC 中乳杆菌属(Lactobacillus)的相对丰度最高(64.31%),醋酸杆菌属(Acetobacter)的丰度仅次于乳杆菌属(Lactobacillus)的含量,占28.18%。DC 中乳杆菌属(Lactobacillus)的相对丰度较高(49.80%),其次是醋酸杆菌属(Acetobacter)12.95%,土壤杆菌属(Agrobacterium)7.31%,黄单胞菌属(Xanthomonas)5.79%、鞘氨醇单胞菌属(Sphingomonas)5.34%。醋醅发酵表层中的优势菌是醋酸杆菌属(Acetobacter),随着醋醅深度加深,醋酸杆菌属(Acetobacter)丰度呈降低的趋势。由于醋酸杆菌属(Acetobacter)是一类好氧微生物[28],并且发酵工艺是从表层开始接种,发酵深度越深相对溶氧量越低,醋杆菌丰度也就越低。而乳杆菌属(Lactobacillus)在中层丰度最高其次是底层,表层含量最低。引起乳杆菌分布不同的原因可能是由于乳杆菌属(Lactobacillus)是一类兼性厌氧菌,并且整个醋缸中中层醅温度高于底层醅温,中层醋醅环境最适宜乳杆菌生长,其次是底层环境。乳酸菌发酵产乳酸可以改善醋最终的口感风味,使镇江香醋的酸味柔和,乳酸菌还可以促进糖、蛋白质和脂肪的分解和代谢、合成乙偶姻等[29]。已有研究对镇江香醋醋酸发酵阶段中微生物变化和风味的相关性分析发现,少数物种是食醋发酵的核心功能微生物(醋酸杆菌属、乳杆菌属、水栖菌属、乳球菌属、葡糖醋杆菌属、芽孢杆菌属和葡萄球菌属)[14],特别是醋酸菌和乳酸菌它们的物种组成和比例含量是影响发酵过程的关键[15,30]。结合本研究醋酸菌和乳酸菌的相互作用不仅体现在随时间的演替,在空间分布上也存在一定的规律。
2.1.2 不同深度醋醅中细菌群落的多样性指数 各样品Alpha 多样性指数值统计如下表2 所示。Chao1、Ace、Shannon、Simpson、PD whole tree 多样性指数均呈现相同的趋势,即DC 高于ZC 高于BC,说明随着醋醅的深度的加深细菌的多样性越高,固态酿造食醋底层细菌种类最丰富。

表2 不同深度醋醅中细菌群落Alpha 多样性指数Table 2 Alpha diversity index of bacteria at differentdepths of Cupei
Beta 多样性使用样本相关性热图来呈现样品间细菌群落分布的相似性(图3),BC 与DC 之间细菌群落差异较大,BC 与ZC 之间细菌群落差异较小。
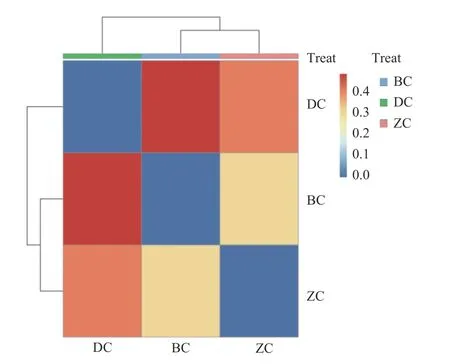
图3 不同深度醋醅中细菌分布相关性热图Fig.3 Heat map of bacterial distribution at different depths of Cupei
2.1.3 相关性与关联分析 根据各个物种在各个实验样品中的丰度以及相互关系,基于python 在属水平分析物种相关性进而绘制物种相关性网络图(图4),可体现随空间变化的微生物物种间的相关性。选取属水平相关性最高的前37 个属,进行斯皮尔曼(Spearman)秩相关分析并筛选相关性大于0.1且P值小于0.05 的数据构建相关性网络。
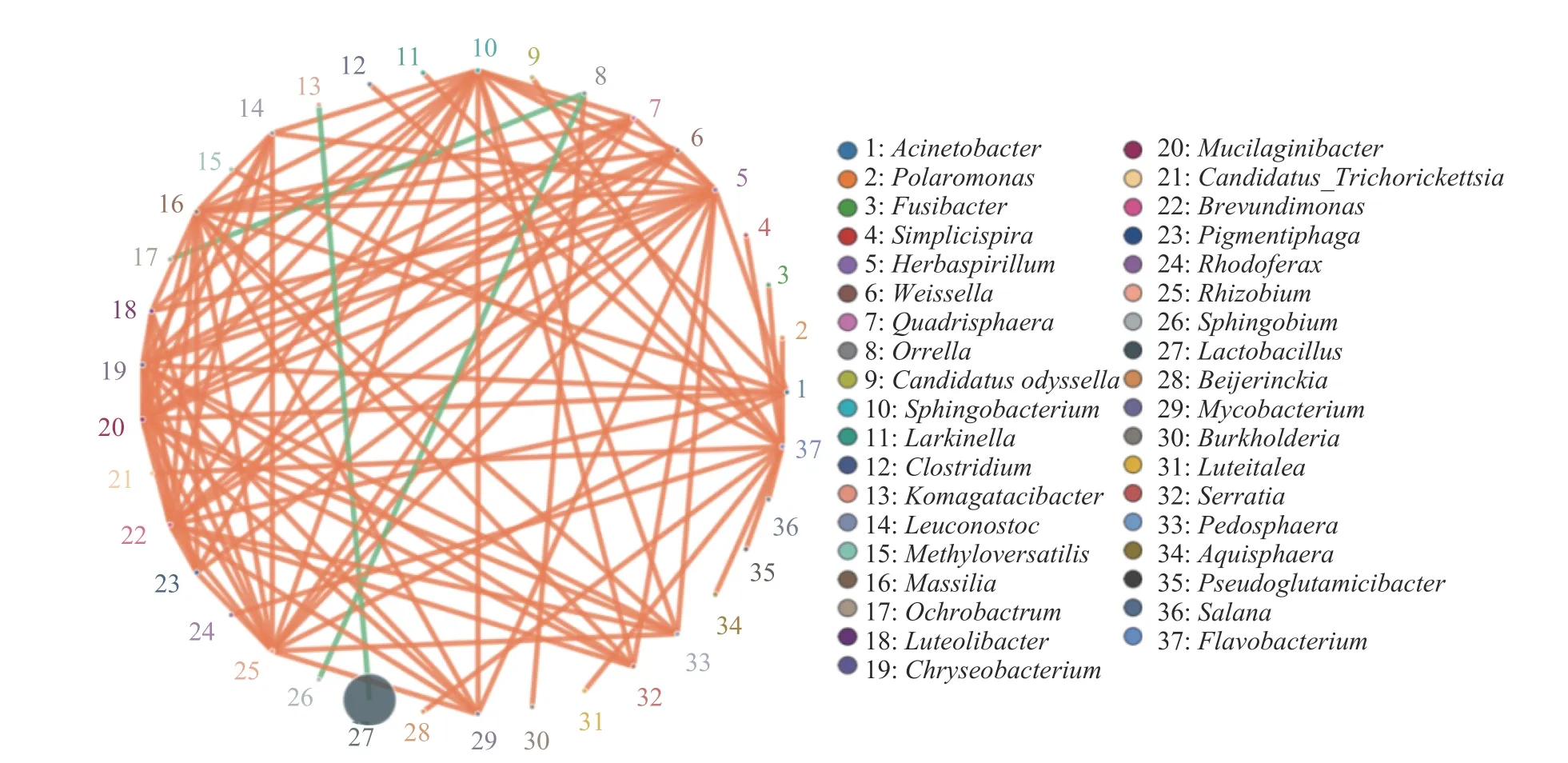
图4 属水平物种相关性网络图Fig.4 Species correlation network at genus level
大多数物种间呈现正相关,其中水球菌属(Aquisphaera),奥雷拉属(Orrella),土圈菌属(Pedosphaera)等优势细菌属物种和其他细菌属相连的节点数目在1~3 之间;草螺菌属(Herbaspirillum),鞘氨醇杆菌属(Sphingobacterium),马赛菌属(Massilia),金黄杆菌属(Chryseobacterium)等优势细菌属物种和其他细菌属相连的节点数目超过5 个,节点连通性很高,和其他物种间联系紧密,这些物种在醋醅中有利于多种微生物的共存。乳酸杆菌属(Lactobacillus)与驹形氏杆菌属(Komagataeibacter)呈负相关,奥雷拉属(Orrella)与苍白杆菌属(Ochrobactrum)和鞘氨醇杆菌属(Sphingobacterium)呈负相关,他们之间可能存在竞争或拮抗作用。
2.2 富营养和寡营养培养基对醋醅中可培养微生物富集率的影响
2.2.1 不同培养基富集后OTU 变化 ZP、FY、GY样品测序共获得203572 对Reads,经质控和拼接后共产生201738 条Clean Reads,单个样品不少于47429条Clean Reads。高通量测序共获得146个OTU,其中种醅(ZP)中含有135 个OTU,富营养培养基(FY)有26 个OTU,寡营养培养基(GY)有37 个OTU。3 个样品中OTU 分布Venn 见图5,可见本研究所用的富集培养基只能培养出醋醅中部分细菌,富营养培养基可培养出23 种,寡营养培养基可培养出32 种。有少数富集培养后的OTU 未在种醅中检测出,可能是由于微生物在样品中分布不均匀导致。寡营养培养方式可富集到17 种富营养培养方式下富集不到的微生物菌群。
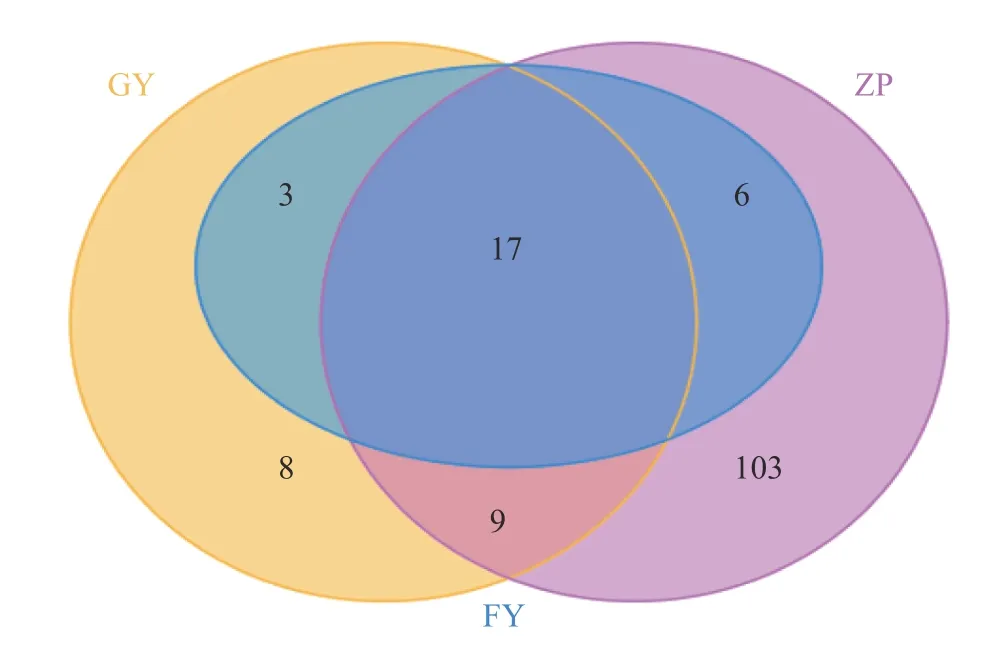
图5 富集培养后OTU 分布Venn 图Fig.5 Venn diagram of OTU distribution after enrichment culture
本研究所测序的种醅样品,即发酵第7 d 的醋醅(上一批次),在本批次醋酸发酵中作为发酵剂。高通量测序显示(图6),种醅(ZP)中优势属为未有效注释到已报道的物种的未知分类类群(Unassigned)平均相对丰度为85.49%,醋酸杆菌属(Acetobacter)平均相对丰度为0.91%;乳酸杆菌属(Lactobacillus)平均相对丰度为0.72%;农杆菌属(Agrobacterium)平均相对丰度为2.10%,鞘氨醇单胞菌属(Sphingomonas)平均相对丰度为2.00%,泛海属(Pantoea)平均相对丰度为1.80%,黄单胞菌属(Xanthomonas)平均相对丰度为1.20%,甲基杆菌属(Methylobacterium)平均相对丰度为1.00%,短小杆菌属(Curtobacterium)平均相对丰度为0.77%,新鞘层属(Novosphingobium)平均相对丰度为0.68%、铜绿假单胞菌(Pseudomonas)平均相对丰度为0.62%,其他属(Others)平均相对丰度为2.72%。
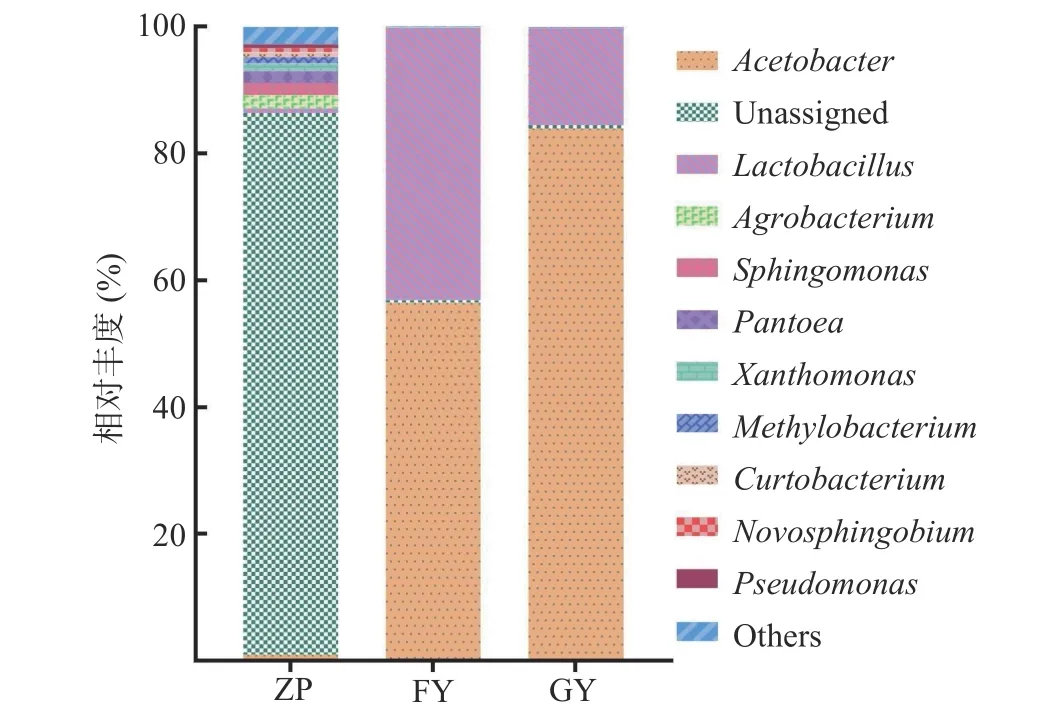
图6 富集培养后属水平TOP10 物种分布图Fig.6 Distribution of TOP10 genera after enrichment culture
富营养培养基富集后扩增子测序显示相对丰度>1%的细菌菌群仅归属到2 个属,其中包括醋酸菌属(Acetobacter)和乳酸菌属(Lactobacillus)。其中,醋酸菌属(Acetobacter)是此种富集培养条件下得到的相对丰度最高的类群,平均相对丰度为56.45%,乳酸菌属(Lactobacillus)平均相对丰度为43.02%。寡营养培养基对镇江香醋醋醅中的菌群进行富集,高通量测序显示相对丰度>1%的细菌菌群同样归属到2 个属,醋酸菌属(Acetobacter83.96%)和乳酸菌属(Lactobacillus15.21%)。因此降低碳源和氮源的寡营养条件有利于镇江香醋醋醅中醋杆菌属的富集,富营养培养基有益于醋醅中乳酸菌的富集。
2.2.2 不同培养基对醋醅中细菌培养效果 以每个OTU 单元为横坐标,以序列相对含量的对数值为纵坐标绘制散点图(图7),以比对寡营养培养基和富营养培养基对醋醅中细菌的培养效果。相对含量的对数值大于0,表示培养基对该类群有富集效果,相对含量的对数值小于0,表示培养基有一定培养作用但不能富集。富营养培养基对醋醅中细菌的富集作用主要体现在对厚壁菌门细菌的富集,他还可以富集变形菌门中的醋杆菌和一个未知类群细菌。寡营养培养基可以富集1 种拟杆菌门细菌,6 种厚壁菌门细菌,5 种变形菌门细菌和4 种未分类的类群,对厚壁菌门部分细菌富集作用最强。寡营养的培养基能够富集的OTU 高于富营养培养基,且具有新类群微生物的培养潜力。

图7 不同培养基对醋醅中细菌丰度的影响Fig.7 Effect of different media on the abundance of bacteria in Cupei
3 结论
本研究采用高通量测序技术,揭示了发酵第7 d镇江香醋醋醅不同发酵深度的细菌群落的多样性。共获得了192680 条有效序列,样品中鉴定出118个OTU。随着发酵深度的增加,细菌物种数量和多样性升高。表层醋醅细菌的优势类群为醋酸杆菌(Acetobacter),且随着醋醅深度增加的醋酸杆菌(Acetobacter)相对含量依次减少,中层和底层醋醅细菌的优势类群为乳杆菌属(Lactobacillus),醋酸杆菌(Acetobacter)和乳杆菌属(Lactobacillus)作为食醋发酵核心微生物,它们主要在醋醅中不同的垂直环境发挥作用。为探究不同营养成分对醋醅中细菌的富集作用,本研究使用富营养和寡营养培养基对种醅微生物进行富集,并通过高通量测序了解细菌群落组成。3 个样品共获得203572 条有效序列,归属于146 个OTU。两种培养基都可以对醋杆菌和乳杆菌有效富集,但寡营养培养基对比富营养培养基可培养的菌群更多样,特别是对潜在的未分类新类群的培养。本研究可进一步加深对镇江香醋醋酸发酵阶段微生物空间分布的了解,同时可为醋醅中特定微生物的分离,特别是从培养基营养成分选择和采样位置选择提供参考,但是如何结合时间和空间多维度对发酵机理的解析还需要深入的研究。
