γ-聚谷氨酸对棉花生长与根际微生物的影响
2023-09-09陶龙锦张经博董正武马晓东涂永峰赵冬梅刘隋赟昊
陶龙锦,张经博,董正武,马晓东,涂永峰,赵冬梅,刘隋赟昊*
(1.新疆师范大学 生命科学学院,新疆 乌鲁木齐 830054;2.新疆特殊环境物种保护与调控生物实验室,新疆 乌鲁木齐 830054;3.新疆特殊环境物种多样性应用与于调控重点实验室,新疆 乌鲁木齐 830054;4.新疆慧尔农业集团股份有限公司,新疆 昌吉 831100)
棉花作为新疆农业经济中的重要产业,对新疆农业经济发展有着十分重要的意义[1]。近年来,南北疆超高产棉田出现肥料过量施用和环境污染现象,制约我国农业的可持续发展。因此,提高肥料利用率、降低环境污染已成为当前热点问题。为此,急需开发新型环境友好型肥料,改善土壤和调整施肥习惯。
缓控释肥能有效提高肥料利用率,减少环境污染,并已应用于棉花研究[2]。γ-聚谷氨酸(γ-PGA)是一种可降解的绿色生物大分子材料,由L-谷氨酸和D-谷氨酸酰胺键结合而成,来源于微生物发酵,拥有巨大的开发潜力。它有良好的吸附、保水能力和生物相容性,可在生物体内降解,广泛用于农业、医药、环保、食品等多个领域,如生物絮凝剂、肥料增效剂、药物载体和食品添加剂[3]。有研究发现,在草莓上施用2 次100 mg·L-1的γ-PGA 水溶肥,其产量比对照提高29.6%;在蜜柑叶片上喷施5 次浓度为200 mg·L-1的γ-PGA 水溶肥,其单果鲜质量比对照提高17.4%[4-5];采用γ-PGA作增肥剂的茄子,氮磷钾肥表观利用率较常规肥分别提高了17.13%~22.77%、13.25%~18.28%和1.94%~12.95%[6];油菜、小青菜、番茄、玉米、小麦等作物施用γ-PGA都能增产节肥[7]。在作物生长期中,γ-PGA 的喷施会显著增加植株株高、质量和产量等,同时也会对土壤微生物产生影响[8]。
土壤微生物在生态系统物质循环与能量流动中扮演着重要角色,调控着养分在土壤-植物-大气连续体(SPAC)之间的循环,是联系植物和土壤的重要因素[9]。由于土壤微生物对环境变化的敏感性,土壤微生物的群落结构、组成和多样性可作为评价土壤质量和肥力的重要指标[10-11]。有研究表明,γ-PGA 可显著促进根区微生物群落的生长[12];在西瓜苗播种前向基质中添加γ-PGA 可以显著提高育苗基质微生物活性[13];此外一些γ-PGA 发酵液及其浓缩后的γ-PGA 颗粒肥产品还可以增加土壤微生物种群的数量、多样性以及均匀度[14]。总之γ-PGA 能够改善土壤结构、增强持水能力、减少养分流失、促进根区微生物群生长,这为γ-PGA 调控作物生长奠定基础。目前γ-PGA 应用于棉花增产及提高肥料利用率报道较多,但对棉花根际微生物影响鲜有报道。
本研究采用盆栽试验,研究了γ-PGA 对棉花植株形态和根际微生物群落的影响,旨在阐明其作为肥料增效剂的机理,为合理施用提供数据支持。
1 材料与方法
1.1 试验场地概况
试验场地位于新疆维吾尔自治区乌鲁木齐市沙依巴克区的新疆师范大学昆仑校区(北纬43°50′,东经87°35′)的自然光温室,温室内平均气温在30 ℃左右,昼夜温差10 ℃左右,相对湿度40%左右,二氧化碳浓度532.10 mg·m-3左右,光照充足。试验于2022 年5月10日开始进行。
1.2 试验材料
棉花种子选用石河子农业科学研究院选育的新陆早80 号,生育期117 d 左右,吐絮率95.6% 以上,化肥选用氨磷钾复合肥(NPK 为15-15-15,速效成分45%),γ-PGA 选用慧尔聚谷氨酸水溶肥(γ-PGA 含量≥5%),供试土壤为壤土,中等肥力,土壤有机质7.5 g·kg-1,铵态氮41.2 mg·kg-1,速效磷18.5 mg·kg-1,速效钾115 mg·kg-1,pH=7.5。
1.3 试验方法
1.3.1 试验设计
采用盆栽法进行试验。选取60 个内径为18.5 cm,高为7.5 cm 的花盆,每盆装入土壤1400 g。试验共设置3 个处理,分别为未施肥处理(CK),稀释150 倍γ-PGA 配施化肥处理(P)以及单施化肥处理(N),每个处理15 次重复。于2022 年5 月10 日开始育苗,2022 年6 月10 日定植,各施肥处理具体见表1。

表1 施肥处理Table 1 Fertilization treatment
1.3.2 棉花农艺性状与植物叶片酶活性的测定
于2022 年8 月5 日,每组随机选取5 株,将植株连根拔起后,冲洗表层土壤,用卷尺测定植株高度,用游标卡尺测量植株地径,记录棉花主茎叶数和果台数,使用电子台秤对地上与地下部分干物质量分别称重。
选取-80 ℃保存的棉花倒三叶测定酶活性。生化指标的评估使用索莱宝试剂盒(北京索莱宝科技有限公司,北京,中国)。估算过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性,0.1 g 样品中加入相应的提取液1 mL,冰浴匀浆,收集上清加入相应的工作液,CAT、SOD 的吸光度值分别在240、560 nm 处用分光光度计(Unico Instrument Co.,Ltd,上海,中国)测定吸光度,根据相应公式计算,并用U·g-1表示。测定丙二醛(MDA)含量,取0.1 g样品加入提取液冰浴匀浆,收集上清加入相应的工作液,在450、532 和600 nm 处测定吸光度,根据相应公式计算,以nmol·g-1表达。测定脯氨酸(Pro)含量,0.1 g 样品加入提取液冰浴匀浆,收集上清加入相应的工作液,在520 nm 处测定吸光度,根据标准曲线和相应公式计Pro 含量,以μg·mL-1表达。每个指标测试重复3次。
1.3.3 土壤样品的采集与测定
于2022 年8 月1 日在每个处理随机选取3 株植株,以棉花的根为中心,半径5 cm,深度10 cm,小心地挖取土样,将采集的土样混匀,剔除落杂物,铺成四方形,划对角线将土样分成4 份,把对角的2 份分别合并装入离心管中作为1 个重复,另一部分回填,每个处理各3 个重复,记为P1、N1和CK1。离心管带回置于-80 ℃保存,用于根际微生物DNA 提取。9月5 日将棉花植株采收后重复上述操作,样品记为P2、N2和CK2。
土壤理化性质测定参考《土壤农化分析》[15]进行。其中土壤pH 采用pH 计测定;土壤总有机质含量采用重铬酸钾-外加热法测定;土壤全氮含量采用凯氏定氮法通过CHN 元素分析仪测定;土壤全磷含量采用钼锑抗比色法通过紫外可见分光光度计测定;土壤全钾含量通过火焰光度计法测定;土壤速效磷采用0.5 mol·L-1碳酸氢钠浸提-钼锑比色法测定;土壤速效钾采用1 mol·L-1醋酸铵浸提-火焰原子光度计法测定;土壤铵态氮采用2 mol·L-1氯化钾浸提-全自动流动注释分析仪检测。
1.3.4 土壤微生物种类多样性测定
使用Power Soil DNA Isolation Kit 强力DNA 提取试剂盒(PowerMag ™Soil DNA isolation Kit, MO BIO)进行微生物总DNA 的提取。细菌16S rRNA(V3+V4)区域引物:正向引物5′-ACTCCTACGGGAGGCAGCA-3′;反向引物5′-GGACTACHVGGGTWTCTAAT-3′[16]。 真菌ITS1 区域引物:正向引物5′-CTTGGTCATTTAGAGGAAGTAA-3′;反向引物5′-GCTGCGTTCTTCATCGATGC-3′[17]。本研究中所有样品的测序和生物信息服务均在北京百迈客生物科技有限公司Illumina NovaSeq 测序平台完成。微生物多样性是基于 Illumina NovaSeq 测序平台,利用双末端测序(Paired-End)的方法, 构建小片段文库进行测序。通过对 Reads 拼接过滤,聚类或去噪,并进行物种注释及丰度分析,揭示样品的物种构成; 进一步进行α 多样性分析(Alpha Diversity)、β多样性分析(Beta Diversity)、显著物种差异分析、相关性分析、功能预测分析等,挖掘样品之间的差异。
1.4 数据分析方法
用Microsoft Excel 2016 软件对数据进行整理,采用SPSS20.0(SPSS Inc. USA)软件One-way ANOVA 中的最小显著性差异(LSD)法对棉花株高、茎粗、主茎叶数、果台数、地上与地下干物质量进行显著性差异分析。使用R 4.0.2 对数据进行分析及作图,用ggalluvial 软件包绘制细菌群落丰度图,借助Mothur (v 1.30)进行主成分分析(Principal Component Analysis, PCA),使用BugBase(https://bugbase.cs.umn.edu/index.html)软件对微生物组进行表型预测。
2 结果分析
2.1 聚谷氨酸配施对棉花叶片酶活性的影响
不同施肥处理的叶片酶活性如图1 所示,相较蒸馏水对照,配施γ-PGA 可显著提高SOD 和CAT活性,分别增幅60.25%、57.64%,单施化肥则增加SOD、降低CAT 活性。与蒸馏水对照相比,单施化肥显著提高MDA 和Pro 含量,分别增幅16.90%、401.45%,配施γ-PGA 增幅程度次之,分别为5.90%、208.76%。

图1 棉花叶片酶活性Fig. 1 The activities of enzymes in cotton leaves
2.2 聚谷氨酸配施对棉花植株生长的影响
与对照相比,γ-PGA 显著促进了棉花的生长(表2)。γ-PGA 配施化肥处理的棉花株高、茎粗、主茎叶数、果枝数是蒸馏水对照的1.15、1.29、1.52、4.01 倍。单施化肥处理的棉花仅果枝数有显著增加。与对照相比,γ-PGA 显著促进了棉花的干物质积累。γ-PGA 配施化肥处理的棉花地上干物质量比对照组高7.14 g,地下干物质量高2.83 g。单施化肥处理与对照组对比仅地下干物质量显著增加2.22 g。
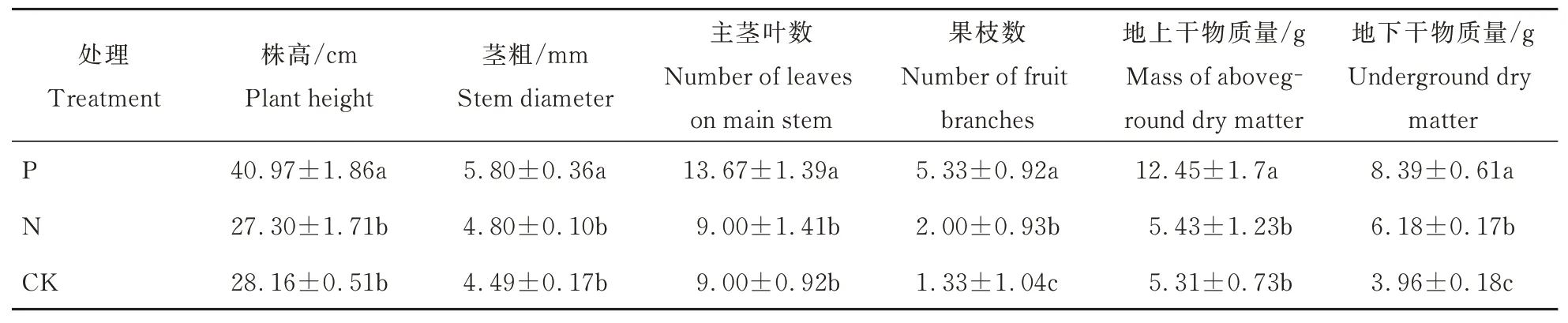
表2 聚谷氨酸配施对棉花植株生长的影响Table 2 Effects of polyglutamic acid combined application on cotton plant growth
2.3 聚谷氨酸配施对土壤养分含量的影响
由表3 可见,不同的施肥处理对土壤pH 影响不大。采前各处理有机质含量无显著差异,采后各处理有机质含量均有所下降且无显著差异。采前配施γ-PGA 显著提高土壤全磷、速效磷和速效钾含量,单施化肥则显著提高速效磷和速效钾含量,其余均低于蒸馏水处理。采后各处理的全磷含量无显著差异,配施γ-PGA 显著提高土让铵态氮和速效钾含量,单施化肥则显著提高速效磷和速效钾含量,其余均低于蒸馏水处理。

表3 土壤理化性质的变化Table 3 Changes in soil physical and chemical properties
2.4 聚谷氨酸配施对棉花植株根际微生物的影响
2.4.1 土壤微生物OTUs数量及微生物群落多样性
Chao1 和ACE 指数表示微生物的丰度,数值越大说明群落丰富度越高。Shannon 和Simpson 指数表示微生物的多样性,数值越大说明群落多样性越高。表4 显示:(1)细菌丰度和多样性在采前和采后蒸馏水处理中均最高,配施γ-PGA 次之且变化不显著;而单施化肥的处理则在采前时最低,但在采后时却有了大幅上升,基本上与蒸馏水对照组无明显差别。(2)真菌丰度在采前和采后配施γ-PGA 中均最高且无显著变化,蒸馏水处理次之且大幅下降,单施化肥最低无显著变化,采前单施化肥真菌多样性最高,配施γ-PGA 次之,蒸馏水处理最低,采后各处理无明显差异。
2.4.2 土壤微生物在门水平上的相对丰富度
不同配施处理下的棉花根际细菌优势群落门水平分布如图2A 所示,相对丰度前5 的细菌优势门为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)、放线菌门(Actinobacteriota)、芽单胞菌门(Gemmatimonadota)和拟杆菌门(Bacteroidota)。采前与采后对比,配施γ-PGA:变形菌门相对丰度降低13.49%,酸杆菌门增加4.02%,放线菌门增加12.37%,芽单胞菌门增加30.08%,拟杆菌门降低6.92%。单施化肥:变形菌门降低35.68%,酸杆菌门增加108.35%,放线菌门增加3.98%,芽单胞菌门增加65.28%,拟杆菌门降低6.70%。蒸馏水处理:变形菌门降低23.4%,酸杆菌门增加49.4%,放线菌门增加30.8%,芽单胞菌门增加99.4%,拟杆菌门降低25.7%。配施γ-PGA 各菌门变化趋势与其它处理相同但幅度较小。
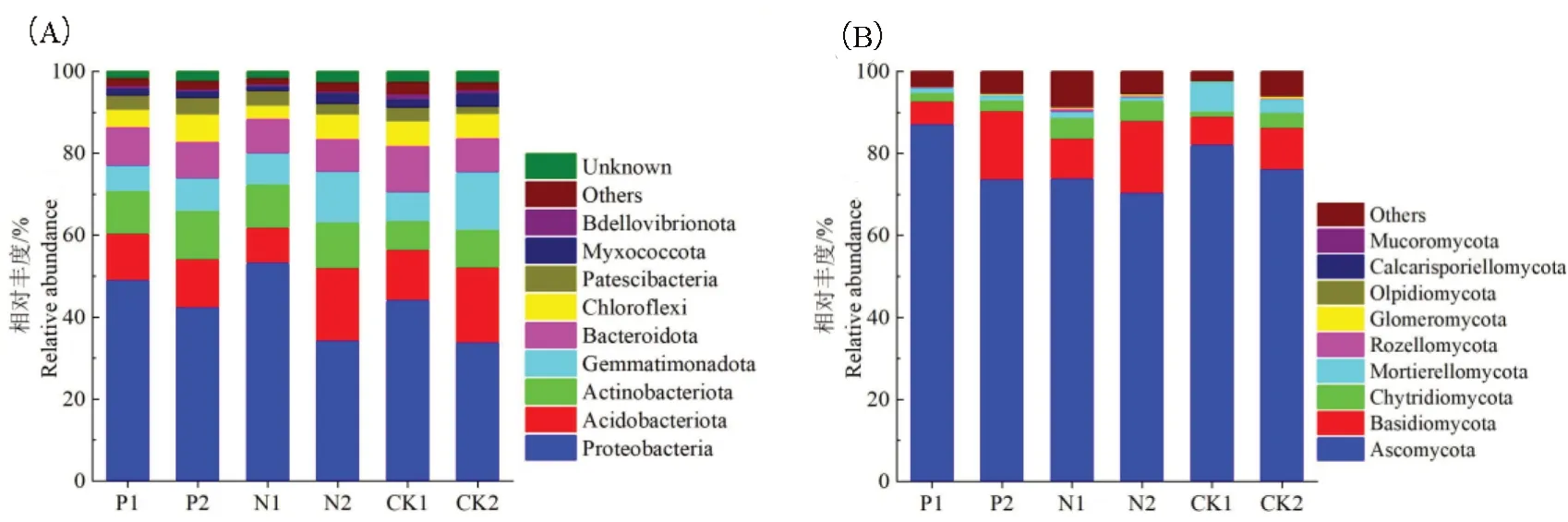
图2 各处理不同时期下微生物优势群落门水平分布Fig.2 Horizontal distribution of microbial dominant communities at different periods in different treatments
不同配施处理下的棉花根际真菌优势群落门水平分布如图2B 所示,相对丰度前5 的真菌优势门为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、被孢霉门(Mortierellomycota)和罗兹菌门(Rozellomycota)。采前与采后对比,配施γ-PGA:子囊菌门相对丰度下降15.35%,担子菌门增加195.47%,壶菌门增加29.29%,被孢霉门下降10.49%。单施化肥:子囊菌门下降4.63%,担子菌门增加77.30%,壶菌门下降0.65%,被孢霉门下降49.74%。蒸馏水处理:子囊菌门下降7.32%,担子菌门增加48.89%,壶菌门增加184.27%,被孢霉门下降55.14%。配施γ-PGA 各菌门变化趋势与蒸馏水处理相同。
2.4.3 土壤微生物物种群落结构差异分析
细菌组间主成分分析如图3A 显示,主成分1(PC1)和主成分2(PC2)贡献率分别为49.54%和16.34%。采前与采后单施化肥细菌群落的相对距离最大,配施γ-PGA 次之,蒸馏水处理最小。真菌组间主成分分析如3B 显示,主成分1(PC1)和主成分2(PC2)贡献率分别为69.18%和9.91%。采前与采后配施γ-PGA 真菌群落的相对距离最小,其余两种处理相对距离较大,且配施γ-PGA 真菌群落接近9月蒸馏水处理。

图3 不同施肥处理棉花土壤微生物群落PCA 分析Fig.3 PCA analysis of cotton soil microbial community under different fertilization treatments
2.4.4 微生物群落功能分析
图4A 显示的是棉花根际细菌群落的功能表型分析,包括需氧性(Aerobic),厌氧性(Anaerobic),移动元件(Contains Mobile Elements),兼性厌氧性(Facultatively Anaerobic),形成生物膜(Forms Biofilms),革兰氏阳性(Gram Positive),革兰氏阴性(Gram Negative),潜在致病性(Potentially Pathogenic)和胁迫耐受(Stress Tolerant)9 大类。采前与采后相比,配施γ-PGA:需氧性增加至33.33%,厌氧性增加至7.28%,兼性厌氧性降低至2.96%,胁迫耐受降低至1.56%。单施化肥:需氧性降低至27.78%,厌氧性增加至11.19%,兼性厌氧性变化不大,胁迫耐受增加至1.71%。蒸馏水处理:需氧性降低至25.62%,厌氧性增加至11.86%,兼性厌氧性增加至3.25%,胁迫耐受增加至2.81%。

图4 微生物群落功能表型分析Fig.4 Functional phenotypic analysis of microbial community
图4B 显示的是棉花根际真菌群落的功能表型分析,包括未定义腐生真菌(Undefined Saprotroph),木质腐生菌(Wood Saprotroph),粪便腐生菌(Dung Saprotroph),真菌寄生菌(Fungal Parasite),动物病原菌(Animal Pathogen),植物腐生菌(Plant Saprotroph),植物病原菌(Plant Pathogen),土壤腐生菌(Soil Saprotroph),植物内生菌(Endophyte)和动物内生菌(Animal Endosymbiont)等。采前与采后相比,配施γ-PGA:木质腐生菌下降至12.03%,植物腐生菌下降至3.25%,植物病原菌增加至6.91%,植物内生菌下降至6.56%。单施化肥:木质腐生菌增加至11.42%,植物腐生菌下降至1.03%,植物病原菌下降至5.10%,植物内生菌下降至1.68%。蒸馏水处理:木质腐生菌增加至18.85%,植物腐生菌下降至2.72%,植物病原菌增加至5.70%,植物内生菌下降至1.18%。
2.4.5 根际土壤细菌和真菌群落组成与土壤理化性质相关性分析
为探究棉花根际土壤微生物群落对土壤理化性质变化的响应规律,选取细菌和真菌群落中丰度前10 的门水平与土壤理化性质进行冗余(RDA)分析,分析结果如图5 所示,采前与采后细菌门水平下土壤全氮(TN)、全磷(TP)、全钾(TK)、铵态氮(AN)、速效磷(AP)和速效钾(AK)的射线较长,表明其对门水平细菌群落结构影响较大。变形菌门采前与全氮呈负相关,采后呈正相关;放线菌门采前与全磷呈正相关,采后呈负相关;酸杆菌门采前与速效磷呈正相关,采后呈负相关。真菌门水平下采前全磷、速效磷和全钾的射线较长,采后则是pH、有机质、速效磷和全钾的射线较长,表明速效磷和全钾对真菌门水平群落结构影响较大。子囊菌门采前和采后均与速效磷呈正相关;担子菌门采前与全磷呈正相关,采后呈负相关;壶菌门采前和采后与全钾均呈正相关,但采后其在全钾射线上的投影变短。

图5 土壤微生物群落结构与土壤理化性质的RDA 分析Fig.5 RDA analysis of soil microbial community structure and soil physicochemical properties
3 讨论
本研究发现使用γ-PGA 与化肥配施可以提高棉花叶片SOD 和CAT 活性,而单独使用化肥会导致较高的Pro 和MDA 含量。黄巧义等[18]发现,施用γ-PGA 明显提高菜心叶片CAT 活性与SOD 活性,与本研究结果一致。Pro 作为脱水胁迫、高温胁迫时各种酶的保护剂,使之不受高温破坏[19],MDA 是在植物衰老或在干旱等逆境时,其组织或器官膜脂质发生过氧化反应的最终分解产物,积累越多表明组织的保护能力越弱[20]。这表明γ-PGA 可以提高棉花叶片的抗氧化能力和抗逆性能,同时减少氧化损伤。
配施γ-PGA 可显著促进棉花生长,株高增幅45.49%,茎粗增幅13.14%,主茎叶数增幅51.88%,果枝数增幅300.75%,地上干物质量增幅140.11%,地下干物质量增幅111.87%。施用γ-PGA 水稻产量可提高13.6%,冬小麦产量可提高22.4%[21],番茄穴盘苗顶喷施6 mg·L-1γ-PGA 水溶肥根鲜质量和干质量比对照显著提高42.2%[22],均与本研究结果相似。作物的生长指标能够反映作物的生长状况和养分吸收情况[23]。配施γ-PGA 能显著增加棉花地上部生物量,单施化肥则无明显增长,显示γ-PGA 可以促进作物生长。
本研究通过对棉花根际土壤理化性质的测定发现,γ-PGA 的施用对土壤具有改良作用。采前与采后对比,棉花采摘后土壤pH 变化不显著,有机质含量均显著下降。配施γ-PGA 后,棉花根际土壤中全氮含量下降,但铵态氮含量显著上升。这可能是因为γ-PGA 促进了土壤中微生物的活性,促进了铵态氮的转化,并提高了土壤的矿化和硝化作用[24]。配施γ-PGA 和单施化肥,采后土壤全磷和速效磷含量均下降,全钾和速效钾含量有所上升。有研究表明,微生物菌肥在分解有机质时需要合成蛋白质,从而需要一定量的氮、磷元素[25],植物的营养需求在不同生长阶段有所不同,这可能是导致施肥后某些养分下降或上升的原因。
细菌群落是根际微生态中不可或缺的一部分,对基质中养分活化和防治病害起重要作用,很多研究通过直接接种促生菌或添加有机肥来调控细菌群落结构和多样性[26]。本试验中,配施γ-PGA 细菌丰度与多样性低于单施化肥和蒸馏水处理;配施γ-PGA 真菌群落丰度最高且棉花采后下降不显著,单施化肥真菌群落多样性最高,配施γ-PGA 次之。这与Yin[14]的研究结果不一致,添加γ-PGA 可提高土壤中细菌的丰富度、多样性和生物量,降低真菌的多样性,但显著提高了真菌生物量。这可能是因为施用化肥,γ-PGA 的分子链上具有大量游离的羧基,因而具有大量活性位点,易与氮磷钾元素配位反应,形成复合物[27],且γ-PGA 有一定的抗菌性,对革兰氏阴性菌和革兰氏阳性菌均有较强的抑菌或杀菌作用[28]。
优势物种主导土壤微生物群落,了解不同水平的物种组成对于理解群落结构形成、变化及其生态影响至关重要。变形菌门的大部分成员在固氮中发挥重要作用[29-30]。本试验中配施γ-PGA 的采后土壤中变形菌门的下降程度最低。有研究发现,放线菌门细菌具有产生多种代谢物(如抗生素等)及分解难降解物质(如纤维素和几丁质等)转化为有机物的功能[31]。蒸馏水处理的采后土壤中放线菌门的增加程度最高,配施γ-PGA 次之,单施化肥最低。有研究表明担子菌门对难分解碳的利用能力较强,对低养分环境的适应能力比较强[32]。本试验配施γ-PGA 显著增加了采后土壤中担子菌门相对丰度。被孢霉门偏爱通气性好的土壤,并可分解木质素和纤维素等,同时利用土壤中多糖类物质进行代谢增长,有助于补偿土壤流失的养分[33]。本试验配施γ-PGA 的采后土壤中被孢霉门相对丰度下降程度最低。以上结果表明施用γ-PGA 可改善土壤条件,利于有益微生物的生存。
通过微生物功能表型分析发现,配施γ-PGA的采后土壤中需氧型相对丰度提高,而单施化肥和蒸馏水处理则需氧型相对丰度显著降低,厌氧性却显著上升。此外,配施γ-PGA 的采后土壤中植物腐生型相对丰度下降程度较小,共生型相对丰度趋势一致。因此,γ-PGA 不仅有助于改善土壤环境,还有利于维护根际土壤健康。
配施γ-PGA 引起的土壤理化性质的改变对土壤微生物菌群的群落结构产生一定影响。通过RDA 分析得出,棉花根系土壤的全氮、全磷、全钾、铵态氮、速效磷和速效钾是微生物群落改变主要的影响因子。有研究指出有机质含量对土壤菌群结构的变化有极显著影响[34-35]。本试验中有机质的影响并不大,可能是因为本试验是基于盆栽,有机质的存储不如大田。土壤中的速效磷和速效钾与土壤微生物群落具有较大相关性[36],并作为主要因素影响微生物菌落的结构,我们的研究也反映了此点。本试验中不同时期某些菌群的影响因子并不相同,进一步说明可通过改变土壤理化性质来影响微生物群落。
4 结论
γ-PGA 可促进作物生长,并增强抗逆性。配施γ-PGA 明显增加土壤速效养分含量和真菌群落丰度,并且在棉花采收后仍可维持在采收前的程度。配施γ-PGA 还可富集有益微生物,土壤微生物群落功能倾向于需氧型和植物共生型。
