猪圆环病毒2 型感染树突状细胞外泌体中差异miRNA 分析
2023-09-09上官琳晖丁文文刘佳宇范阔海尹伟孙娜孙盼盼李宏全
上官琳晖,丁文文,刘佳宇,范阔海,尹伟,孙娜,孙盼盼,李宏全*
(1.山西农业大学 动物医学学院/中兽医药现代化山西省重点实验室,山西 晋中 030801;2.山西农业大学 实验动物管理中心,山西 晋中 030801)
猪圆环病毒2 型(Porcine circovirus type 2,PCV2)是猪圆环病毒相关疾病(Porcine circovirus type 2 associated disease,PCVAD)主要病原体[1]。PCV2 感染后主要侵害机体免疫系统,表现为感染猪外周血和免疫器官中淋巴细胞大量凋亡,致使感染猪出现免疫抑制并继发感染猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndromevirus,PRRSV)、猪细小病毒和猪流行性腹泻病毒等多种病原体[2-3]。在PCV2 感染猪体内,其抗原主要存在于树突状细胞(Dendritic cell,DC)中[4]。体外实验表明,PCV2 在体外感染树突状细胞后,会抑制DC 成熟增强DC 内吞作用,减弱DC对T 淋巴细胞的刺激作用[5]。因此,探讨PCV2 与树突状细胞相互作用的机制是有必要的。
DC 作为功能最强的抗原呈递细胞(Antigenpresenting cell,APC),在免疫反应中起捕获外来抗原的作用[6]。但是病毒也可以通过干扰DC 功能来逃避机体的抗病毒免疫反应并导致持续感染[7],或者利用DC 摄取抗原后向淋巴结迁移的特性以DC 为媒介在体内传播[8-9]。研究表明,PCV2感染机体后,以巨噬细胞或树突状细胞为靶细胞,单核细胞来源的树突状细胞(Mononuclear-derived dendritic cells,MoDC)中持续存在并保持感染性;这种现象表明DC 可能是PCV2 在体内传播的媒介[10-11]。
外泌体(Exosome,Exo)是一种由细胞释放的细胞外囊泡(Extracellular vesicles,EVs),直径为30~150 nm,呈椭圆或圆形盘状[12-14]。外泌体可通过传递其所携带的内容物(蛋白质、脂质、mRNA、miRNA、tRNA 等)参与细胞间的分子传递来调节受体细胞的生理状态[15]。在病毒感染中,外泌体可以通过内容物变化,对机体的抗病毒作用产生影响[16]。MicroRNA(miRNA)是一类内源性非编码小RNA,大小为19~25 nt,在细胞凋亡、免疫功能和肿瘤发生等过程中发挥调节作用,通常会导致靶基因转录后沉默[17-18]。研究表明,病毒感染会引起宿主细胞中miRNA 表达量的变化,差异miRNA 又可以通过靶向宿主或病毒的基因转录,来调节病毒感染过程和宿主的免疫反应[19],如PRRSV可以通过上调感染细胞中miR-382-5p 和miR-30c表达,抑制Ⅰ型IFN 产生,促进PRRSV 的感染和复制[20-21]。病毒与miRNA 这种相互作用可以被外泌体介导。PCV2 感染PK-15 细胞后,PK-15 外泌体可以通过上调miR-125a-5p 来抑制靶基因Bcl-2 表达,从而激活线粒体凋亡通路,抑制脾淋巴细胞增殖[22-23]。
课题组前期研究发现,PCV2 感染MoDC 后,在MoDC 来源外泌体中检测到病毒成分,但PCV2感染后是否可以引起MoDC 来源外泌体中miRNAs 变化,以调节机体免疫反应目前尚不清楚。因此,本研究通过建立PCV2 感染猪MoDC 模型,对正常MoDC 来源外泌体(DEX)与病毒感染的MoDC 来源外泌体(VDEX)中miRNA 进行高通量测序,旨在探明PCV2 影响下VDEX 中差异表达miRNAs 及其靶基因的变化规律,为明确PCV2 感染的分子机制提供思路。
1 材料和方法
1.1 试验材料和细胞制备
PCV2-SH 毒株由南京农业大学姜平教授提供,经PK-15 增殖后测定病毒TCID50 为10-5.38。选取1 月龄临床健康且PCV2 阴性长白猪,购自太谷县冠农农牧科技有限公司,采集前腔静脉血20 mL,使用猪外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)分离液试剂盒(天津灏洋)提取PBMC。将PBMC 在MoDC 诱导培养基中培养6 d,每隔天更换半量培养基,即可得到MoDC。
1.2 试验方法
1.2.1 建立MoDC 感染PCV2 模型
将所得MoDC 接种到96 孔板中,每孔5×104个细胞,37 ℃孵育12 h。弃去原培养基,加入2%1640 培养基和感染复数为1 MOI 的PCV2 病毒液,同时设置空白细胞对照组,每组3 个重复孔,病毒作用于细胞2 h 后弃去病毒液,加入2% 1640 培养基,培养至48 h。使用PCV2 间接免疫荧光检测试剂盒(中国兽医药品监察所)检测MoDC 是否感染PCV2。
1.2.2 外泌体制备及鉴定
超高速离心法提取DEX 与VDEX。将细胞培养液转移到10 mL EP 管中,1500 r·min-1,离心10 min,去除细胞沉淀;6000 r·min-1,4 ℃,离心10 min,去除死细胞;15 000 r·min-1,4 ℃,离心30 min,去除细胞碎片;31 200 r·min-1,4℃,离心90 min,弃去液体,1 mL 预冷PBS 完全溶解沉淀后,补满PBS;31 200 r·min-1,4℃,离心90 min,弃去液体,100 μL 预冷PBS 重悬沉淀,经0.22 μm 滤器过滤后分装,-80 ℃保存。
纳米颗粒追踪技术(NTA)检测:使用超纯水清洗Zeta View PMX 110 样本池,聚苯乙烯微球(110 nm)校准机器,PBS 溶液再次清洗样本池,将DEX 与VDEX 样品使用PBS 溶液稀释后上机检测。
Western blot 检测:分别取100 μL 溶于PBS 的DEX 与VDEX 提取总蛋白,二喹啉甲酸(Bicinchoninic acid,BCA)法测蛋白浓度,Western blot 鉴定外泌体表面标志物CD63 和TSG101,一抗Anti-CD63 antibody(Abcam)和TSG101 Polyclonal Antibody(三鹰生物)以5% BSA 封闭液按1:1000 稀释,二抗Goat Anti-Rabbit IgG(H+L)-HRP(全式金)以TBST 按1∶40 000 稀释。
1.2.3 Small RNA 测序
TRIzol 法分别提取DEX 与VDEX 组总RNA,用于Small RNA 文库制备。使用TruSeq Small RNA Sample Prep Kits 试剂盒制备Small RNA 测序文库,由联川生物技术公司完成测序。
1.2.4 测序结果分析
使用ACGT101-miRNA 软件对miRNA 测序结果进行分析。原始数据经过质控处理后得到clean reads,留碱基长度在18~26 nt 序列,再将其与各种RNA 数据库(mRNA 数据库、RFam 数据库和Repbase 数据库)序列比对与过滤,最后获得有效数据,对有效数据进行进一步鉴定和预测分析。
1.2.5 miRNA 表达和差异分析
将DEX 组和VDEX 组miRNA 表达量归一化到同一数量级,每组样品拷贝数=原始拷贝数×算法校正因数;当miRNA 表达量>1000 为高表达,表达量在10~999 之间为中表达,表达量在0~9 之间为低表达。miRNA 差异倍数(Fold change,FC)=VDEX 组均值/DEX 组均值,采用独立样本T 检验分析两组样品间miRNA 差异显著性,当|Log2(FC)|>1 时,如P<0.01 则miRNA 表达差异极显著;0.01
1.2.6 miRNA 靶基因预测和富集性分析
使用TargetScan(v5.0)和miRanda(v3.3a)对差异显著(P<0.05)的miRNA 进行靶基因预测。在TargetScan算法中保留阈值为TargetScan score≥50,miRanda Energy<-10,两款软件筛选结果取交集即为miRNA 靶基因。对靶基因进行GO 功能和KEGG通路富集分析。
1.2.7 目标miRNA 的qPCR 验证
根据测序所得miRNA 序列采用加尾法在DNAMAN 9 软件中设计miRNA 上游引物(表1),引物序列由西安擎科生物科技有限公司合成,下游通用引物由M5 miRNA qPCR Assay Kit 提供。使用Easy Pure® miRNA Kit 试剂盒(全式金)提取并纯化DEX 与VDEX 中miRNA,根据M5 miRNA cDNA Synthesis Kit(聚合美)说明书进行操作,qPCR 反应体系20 μL:2×M5 miRNA qPCR Mixture 10 μL,上、下游引物各0.4 μL,cDNA 2 μL,ddH2O 7.2 μL。PCR 反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火/延伸1 min,共40个循环;熔解曲线15 s。目的基因表达量用2-ΔΔCt法计算。

表1 qRT-PCR 引物序列Table 1 qRT-PCR primer sequence
1.3 数据分析
miRNA 测序结果用独立样本t检验和超几何检验进行分析。qRT-PCR 结果t-test 检验显著性;P<0.05 表示差异显著,P<0.01 差异极显著。用GraphPad Prism 5.0 软件作图。
2 结果与分析
2.1 感染PCV2 MoDC 模型的鉴定
PCV2 Cap 蛋白是由ORF2 所编码的病毒衣壳蛋白,是PCV2 目前唯一已知的结构蛋白,具有良好的免疫原性,常用来作为PCV2 的检测[22]。感染PCV2 的MoDC 培养48 h 后,]间接免疫荧光(IFA)检测PCV2 Cap 蛋白,用荧光倒置显微镜观察。未感染病毒的MoDC 正常细胞对照组(图1A,图1C)中未观察到特异性绿色荧光;MoDC 在感染PCV2 48 h 后,荧光显微镜下可观察到特异性的绿色荧光为Cap 蛋白(图1D,图1F),并且可以观察到Cap 蛋白在MoDC 内表达(图4F)。结果表明,MoDC 可以被PCV2 感染,PCV2 体外感染MoDC 模型建立成功,达到后续提取外泌体的细胞要求。
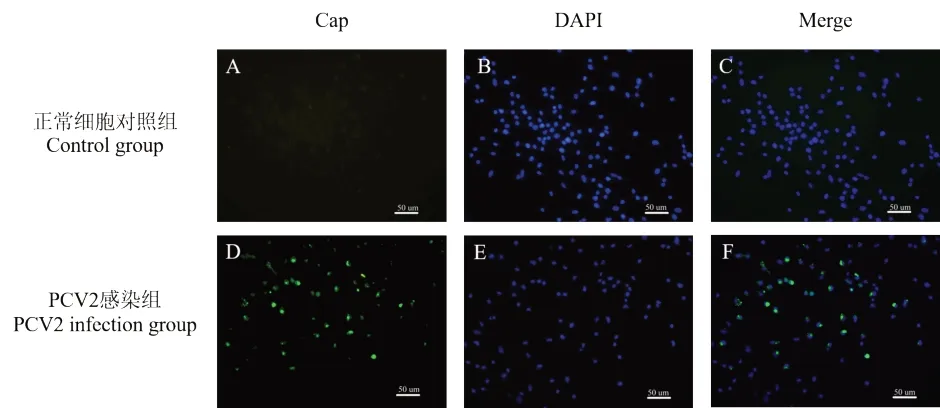
图1 PCV2 感染MoDC 48 h 后PCV2 Cap 蛋白分布Fig.1 Cap protein distribution of PCV2 after PCV2 infection with MoDC in 48 h
2.2 外泌体鉴定
DEX 与VDEX 鉴定结果如图2 所示。粒径检测颗粒分析技术结果见图2A,2 组外泌体直径集中在120 nm 左右。从两组MoDC 培养基上清中经超速离心所得的沉淀物,免疫印迹检测结果见图2B,沉淀物均表达外泌体标志性蛋白质CD63 和TSG101。NTA 和WB 结果表明,超高速离心所得沉淀物为外泌体。
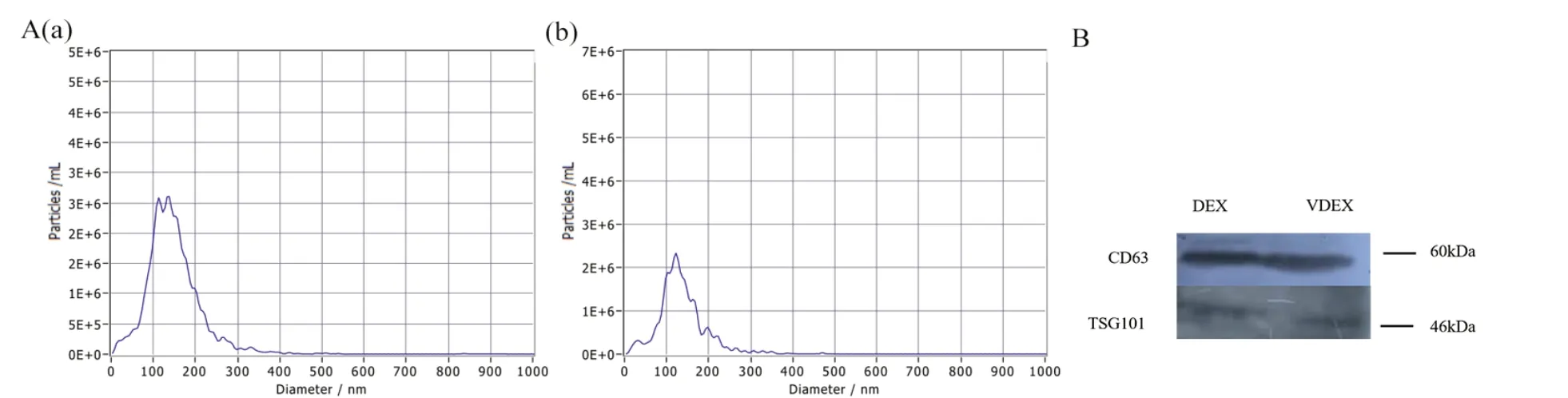
图2 外泌体鉴定Fig.2 Identification of exosomes
2.3 DEX 和VDEX 差异表达miRNAs 比较分析
DEX 和VDEX 的miRNAs 表达量差异表达miRNAs 有908 个。表2 给出差异极显著前10 个miRNA。差异表达miRNAs 火山图(图3)显示,与DEX 组相比,VDEX 组差异表达显著有504 个miRNAs(P<0.05),VDEX 组特异性高表达新miRNA 有3 个,分别是:miPC-3p-11758_454、miPC-3p-7555_705 和miPC-5p-3971_1298;特异性中度表达有61 个。DEX 组特异性高表达有3个,分别是:ssc-miR-4332_L-1R-1、ssc-miR-142-3p 和ssc-miR-150;特异性中表达有156 个,特异性低表达87 个。即PCV2 侵入树突细胞外泌体以后激活了64 种miRNA 表达,遏止了246 个miRNA 表达。
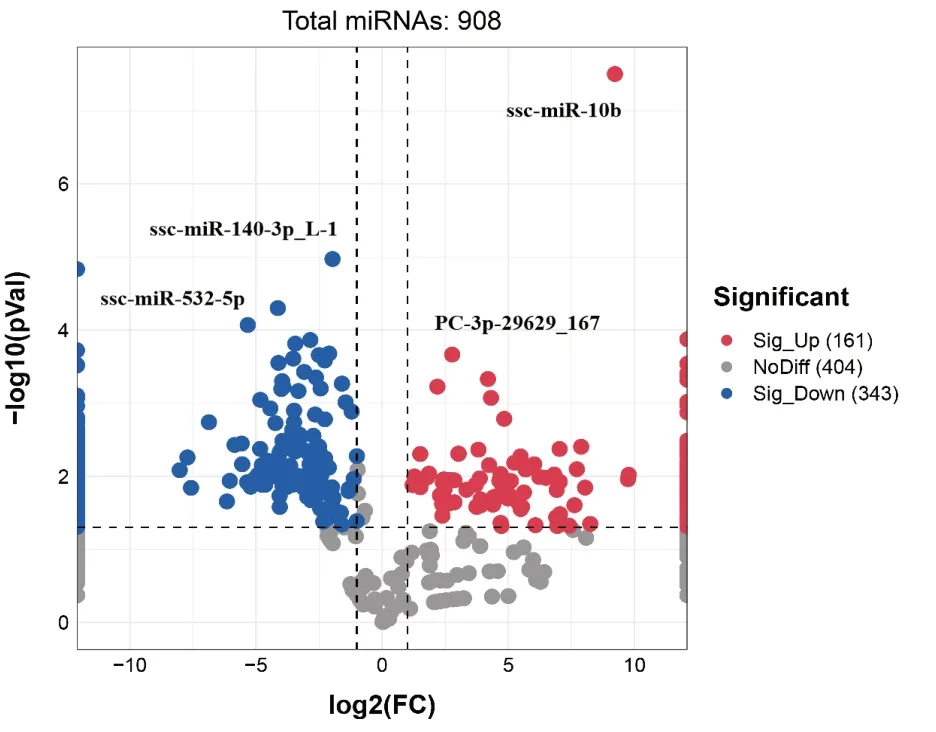
图3 差异表达miRNA 火山图Fig.3 Volcano plot of differentially expressed miRNA
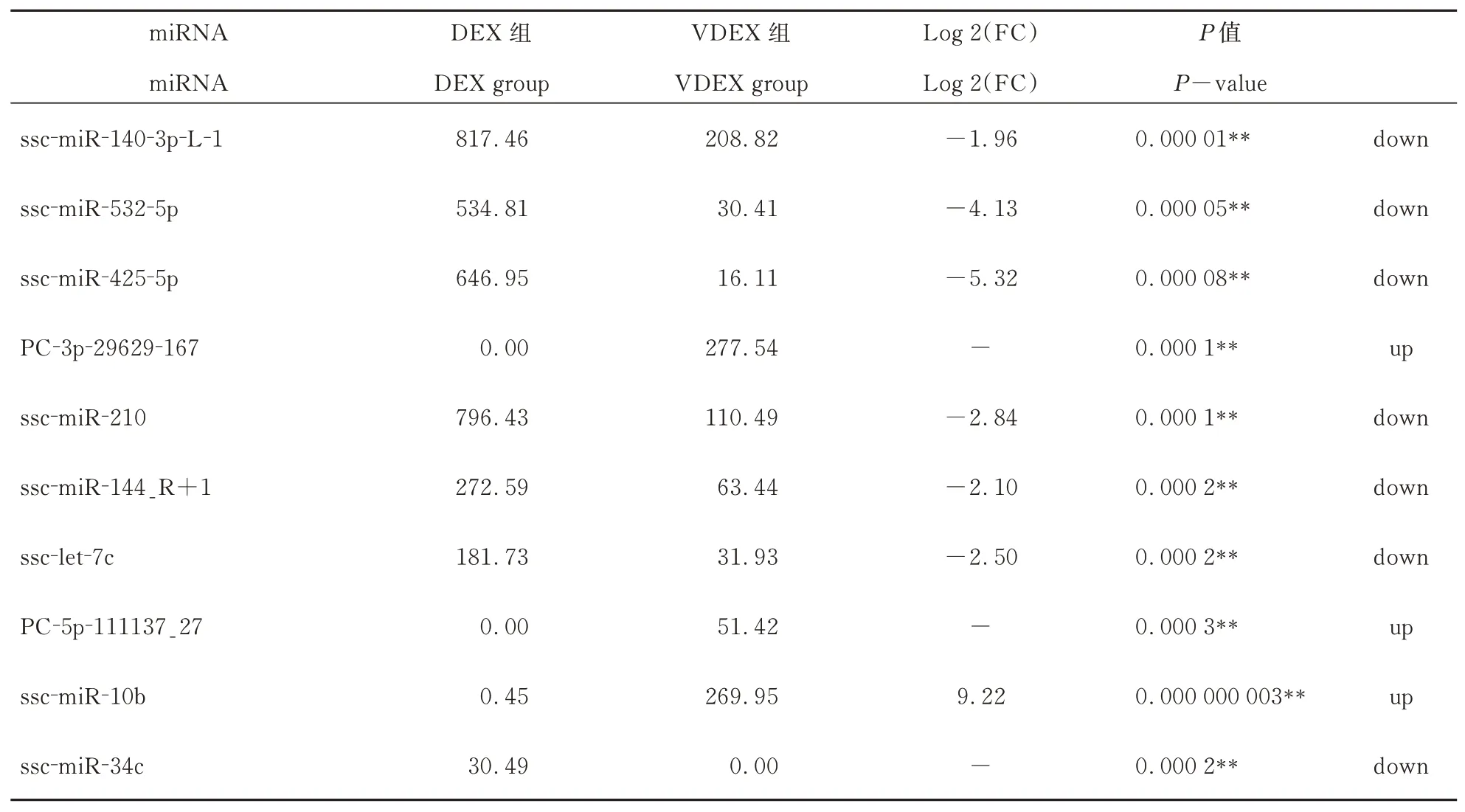
表2 PCV2 感染外泌体中差异极显著miRNA(前10)Table.2 Highly differentiated miRNAs in PCV2-infected exosomes (Top 10)
2.4 miRNAs 聚类热图
图4是用miRNA 差异极显著前40 个miRNA聚类分析,特异性仅在DEX 中表达miRNA 有11个,仅在VDEX 组表达8 个;共表达miRNA 有21个:其中19 个miRNA 在VDEX 中显著降低,仅有2 个上调。
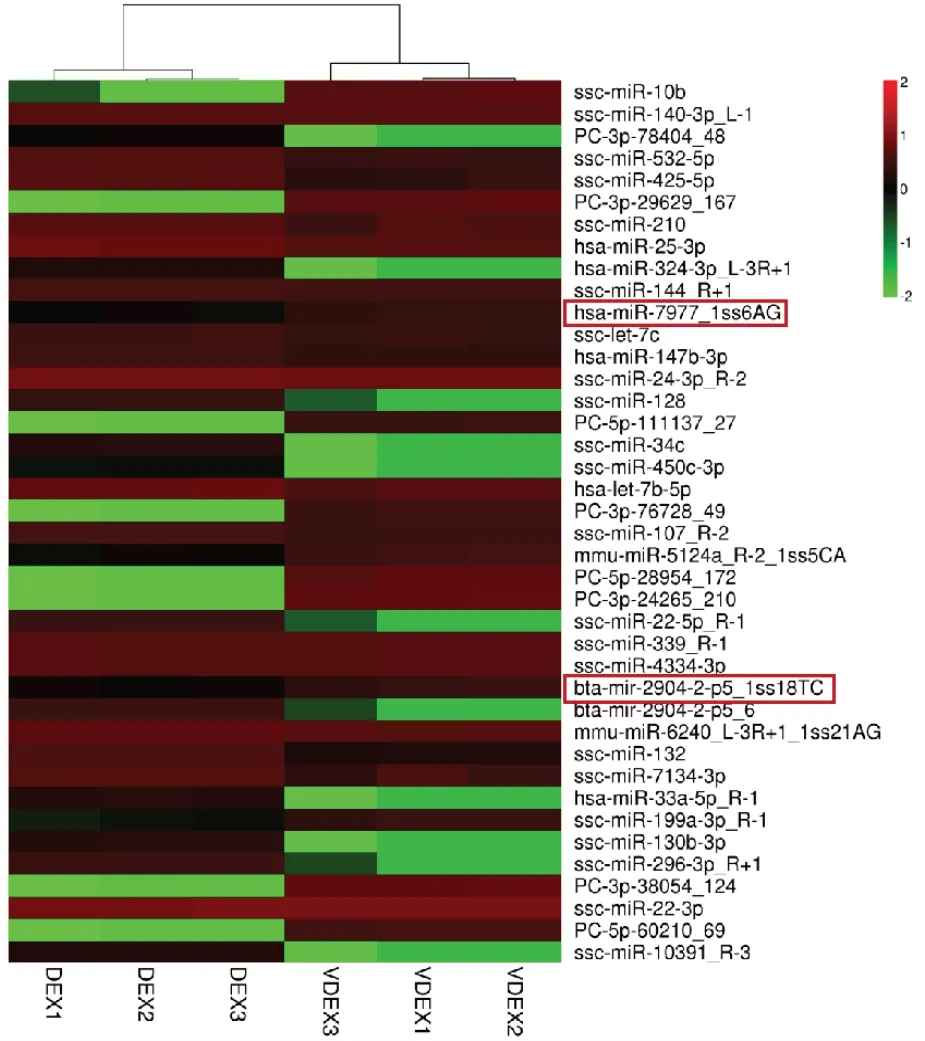
图4 差异表达miRNA 聚类热图Fig.4 Complex heatmap of differentially expressed miRNA
2.5 靶基因GO 富集分析
GO 富集分析气泡图显示(图5),差异miRNA的靶基因富集在细胞核中的数量最多,其次是蛋白结合功能;富集程度最高的是激酶活性、其次是氧化还原酶活性;靶基因富集数量多同时富集程度高是在细胞质。结果表明差异miRNA 的靶基因可能广泛参与调控细胞功能和生物学过程。

图5 差异表达miRNA 靶基因GO 富集分析Fig.5 GO enrichment analysis of differentially expressed genes in miRNA
2.6 靶基因KEGG 分析
KEGG 通路分析气泡图(图6)显示,差异miRNA 的靶基因富集在癌症通路的数量最多,其次是单纯疱疹病毒1 感染通路;富集程度最高的通路是T 细胞受体(TCR)信号通路,其次Th17 细胞分化通路、再者是B 细胞受体信号通路和FCγR-介导吞噬作用;靶基因富集数量多同时富集程度高的是内吞作用通路。TNF 信号通路、人白细胞病毒1 感染(HTLV-1)、人类免疫缺陷病毒1 型感染(HIV-1)、类风湿关节炎通路、流体剪切力与动脉粥样硬化、趋化因子信号通路等均与免疫相关。
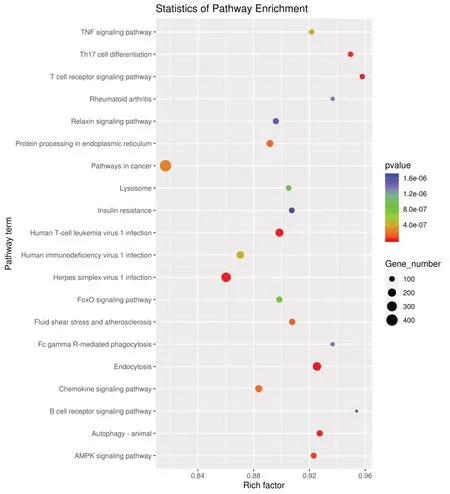
图6 差异表达miRNA 靶基因KEGG 富集分析Fig.6 KEGG enrichment analysis of differentially expressed miRNA target genes
2.7 构建miRNA 靶基因的网络图
选择VDEX 组特异性高表达的3 个miRNAs,极显著上调ssc-miR-10b 和PC-3p-29629_167 ,极显著下调ssc-miR-140-3p_L-1、ssc-miR-532-5p、 ssc-miR-425-5p、 ssc-miR-210、 ssc-miR-144_R+1 和ssc-miR-34c 的靶基因及其富集KEGG 通路(表3)。把12 个miRNAs 预测靶基因作为研究对象,以红色四边形节点为miRNA,紫色圆形节点为对应的靶基因,箭头代表靶向关系,构建miRNA-Target 的调控网络图(图7),其中VDEX 组特异性高表达miPC-3p-7555_705 处于中间位置,与ssc-miR-10b 共同调控TNF 表达,与特异性高表达miPC-5p-3971_1298 共同调控TRIM52 和SMAD3,与ssc-miR-140-3p_L-1 共同调控IL2 和PPP3CA,还有ssc-miR-532-5p 调控IL2,与ssc-miR-34c 共同调控转录因子FOSL1。另外,IL-2 及受体家族IL2RG、IL2RA、IL2RB,原癌基因AKT 家族等、转录因子、NFKBIA、NFKBIE、NFATC1 家族均是与免疫调控密切相关的基因。
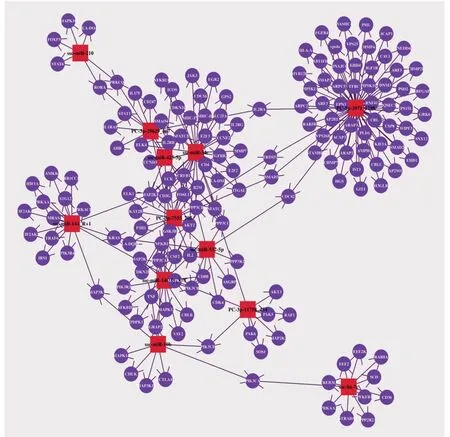
图7 12 个miRNA-靶基因网络图Fig.7 Network diagram of 12 miRNA-target genes
2.8 miRNA 测序结果验证
在表达差异显著miRNA 中进一步筛选,保留P<0.001 和| Log2(FC)|≥2.0 的猪源已知miRNA,再参照KEGG 结果筛选可能参与病毒感染和免疫相关的目标miRNA。最后选出10 个目标miRNA:ssc-miR-199a-3p-R-1、ssc-miR-532-5p、ssc-miR-425-5p、ssc-miR-210、ssc-miR-144-R+1、ssc-let-7c、ssc-miR-107-R-2、ssc-miR-22-5p-R-1、ssc-miR-296-3p-R+1 和ssc-miR-10b。对筛选出10 个目标miRNA 进行qPCR 验证,结果表明,与DEX 相比,ssc-miR-532-5p、ssc-miR-425-5p、ssc-miR-210、ssc-miR-144-R+1、ssc-let-7c、ssc-miR-107-R-2、ssc-miR-22-5p-R-1 和 sscmiR-296-3p-R+1 在VDEX 中表达量均显著降低(P<0.05;图8),与测序结果一致;ssc-miR-199a-3p-R-1 和ssc-miR-10b 在VDEX 中表达量显著降低(P<0.05),与测序结果不一致,这可能由于我们未使用测序样本进行验证,并且这2 组基因表达量偏低,从而导致结果上下调不一致。
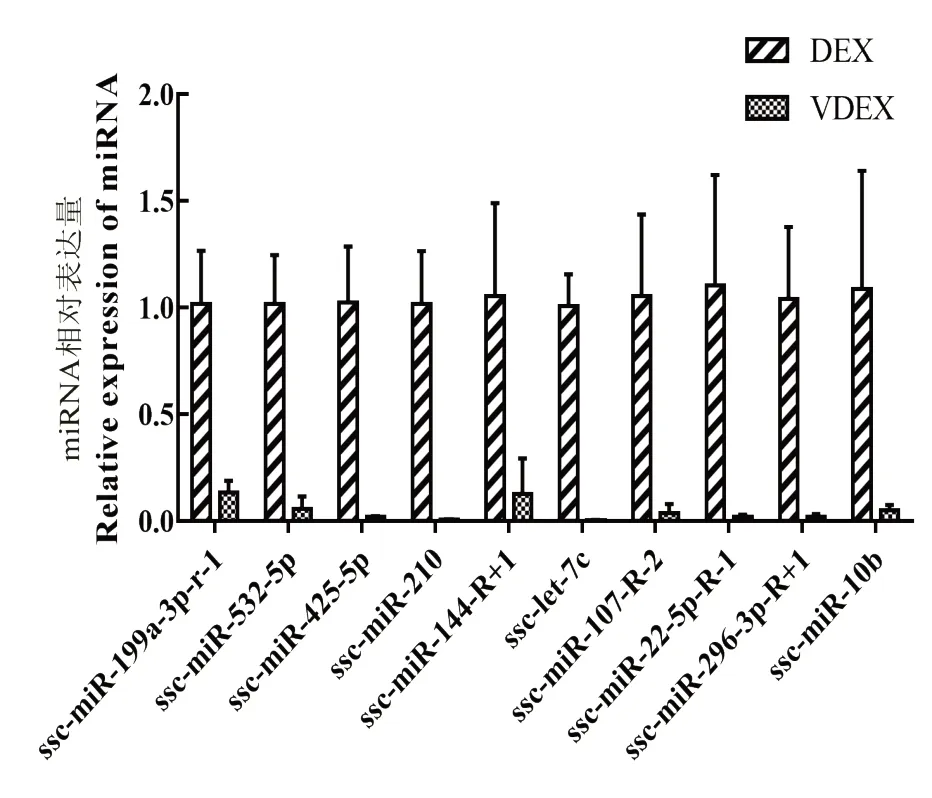
图8 目标miRNA qPCR 验证Fig.8 qPCR verification of target miRNA
3 讨论
DC 是目前所知抗原递呈功能最强大的抗原递呈细胞,能有效激活初始T 细胞,参与机体的免疫调节。Vincent 等[24]研究发现,感染了PCV2 的DC 与T 细胞共培养一段时间后,虽然观察到T 细胞与DC 产生了细胞接触,但未观察到病毒转移。这表明,在PCV2 感染中,感染了PCV2 的DC 可能不通过细胞接触的方式调节机体的抗PCV2 感染。DC 分泌的外泌体具有调节多种免疫细胞细胞活动的功能。Tkach 等[25]通过将DC 分泌的各类外泌体分别添加进CD4+T 细胞培养体系中与T 细胞共孵育。结果发现,DC 分泌的外泌体均可以激活CD4+T 细胞,促进CD4+T 细胞增殖及分化。另外,在肿瘤研究中,发现外泌体还可以通过向受体细胞传递MHC Ⅰ、补体活化相关物质以及抗原成分,促进T 细胞和B 细胞的活化,增强抗肿瘤免疫反应[26-28]。为了探究感染了PCV2 的DC 是否可以通过VDEX 途径进行免疫调节,本研究通过高通量测序技术获得了DEX 与VDEX 中miRNA 差异表达谱,与DEX 相比,VDEX 中表达差异显著的miRNA 有504 个(P<0.05),其中上调的有161个,下调的有343 个。对差异显著的miRNA 进行靶基因预测、GO 富集分析和KEGG 富集分析,差异显著miRNA 共预测到13 204 个靶基因(P<0.05),GO 富集分析得到具有显著性的GO 条目1752 条(P<0.05),KEGG 富集分析得到具有显著性的通路203 条(P<0.05)。
GO 富集分析结果显示,差异miRNA 的靶基因主要参与的生物学功能有转录调控(DNA 模板)、RNA 聚合酶Ⅱ对转录的正/负调控、信号转导和氧化还原等过程,KEGG 通路富集显示,差异miRNA 靶基因在TNF 信号通路、Th17 细胞分化通路、T 细胞受体信号通路、癌症通路、B 细胞受体信号通路、自噬通路和AMPK 信号通路等信号通路显著富集。因此,DEX 与VDEX 的差异主要集中在转录调控、信号转导、细胞核、T 细胞受体信号通路等方面。这些差异表明,VDEX 可能通过参与转录调控和T 细胞受体信号通路介导免疫过程。
其中ssc-miR-122 通过与PK-15 细胞中的3’UTR 结合,下调活化T 细胞5 核因子(NFAT5)和嘌呤霉素敏感氨基肽酶的表达,抑制PCV2 的蛋白质表达和病毒DNA 复制[29]。miR-30a-5p 靶向自噬调节因子14-3-3 基因,并在调节细胞周期中发挥作用。miR-30a-5p 的过表达可以通过增强自噬来触发PCV2 复制,而miR-30a-5p 的阻断显著降低了PCV2 的复制[30]。miR-15a 的上调通过介导细胞周期蛋白D1 和E 的降解促进了PCV2 诱导的G0/G1 细胞周期阻滞,有助于病毒的有效复制[31]。在本研究中,ssc-miR-122 的上调以及miR-30a-5p 的下调可能解释PCV2 在DC 细胞中没有检测到明显的病毒复制。PCV2 通过上调miR-23a 和miR-29b,激活PI3K/Akt1 和p38 MAPK 信号,抑制IL-12p40 的表达。同时,抑制ssc-miR-23a 和ssc-miR-29b 可以减轻PCV2 对IL-12p40 的抑制作用,导致IL-12p40 表达和Th1 细胞群增加[32]。IL-12p40 是IL-12 的p40 亚基,其可以诱导Th1 的促炎功能,从而将先天免疫反应和适应性免疫反应联系起来[33]。提示ssc-miR-23a 和ssc-miR-29b可能与T 细胞极化和宿主免疫反应有关。在PCV2 亚临床感染猪中miRNA 126-3p,miRNA 126-5p,let-7d-3p,mir-129a 和mir-let-7b-3p 上调,而mir-193a-5p,mir-574-5p 和mir-34a 下调,推测这些miRNA 可以参与与免疫系统相关的途径[34]。
本研究通过结合差异miRNA 显著性P 值,Fold-change 以及KEGG 分析结果,选出可能参与VDEX 介导免疫反应的10 个目标miRNA。在这10 个miRNA 的预测靶点中,存在调控T 细胞增殖分化的靶点。ssc-miR-10b 靶向IL2RA 基因,IL2RA 可以通过激活调节性T 细胞(Treg)来抑制效应T 细胞的活化和增殖[35,36]。ssc-miR-532-5p、ssc-miR-107-R-2 和ssc-miR-296-3p-R+1 靶向TAF1 基因,TAF1 是CD4+CD25+FoxP3+Treg 细胞主要转录子FoxP3 的启动子,有促进Treg 分化增殖的作用[37]。ssc-miR-107-R-2 靶向STAT3,STAT5 基因,研究发现STAT3 和STAT5 可作用于Treg 的分化过程,未成熟树突状细胞外泌体中miR-683 可以通过调节STAT3,STAT5 的表达促进Treg 分化[38]。
随后,我们对目标miRNA 进行qPCR 验证,检测miRNA 在正常组和病毒组中的相对表达量,结果发现qPCR 结果与测序结果基本一致。由此可知,VDEX 可能是通过调控T 细胞的增殖分化来调节免疫反应。虽然本研究获得了感染PCV2 的MoDC 外泌体中差异表达miRNA 的一些信息,但仍然存在一些不足,本研究仅限于基因水平,缺乏在动物模型中的验证,我们将在后期试验中进一步验证本次发现。
4 结论
本研究通过比较DEX 和VDEX 中差异表达miRNA 来进行生物信息学预测分析,结果发现差异miRNA 靶基因主要参与转录调控,并且多集中于T 细胞受体信号通路。由此我们推测PCV2 感染后表达量变化最大的13 种miRNA 可能是VDEX 调节免疫反应的效应物质之一。本试验为深入研究PCV2 与DC 感染的相互作用以及对PCV2 的防治提供了新思路。
