eGFR降低的心肌梗死患者冠状动脉介入治疗造影剂相关急性肾损伤的观察分析
2023-09-08范继红刘江红王刚龙欢马文静刘锐锋
范继红,刘江红,王刚,龙欢,马文静,刘锐锋
急性心肌梗死(acute myocardial infarction,AMI)是冠状动脉粥样硬化性心脏病(冠心病)的严重亚型,发病率在我国呈逐年上升趋势,严重危害人民健康,其内在机制为冠状动脉(冠脉)的急性闭塞导致心肌细胞不可逆坏死,紧急经皮冠脉介入治疗(PCI)是当前开通冠脉和改善患者预后的首选方案。但临床实践中,相当一部分AMI患者合并慢性肾功不全(CKD),有研究指出,接受PCI及最佳药物治疗的AMI患者中CKD患者达42.76%[1]。在慢性冠心病人群中,介入治疗相关的肾功能异常或肾功能恶化是使用造影剂的严重并发症之一,肾损伤发生率存在很大差异(3.3%~14.5%)[2]。对于合并CKD的AMI患者,目前尚缺乏介入治疗后造影剂肾损伤的数据,这类患者常因顾虑肾功的恶化难以决策是否行紧急PCI治疗。因此本研究探讨eGFR降低[估算肾小球滤过率(eGFR)<90 ml/(min·1.73 m2)]的AMI患者,在行PCI术后造影剂相关性肾损伤(PC-AKI)的发生情况及其潜在因素,为临床实践提供更多的可靠依据。
1 资料和方法
1.1 研究人群2015年5月至2020年5月于首都医科大学附属北京友谊医院行PCI的AMI患者。
1.2 纳入标准①年龄18岁以上,符合ST段抬高型心肌梗死(STEMI)或非ST段抬高型心肌梗死(NSTEMI)的通用定义[3];②入院后接受冠脉造影评估并确诊为急性心肌梗死;③eGFR<90 ml/(min·1.73 m2);④患者均签署知情同意书。共纳入AMI患者85例。依据eGFR分期,其中CKD2期(eGFR)60~90 ml/(min·1.73 m2)24例;CKD3期(eGFR)30~60 ml/(min·1.73 m2)49例;CKD4期(eGFR)15~30 ml/(min·1.73 m2)12例。
1.3 排除标准透析及移植、住院期间重复冠脉造影、甲状腺功能亢进、急性肾功能不全(入院后肾功能在行介入治疗前较既往水平明显升高,达到急性肾损伤标准)、陈旧性心肌梗死、心肌病、肺部感染、支气管哮喘、恶性肿瘤、风湿免疫性疾病。因 eGFR<15 ml/(min·1.73 m2)患者多为透析或拒绝冠脉造影,故未予纳入。
1.4 肾功能评估及观察指标所有患者在入院后、PCI术前、PCI术后 24 h、48 h 、72 h分别检测血肌酐、尿素氮水平。eGFR 应用适合中国人的肾脏病膳食改良试验(MDRD)公式计算:eGFR[ml/(min·1.73 m2)]=186×血清肌酐(mg/dl)-1.154×年龄-0.203×(女性×0.742)。PC-AKI标准:应用碘造影剂48~72 h内,血清肌酐绝对增加≥0.3 mg/dl(≥26.5 μmol/L)或相对增加≥50%(≥1.5倍基线)。记录基线资料、实验室检验、超声心动图评估、冠状动脉特征及住院期间用药情况。
1.5 手术及围术期用药术前以0.1% 利多卡因局麻,初诊患者顿服抗血小板聚集药物负荷量(阿司匹林 300 mg、替格瑞洛180 mg或硫氢酸氯吡格雷600 mg),曾规律服用两种药物者不予顿服。术中肝素用量100 U/kg,并酌情给予血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂使激活凝血时间维持200~250 s。术前及术后48 h停用二甲双胍,术后抗血小板聚集类药物、β受体阻滞剂、血管紧张素转换酶抑制剂、硝酸酯类药物等按指南及患者病情决定。所有患者的冠脉造影资料均由经验丰富的临床介入心脏病学专家分析,记录冠脉病变特点、造影剂种类、造影剂剂量及水化情况。
1.6 统计学分析采用 SPSS 26.0软件进行统计学分析,正态分布的计量资料以均数±标准差,组间比较应用t检验;非正态分布的计量资料用中位数(四分位数间距),组间比较用秩和检验;计数资料用例数及百分比(%)表示,组间比较检验方法为卡方(χ2)检验。以是否发生肾功能损害为因变量,患者基本信息(年龄、性别、既往病史、血脂、肝肾功能、造影剂及药物应用等)为自变量,OR值为效应指标,应用多因素logistic回归(后退法)分析探索PC-AKI发生的独立相关因素;ROC曲线计算造影剂剂量截断值。P<0.05为差异有统计学意义。
2 结果
2.1 患者的基线资料85例eGFR<90 ml/(min·1.73 m2)的AMI患者中,CKD2期24例,CKD3期49例,CKD3a期21例,CKD3b期28例,CKD4期12例。平均年龄69.19岁,男性患者比例较高,多合并高血压、多血管病变,应用碘克沙醇患者较多(表1)。

表1 研究对象的基线资料
2.2 PC-AKI的发生及血肌酐变化的统计学分析①所有患者基线eGFR平均为45.26(34.59~60.45)ml/(min·1.73m2),PC-AKI发生率为12.94%(11例);其中CKD2期占28.24%,基线eGFR为72.40(64.94~81.55) ml/(min·1.73m2),PC-AKI发生率为8.33%(2例);CKD3期占57.65%(CKD3a期24.71%,CKD3b期32.94%),基线 eGFR为40.58(35.18~47.71)ml/(min·1.73m2),PC-AKI发生率为16.33%(8例);CKD4期占14.12%,基线eGFR为27.04(21.85~28.03)ml/(min·1.73m2),PC-AKI发生率为8.33%(1例)。②单纯比较肌酐变化:与术前相比,肌酐绝对值在术后24 h、48 h及72 h三个时间段均逐渐升高,但与术前差异无统计学意义;肌酐倍数变化在术后72 h的P值为0.029,与术前差异有统计学意义;③依据肾损伤标准:总体PC-AKI发生率为12.94%,其中按照绝对值升高26.5 μmol/L标准发生率为9.41%,按照血肌酐升高1.5倍标准发生率为4.71%,前者发生率更高。按照绝对值升高26.5 μmol/L标准,术后24 h的PC-AKI发生情况无统计学意义(P<0.05);按照血肌酐升高1.5倍标准,术后三个时间段差异均有统计学意义(P<0.05),(表2)。
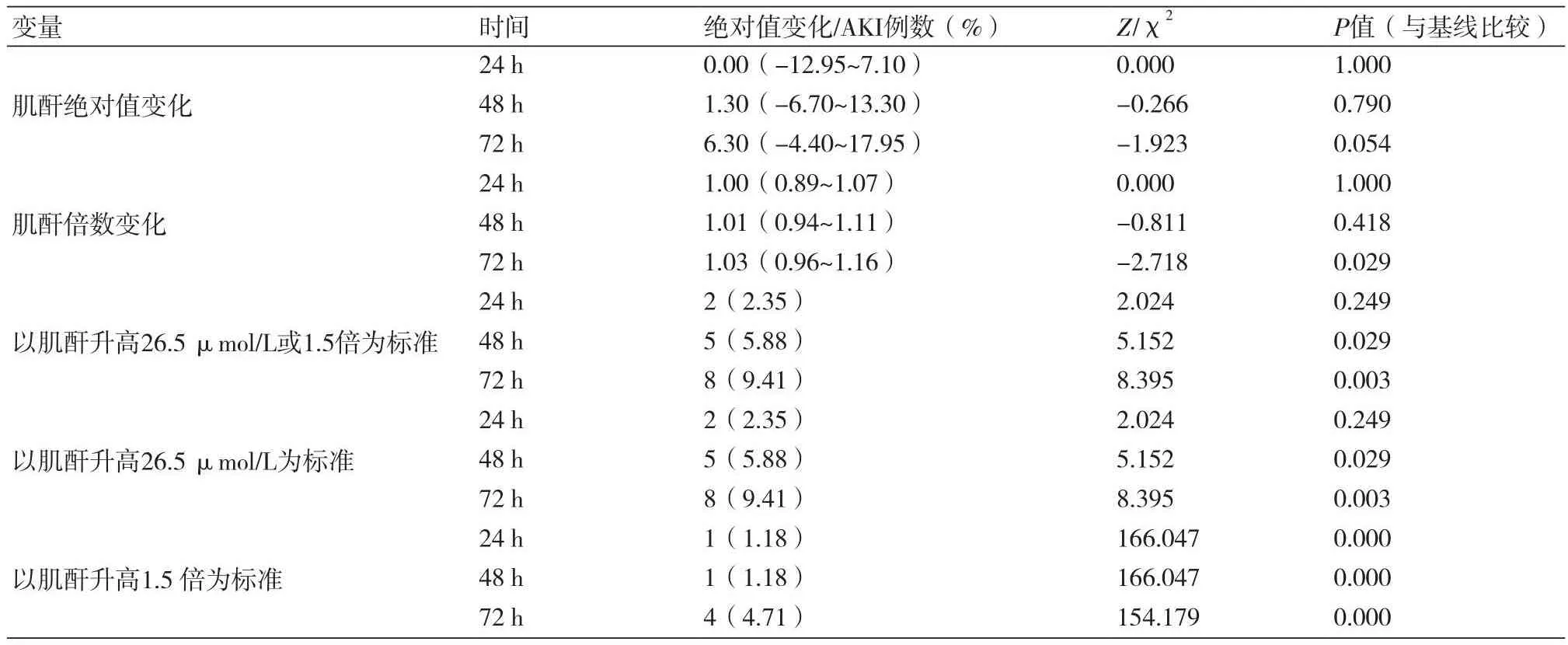
表2 研究对象的基线资料
2.3 PC-AKI发生的独立相关因素将患者基本资料纳入多因素logistic回归分析:①按照肌酐升高1.5倍或者26.5 μmol/L的诊断标准,PC-AKI与造影剂剂量(OR=1.020,95%CI:1.003~1.036)和糖化血红蛋白水平(OR=1.619,95%CI:1.004~2.611)均独立相关(P<0.05);②按照血肌酐绝对值升高26.5 μmol/L为标准,结论与①一致。③按照血肌酐升高1.5倍的诊断标准,PC-AKI仅与造影剂剂量(OR=1.013,95%CI:1.000~1.026)独立相关(P=0.055),P<0.10为差异有统计学意义(表3)。

表3 三种不同诊断标准下多因素Logistics回归分析影响PC-AKI发生的潜在因素
2.4 ROC曲线分析造影剂剂量是PC-AKI发生的独立因素,可预测:造影剂剂量与PC-AKI发生的AUC为0.725(95%CI:0.551~0.898,P<0.05),其截断值为155 ml,敏感性为63.64%,特异性为71.62%。具体见表4和图1。

图1 ROC曲线分析在不同的诊断标准下造影剂剂量对PC-AKI的预测价值
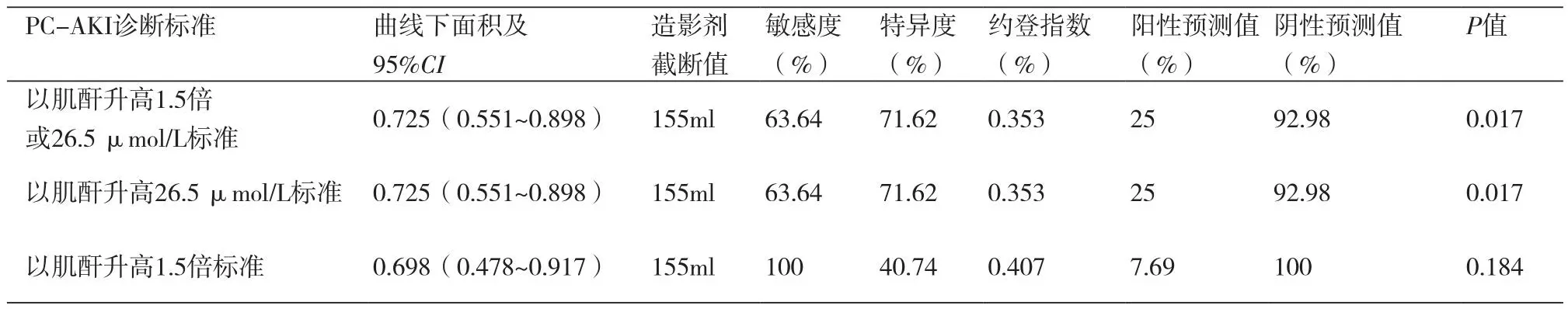
表4 造影剂剂量截断值的ROC曲线分析
3 讨论
积极PCI治疗是降低AMI患者不良事件及死亡率的最有效措施。然而,相当一部分合并CKD的AMI患者,因顾虑肾功恶化未接受及时PCI治疗错失了最佳救治时机,使其院内和远期预后变差。寻找合并CKD的AMI患者肾损伤相关因素,精准的获益及风险评估并预防性治疗尤为重要。本研究入组eGFR<90 ml/(min·1.73 m2)的AMI患者,观察术后72 h各点血肌酐变化发现:冠脉造影及PCI术后总体PC-AKI发生率为12.94%(满足血肌酐变化1.5倍或数值升高26.5 μmol/L其一即做出诊断),其中血肌酐升高26.5 μmol/L标准的敏感性较高,按照该标准肾损伤发生比例较按照肌酐变化1.5倍的标准高;肾功能变化主要与造影剂剂量相关,其高于155 ml肾损伤发生风险增加。
本研究中,冠脉造影和PCI在术后72 h的PCAKI发生率最高,与慢性冠心病患者PCI-AKI有类似趋势(术后24 h发生肾损伤比例为0.3%[4],此后随时间逐渐升高,肾损伤峰值在48~72 h[5])。在肾损伤评估中,血肌酐绝对值升高较倍数对肾损伤预测具有更高的敏感性,其标准肾损伤发生率更高。与既往研究中提出的造影剂相关性肾损伤发生可仅通过血肌酐绝对值升高来评估[6]相一致,因为倍数增加的同时也增加了绝对值。
冠脉造影和PCI过程中含碘造影剂通过直接损伤肾小管、增强氧化应激、细胞内蛋白变性和核酸损害等作用导致肾损伤发生[7,8]。造影剂通过产生活性氧、激活线粒体及细胞凋亡对肾小管上皮细胞和血管内皮细胞发挥细胞毒作用[6,9],诱导血管调节剂(如内皮素、腺苷和一氧化氮)改变引起短暂血管舒张,随后持续数小时血管收缩,细胞毒性和缺血性肾小管细胞损伤诱导肾小球反馈,增强入球小动脉收缩,降低肾血流量和eGFR,导致肾实质缺氧[10-12]。同时造影剂的高渗透压和粘性导致渗透性利尿、肾小管压力增加、血液流速降低,引起肾小管氧供需失衡[11],最终导致肾损伤发生。
CKD患者肾脏代偿能力弱,大剂量造影剂应用增加肾损伤风险,代偿失调导致肾损害及进展。有研究提出将MACD最大允许造影剂量(MACD=5×体重/血清肌酐)方程中因子 K(定义为造影剂体积×血清肌酐/体重)最佳截止值设置为2.5作为PC-AKI的独立危险因素[11],造影剂/GFR比率≥2.13与造影剂肾病独立相关[6]。本研究发现,合并CKD的AMI患者中急性肾损伤发生与造影剂剂量独立相关,高于155 ml时PC-AKI风险明显增加。截断值的提出对于肾损伤高风险人群评估及预防具有重要意义。
其他与PC-AKI相关的因素,本研究发现Gensini积分和糖化血红蛋白还可能与PC-AKI相关;本研究尚未发现年龄[13]、性别、造影剂种类[14]、身高体重指数、合并疾病(高血压、糖尿病、贫血、低蛋白血症[12,15,16])、抗血小板药物[17]等与PC-AKI有关。有关空腹血糖与造影剂肾病独立相关,糖化血红蛋白≥8.8%风险更高[18-20]的观点,本研究在以血肌酐升高26.5 μmol/L为标准的回归分析中得出糖化血红蛋白与肾损伤相关,但1.5倍标准未得出统一结论,由于肌酐绝对值标准对肾损伤评估敏感性更高,需大样本进一步探讨血糖与合并CKD的AMI患者造影剂肾损伤相关性。eGFR是肾功能的评估指标,代表基础肾功能及代偿能力,数值越低,肾损害发生及进展风险越高,研究发现ST 段抬高型心肌梗死(STEMI)患者PC-AKI的发生与eGFR密切相关[12],本研究主要观察合并CKD的AMI患者PC-AKI发生的相关因素,由于CKD的慢性存在、AMI的急性事件及PC-AKI的短期发生,并未观察到eGFR对PC-AKI发生的预测价值。
eGFR降低的AMI患者PCI术后72 h的PC-AKI发生率最高,总体发生率为12.94%。肾功能变化主要与造影剂剂量相关,当其高于155 ml时术后肾损伤风险较高。
