胆固醇对内蒙古绒山羊精子冷冻保存的影响
2023-09-07栗瑞兰李博渊徐冰冰王瑞军李金泉张家新
白 雪,栗瑞兰,张 健,李博渊,徐冰冰,王瑞军,李金泉,张家新*
(1.内蒙古自治区羊遗传育种与繁殖重点实验室/内蒙古农业大学 动物科学学院,呼和浩特 010018;2.山西大同大学 医学院,山西 大同 037000)
冻精的使用能够为人工授精提供充足的精液来源,提高种公羊的利用效率。但在精子冷冻保存过程中,由于精子频繁地暴露在冷冻应激中,使其结构和功能受到损伤[1],质膜中脂质和蛋白质发生重组、DNA断裂、线粒体功能受损[2-3]。部分存活精子也会经历获能样变化(冷冻获能)、胆固醇外流、Ca2+内流激活酪氨酸磷酸化通路,降低精子受精能力[4]。
有研究表明,质膜损伤被认为是细胞死亡的主要原因之一[5]。在冷冻保存过程中膜流动性和稳定性是精子免受冷冻损伤的主要决定因素[6]。相关研究发现人类和兔精子中质膜胆固醇/磷脂比值较高(0.99和0.88),精子抵抗冷应激的能力较强;大鼠(0.55)、牛(0.45)、绵羊(0.37)、猪(0.35)、山羊(0.59)的精子中膜胆固醇/磷脂比值较低,这些动物精子抵抗冷应激的能力较弱[7]。因此,胆固醇在精子冷冻保存中起到重要作用。
胆固醇作为细胞质膜组成成分,对维持精子膜完整性具有重要作用。胆固醇外流改变了精子膜结构并增强了流动性,使许多蛋白质、离子通道和酶的功能发生变化,导致冷冻解冻精子产生类似获能的状态[8]。这种现象可通过用外源性胆固醇或胆固醇类似物处理冷冻前精子来抑制获能样改变和自发性顶体反应[9]。环糊精是一种外表面亲水、内核疏水的环状寡糖,对胆固醇有很强的亲和力,可以作为胆固醇的载体转移到细胞膜[10]。胆固醇-环糊精(CLC)是一种非渗透的冷冻保护剂,能够通过外源添加提高提高精子膜中的胆固醇/磷脂比[11]。据报道,在牛、绵羊、兔、山羊、马和猪的精子冷冻保存中,CLC预处理可以提高冷冻解冻后精子活力[12-17],但其具体的调控机制仍不清楚。因此,本研究比较了不同浓度胆固醇-环糊精预处理后对内蒙古绒山羊精液的冷冻保存效果,在此基础上进一步分析了精子内Ca2+水平和酪氨酸磷酸化变化情况,为阐明绒山羊精子抗冻机制及提高绒山羊精液冷冻保存效果提供理论依据。
1 材料与方法
1.1 试验试剂和仪器
Tris、柠檬酸水合物、葡萄糖、乳酸和甘油,购自Sigma-Aldrich公司;青霉素-链霉素,购自GibcoTM公司;SOF液(NaCl 107.7 mmoL/L,KCl 7.16 mmoL/L,CaCl 21.71 mmoL/L,NaHCO325.07 mmoL/L,KH2PO41.19 mmoL/L,MgSO40.49 mmoL/L,Na Pyruvate 0.33 mmoL/L,Na Lactate 3.30 mmoL/L,Phenol-Red 1%,PS 1%,所需试剂均购自Sigma-Aldrich公司;Annexin V-FITC/PI细胞凋亡双染试剂盒,购自BD Pharmingen公司;精子顶体形态花生凝集素荧光标记(PNA-FITC)染色试剂盒,购自上海哈灵生物技术公司;Fluo3-AM(钙离子荧光探针)、Western及IP细胞裂解液、PMSF和BCA蛋白浓度测定试剂盒,购自碧云天生物技术公司;10-壬基溴代吖啶橙,购自索莱宝科技有限公司;磷酸酶抑制剂,购自贝博生物科技有限公司;TCG(Tris 300 mmol/L,葡萄糖 56 mmol/L,柠檬酸 95 mmol/L;1%双抗)。
计算机辅助精子分析系统(型号为IVOS Ⅱ,CASAS),购自IMV Technologies公司;流式细胞检测仪(NovoCyte2040R),购自ACEA NovoCyteTM公司;酶标仪(Synergy HT)、凝胶成像仪(ChemiDoc XPC),购自Bio-Rad 公司;IMV密度仪,购自IMV Technologies公司。
以上试剂和仪器均来源于内蒙古自治区羊遗传育种与繁殖重点实验室(农业农村部肉羊遗传育种重点实验室)。
1.2 试验动物
试验羊选用内蒙古金莱牧业有限公司的6只具有正常繁殖功能、1.5~2.0岁的内蒙古绒山羊种公羊,饲养管理条件一致。
1.3 试验步骤
1.3.1 精液采集及稀释
采用假阴道法采集精液,取2 μL精液,与TGG室温混合后取4 μL,于精子分析仪专用载玻片上,利用计算机辅助精子分析系统检测精子活力,选择射精量在1.5~2.0 mL、精子密度在30×109/mL以上、精子活力大于75%的精液在室温下混合后使用,以消除个体差异。根据V.M.Salmon等[18]的方法配制不同浓度(0,1,2,3,4 mg/mL)的CLC,以零添加CLC组为对照组。在37 ℃条件下将混合后的精液与不同浓度CLC按1∶2.5(精液∶CLC)比例进行稀释并孵育15 min。随后将预处理的精液与基础冷冻稀释液(TCG+卵黄+甘油)进行混合。
1.3.2 精液冷冻
将稀释后的精液置于30 ℃的水浴中,然后在4 ℃冰箱中缓慢降温,1.5 h后水浴温度降至4 ℃,灌装于0.25 mL冷冻细管中,封管。将封装后的冷冻细管置于4 ℃冰箱平衡30 min,然后在距离液氮液面4 cm处熏蒸10 min,投入液氮中冷冻。冷冻保存的精液于3 d后解冻,解冻时将冻精细管置于38 ℃水温中解冻30 s。
1.3.3 运动参数检测
冷冻解冻后的精液,利用计算机辅助精子分析系统检测至少5个视野,检测系统至少捕捉 1 000 个精子细胞。
1.3.4 精子结构完整性检测
精液解冻后,加入1 mL磷酸盐缓冲溶液(PBS)洗涤,1 350 g/min离心5 min,弃去上清液。用PBS稀释调整浓度为1.2×107/mL,加入PI/PNA-FITC进行精子顶体染色,用流式细胞检测仪检测精子顶体的完整性;用Annaxin V-FITC/PI细胞凋亡双染试剂盒检测精子质膜的完整性,方法同上。用PI/PNA-FITC染色后统计Q2(PI--PNA-),作为具有完整顶体的活精子比例;再用Annaxin V-FITC/PI染色后统计Q2(PI--Annexin V-)作为完整质膜的活精子比例。在上述浓度下,加入吖啶橙染液,用流式细胞检测仪检测精子DNA的完整性,统计绿色荧光精子。
1.3.5 精子Ca2+水平检测
检测精子细胞中游离Ca2+浓度,洗涤后的精子加入PBS悬浮液,调整浓度为1.0×107/mL,加入5 μmol/L Fluo3-AM,37 ℃、5% CO2培养箱避光孵育60 min,离心,弃去上清液后加入PBS悬浮液,继续孵育30 min,之后洗涤2次,用流式细胞检测仪检测荧光强度。剩余部分通过PI染色后在荧光显微镜下观察Ca2+分布情况。
1.3.6 鲜精获能处理
新鲜精液用获能液(SOF 液+2%山羊血清+6 IU/mL 肝素钠)在 38 ℃、5% CO2条件下孵育 30 min,之后吸取上游精液,1 350 r/min离心3 min。
1.3.7 Western blot
将获能处理的鲜精、冷冻解冻后的对照(LCL零添加)组和2 mg/mL CLC组精子分别用PBS洗涤,调整精子浓度为1.2×107/mL,加入300 μL Western及IP细胞裂解液、PMSF和磷酸酶抑制剂进行总蛋白提取,将细胞悬浮液进行超声波裂解,之后10 000 r/min、4 ℃离心15 min,吸取上清液为总蛋白。使用BCA蛋白浓度测定试剂盒进行总蛋白浓度测定。将待使用蛋白质加入SDS-PAGE loading buffer(5×)中用开水煮沸10 min变性,-20 ℃保存,待用。变性后的蛋白样品经过12%的SDS-PAGE电泳分离,每个泳道上样20 μL,总质量40 μg,待电泳结束后使用半干转膜系统进行转膜,转至PVDF膜(PALL)。将转印有蛋白的PVDF膜在3%脱脂奶粉中室温封闭2 h,再分别使用鼠源P-Tyrosime(cell signal,1∶2 000)4 ℃孵育过夜。用PBST洗膜3次,每次10 min,室温分别孵育带有HRP标签的山羊抗鼠二抗(博奥森,1∶1 000),37 ℃孵育2 h,再用PBST洗膜3次,每次10 min。最后使用ECL曝光,凝胶成像仪扫描。利用ImageJ软件对蛋白条带进行灰度值分析。
1.4 数据的统计分析
采用SAS 9.0软件对试验数据进行单因素方差分析(ANOVA),P>0.05为差异不显著,P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1 CLC对解冻后内蒙古绒山羊精子质量的影响
精子冷冻前用不同浓度的CLC处理,解冻后精子活力见图1A,精子结构完整性结果见图1B、图1C、图1D。由图1可以看出:与对照组相比,各试验组解冻后精子活力、质膜与顶体完整率显著升高(P<0.05),精子DNA完整率极显著升高(P<0.01)。
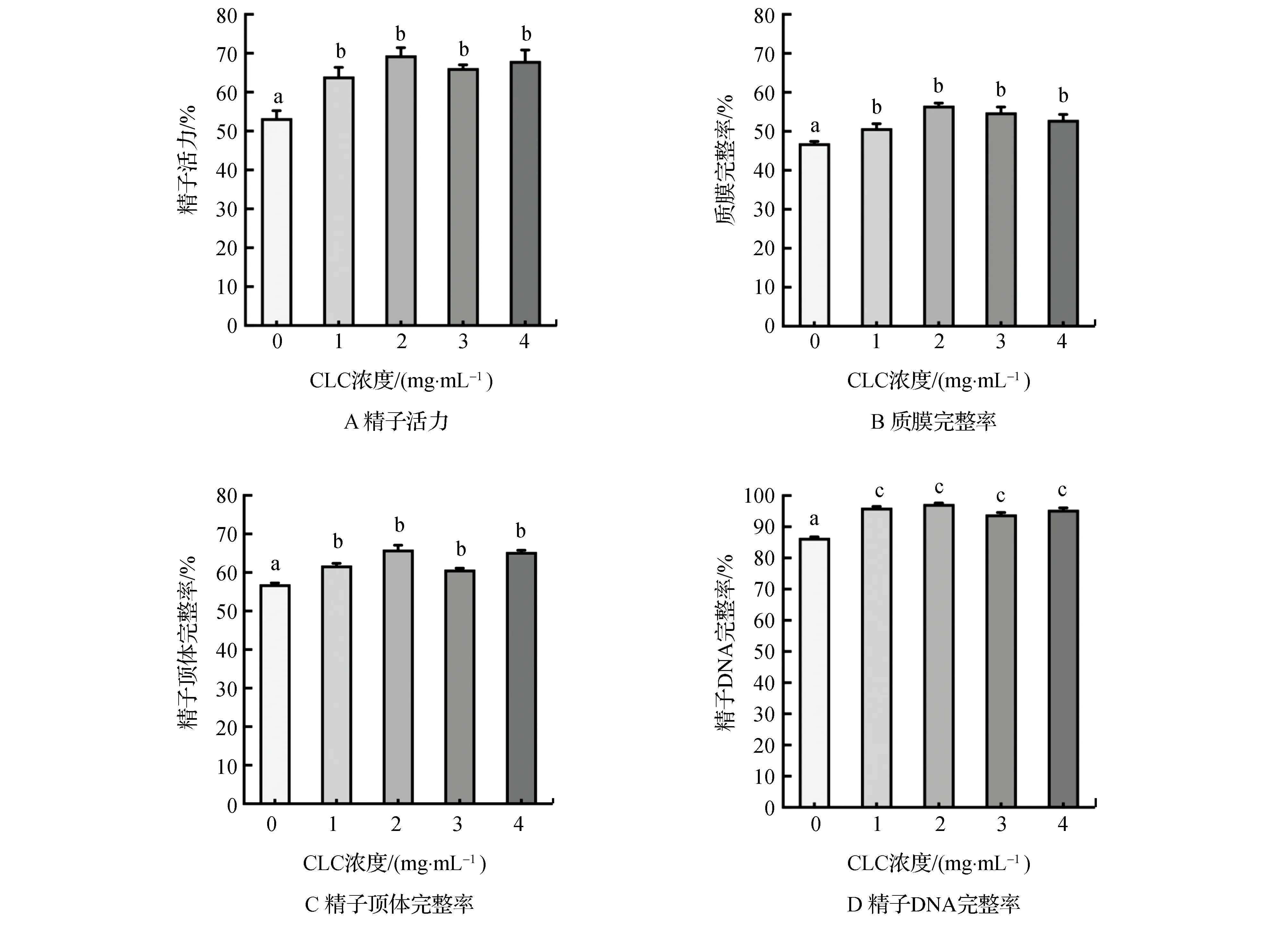
注:柱标字母相间表示差异极显著(P<0.01),相邻表示差异显著(P<0.05),相同表示差异不显著(P>0.05)。
2.2 CLC对精子Ca2+水平的影响
内蒙古绒山羊精液冷冻解冻后精子细胞中游离Ca2+水平见图2。由图2可以看出,2 mg/mL CLC组的精子Ca2+水平极显著低于对照组(P<0.01),1,3,4 mg/mL CLC组显著低于对照组(P<0.05)。
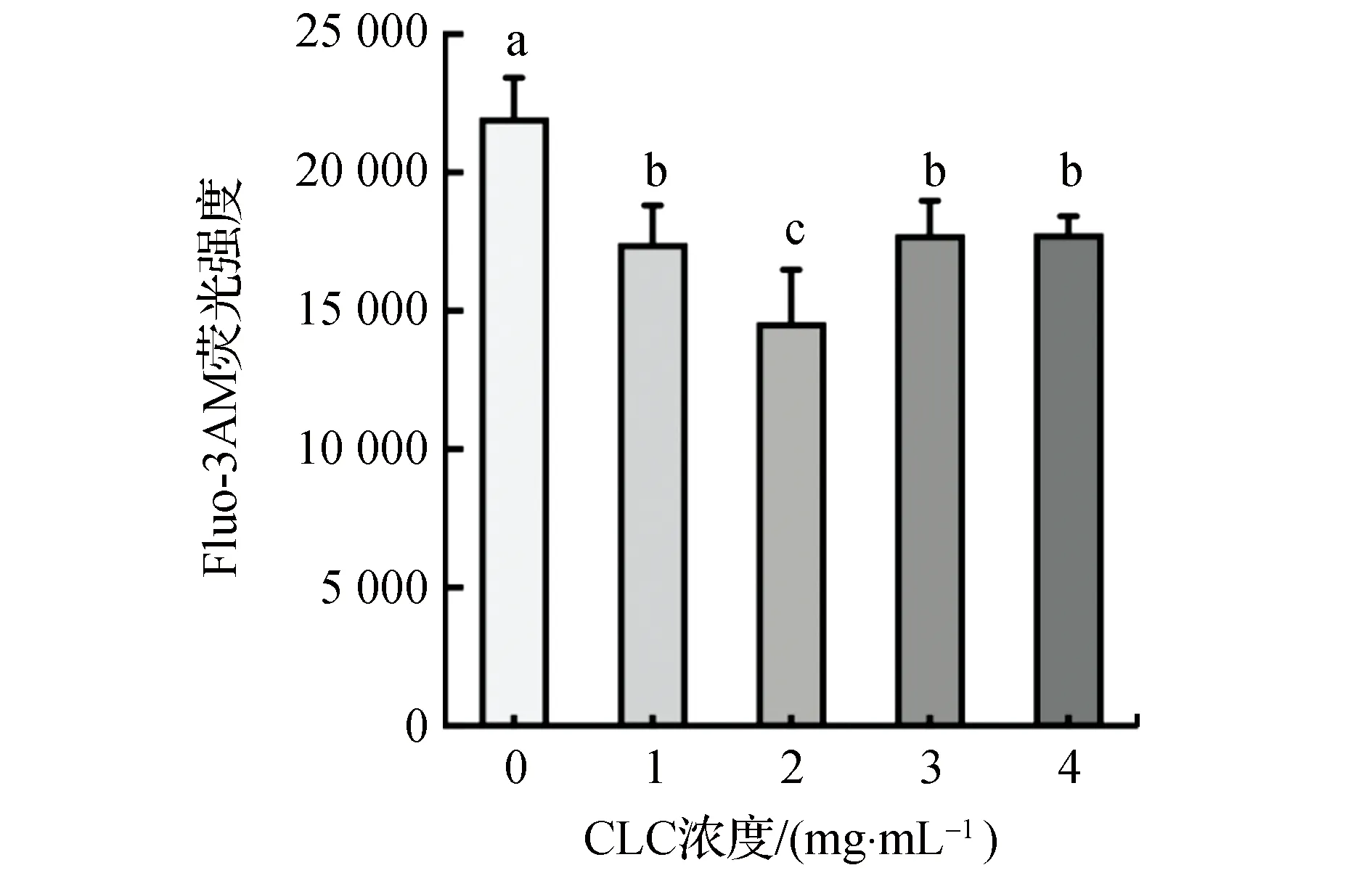
注:柱标字母相间表示差异极显著(P<0.01),相邻表示差异显著(P<0.05),相同表示差异不显著(P>0.05)。
2.3 CLC对精子蛋白酪氨酸磷酸的影响
Western blot分析结果见图3。由图3可以看出:鲜精获能后精子的30,37,40,70 kD蛋白发生了酪氨酸磷酸化,但冷冻解冻后的精子在30,37,40 kD蛋白处发生了酪氨酸磷酸化,精子冷冻前用2 mg/mL的CLC处理后,与对照(CLC零添加)组相比,30,37,40 kD蛋白酪氨酸磷酸化明显下降,但两个冷冻组均未在70 kD蛋白处发生酪氨酸磷酸化。
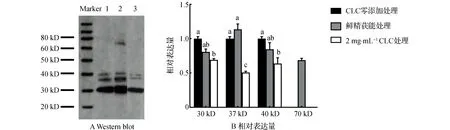
注:A图中1,2,3分别代表CLC零添加、鲜精获能和2 mg·mL-1 CLC处理;B图中柱标字母相间表示差异极显著(P<0.01),相邻表示差异显著(P<0.05),含相同字母表示差异不显著(P>0.05)。
3 讨 论
精子对冷冻保存过程所引发的冷冻损伤极其敏感,这种敏感性与细胞膜的脂质组成密切相关,特别是冷冻解冻过程所引起的精子膜脂质的相变和聚集,质膜中脂质-脂质和脂质-蛋白间相互作用的改变[19]。精子质膜中胆固醇/磷脂含量比与精子冷冻耐受性相关,胆固醇能够使精子质膜在低温条件下的流动性增加,降低精子对冷应激的敏感性[20]。在本试验中,冷冻前用CLC处理内蒙古绒山羊精子,与对照组相比,冷冻解冻后精子活力、DNA完整性、具有完整质膜和顶体的活精子比例显著或极显著升高。在绵羊、山羊和牛精子的冷冻保存中也都发现CLC预处理能够提高精子解冻后活力和结构完整性[21-22]。但是胆固醇在精子冷冻保存过程中的具体调控机制仍需要进一步阐明。
蛋白酪氨酸磷酸化是调节精子获能最重要的细胞内信号事件之一。cAMP/PKA和细胞外信号调节激酶是蛋白酪氨酸磷酸化的重要信号通路。在精子获能过程中,细胞内Ca2+浓度的增加激活了可溶性腺苷酸环化酶,进而触发了cAMP/PKA下游通路,导致精子发生酪氨酸磷酸化[23-25]。精子冷冻保存过程也会导致精子提前获能。有报道表明,牛和猪精子冷冻解冻后发生的获能变化主要表现为酪氨酸磷酸化水平显著提升[26-27]。但冷冻保存后的精子与正常获能精子发生的蛋白酪氨酸磷酸化存在差异,因此冷冻造成的精子提前获能不是真正意义上的获能[28-29]。在本研究中,内蒙古绒山羊新鲜精液经获能处理后,在30,37,40,70 kD位点的4种蛋白发生酪氨酸磷酸化,其中37,40 kD位点的酪氨酸磷酸化与猪精子和马鹿精子诱导获能后发生的酪氨酸磷酸化一致[30]。但是,冷冻保存后的精子蛋白酪氨酸磷酸化主要发生在30,37,40 kD蛋白,这也说明冷冻保存只引起精子的部分获能样变化。在本试验中,内蒙古绒山羊精子经CLC预处理后再进行冷冻保存,结果发现30,37,40 kD蛋白酪氨酸磷酸化都发生明显降低,表明胆固醇预处理内蒙古绒山羊精子可降低精子冷冻保存所引起的“获能”样变化。另外,本试验中2 mg/mL CLC预处理后,冷冻解冻的精子细胞中游离Ca2+水平显著降低,这可能是由于CLC预处理后,降低了精子在冷冻保存过程中的膜通透性,进而抑制冷冻诱导的精子细胞Ca2+内流、并导致精子蛋白酪氨酸磷酸化水平的显著下降。M.L.M.Carro等[31]的研究也证明,绵羊精子经过胆固醇前体物链甾醇预处理后,解冻后保持了较低的酪氨酸磷酸化水平。
4 结 论
冷冻前利用适量浓度 CLC预处理内蒙古绒山羊精液,能够提高精子在冷冻保存过程中的膜结构稳定性,减少Ca2+内流,降低精子蛋白酪氨酸磷酸化水平,进而提高绒山羊精子冷冻保存效果。
