鸡IHH基因生物信息学及组织特异性表达分析
2023-09-07金四华贾羽晴夏晶晶贾富民耿照玉
金四华 税 斐 徐 媛 贾羽晴 夏晶晶 王 鑫 贾富民 耿照玉
(安徽农业大学 动物科技学院, 合肥 230036)
伴随着家禽业的快速发展,家禽养殖密度不断提高,腿部疾病问题日益突出,严重影响家禽生产性能和养殖效益。家禽的股骨、胫骨和跖骨等均由软骨内成骨形成[1]。鸡骨骼发育涉及Notch、刺猬(Hedgehog, HH)和骨形态发生蛋白(Bone morphogenetic protein, BMP)等信号通路[2],其中,以印度刺猬因子(Indian hedgehog,IHH)基因为代表的HH信号通路,在人[3]、小鼠[4]、牦牛[5]和鸡[6]等物种的骨骼发育、疾病与生产性能中发挥很大作用,近年来受到广泛关注。
IHH作为HH家族一员[7],主要在软骨组织中表达,是骨骼发育的中枢调控因子,影响软骨的生长分化和成骨形成等过程,对胚胎和出生后机体骨骼发育均具有重要的调控作用[8-13]。St-Jacques等[4]通过靶向替换IHH的第一个外显子和1 kb序列,使其产生一个等位基因,进而导致小鼠骨骼极度缩短,关节融合,最终导致早期死亡。Yang等[3]通过全外显子组测序发现,IHH基因c.299A>G位点突变导致人类短指A1型综合征(BDA-1)。本课题组前期研究发现,IHH基因突变是造成鸡匍匐性状的关键因素[14],IHH缺失导致鸡匍匐表型[6],匍匐型鸡杂合子软骨细胞成熟延迟,提示IHH丢失可导致鸡软骨营养不良[15]。此外,在鸡胫骨软骨发育不良[16]和细菌性软骨坏死伴骨髓炎[17]等骨骼相关疾病研究中,均发现IHH是影响鸡软骨发育的关键基因[18],该基因的表达失调是造成骨骼疾病的关键因素。综上可知,IHH是影响鸡软骨发育的重要基因。
目前,关于IHH基因的研究多集中在啮齿类动物,而鸡IHH基因的生物信息学及其在不同组织中的表达规律研究较少。因此,本研究借助现代生物信息学技术分析IHH基因开放阅读框、内切酶、启动子和CpG岛,比较多物种IHH蛋白氨基酸相似性,解析物种间遗传距离,并分析鸡IHH蛋白理化性质、亚细胞定位和蛋白结构等生物信息特征。另外,采集心、肝、脾、肺、肾、软骨、下丘脑、胸肌、十二指肠和胸腺组织,并比较不同组织的差异表达规律,该研究结果将为进一步研究鸡IHH基因功能奠定了基础,并为深入解析鸡骨骼发育潜在分子机制提供重要参考。
1 材料与方法
1.1 试验材料
1.1.1试验动物及样品采集
本研究材料由安徽省淮南麻黄鸡省级保种场提供。从淮南麻黄鸡省级保种场随机选取体重相近且健康强健的1日龄公鸡6只,采集心、肝、脾、肺、肾、软骨、下丘脑、胸肌、十二指肠和胸腺共10个组织,放入加有RNA保存液的2 mL离心管,4 ℃过夜后置于-80 ℃保存。
1.1.2主要试剂和仪器
Hifair®II 1 st Strand cDNA Synthesis SuperMix for qPCR、Hieff®qPCR SYBR Green Master Mix均购自翌圣生物科技(上海)有限公司;引物合成和测序工作均由南京擎科生物科技有限公司完成。
1.2 生物信息学分析
从NCBI数据库下载鸡IHH基因mRNA序列(NM_204957.3),利用在线软件分析下载的鸡IHH基因序列,预测其开放阅读框大小、基因结构和内切酶等。同时,利用BDGP在线软件预测鸡IHH基因5′端转录起始位点上游2 000 bp区间核心启动子,采用Cpgplot在线分析基因CpG岛。
利用NCBI数据库中9种动物IHH蛋白氨基酸序列(表1),借助MegAlign和ClustalX 1.81软件对获得的氨基酸序列进行相似性分析。

表1 鸡IHH蛋白氨基酸序列大小及参考序列Table 1 Amino acid sequence size of chicken IHH protein and reference sequence
通过在线软件预测鸡IHH蛋白的疏水性、理化特性和蛋白结构等生物信息。上述生物信息在线分析软件网址见表2。
1.3 总RNA提取及反转录
Trizol法提取总RNA并检测RNA完整性。借助NanoDrop 2 000分光光度计(ThermoFisher Scientific,美国)检测RNA浓度,通过OD值比值判断RNA纯度,其中OD260/OD280为1.8~2.1,OD260/OD230比值应大于2,1%琼脂糖凝胶电泳检测RNA样品完整性。
以总RNA为模板,按照Hifair®II 1 st Strand cDNA Synthesis SuperMix for qPCR(翌圣生物科技(上海)有限公司)合成cDNA第1链,具体过程如下:1)去除DNA污染:体系10 μL,包括5×gDNA digester Buffer 2 μL,gDNA digester 1 μL,Total RNA 1 μg,RNase-free ddH2O补足,反应体系在42 ℃孵育2 min;2)逆转录反应体系及程序:在上述体系中再加入2×Hifair®II SuperMix Plus 10 μL,混匀后25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,温度降至4 ℃,终止反应,产物置于-20 ℃保存待用。
1.4 鸡各组织IHH mRNA的相对表达分析
从NCBI数据库中下载IHH(登录号:NM_204957.3)和内参基因GAPDH(登录号:NM_204305.2)的mRNA序列,利用Primer Premier 5.0软件设计引物(表3)用于实时荧光定量PCR(Quantitative real-time PCR, qRT-PCR)检测。qRT-PCR体系10 μL,Hieff®qPCR SYBR Green Master Mix 5.0 μL,上下游引物各0.2 μL,模板DNA 1.0 μg,补水至10.0 μL。扩增程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。每组试验3个重复,每组用RNase-free ddH2O代替模板作阴性对照。1.5%琼脂糖凝胶电泳检测反转录质量。

表3 qRT-PCR引物序列Table 3 Primer sequences for quantitative real-time PCR
1.5 统计与分析
利用Excel 2019对试验数据进行预处理,根据目的基因和内参基因Ct值,采用2-ΔΔCt法[19]计算目的基因的相对表达量。采用SPSS 22.0(IBM, Armonk, NY, USA)软件中One-way ANOVA程序进行差异显著性检验,Duncan法进行不同组织间差异表达分析。试验数据以平均数±标准差表示,P<0.05表示差异显著。
2 结果与分析
2.1 鸡IHH基因结构分析和内切酶分析
开放阅读框(Open reading frame,ORF)分析表明,阅读框大小为1 227 bp,可编码408个氨基酸。经FGENESH程序分析,该基因有3个外显子,分别位于397~699 bp、4 366~4 627 bp和7 003~7 664 bp(图1),NEBcutter软件分析IHH基因内切酶位点,可见该基因存在多个酶切位点(图2),其中有十多个酶切位点受CpG甲基化的影响,为后续进一步研究基因多态性位点奠定基础。
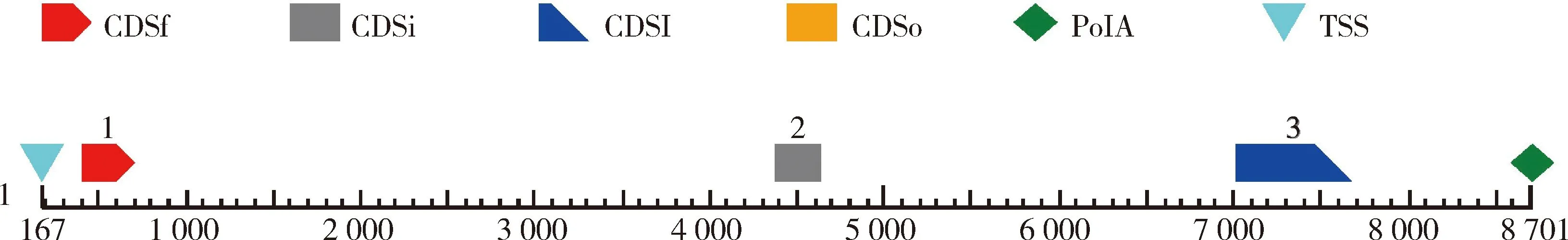
CDSf:起始外显子;CDSi:中间外显子;CDSl:末端外显子;CDSo:唯一外显子;PolA:末端polyA尾区;TSS:转录起始位点。CDSf: First-starting with start codon; CDSi: Internal exon; CDSl: Last coding segment; CDSo: Only exon; PolA: Last polyA; TSS: Transcription start site.图1 鸡IHH基因结构分析Fig.1 Analysis of IHH gene structure in chicken
2.2 鸡IHH基因启动子CpG岛分析
启动子是调控基因表达的重要因素。使用BDGP软件预测鸡IHH基因5′端转录起始位点上游2 000 bp区间核心启动子(表4),可见存在4个核心启动子区,经Cpgplot分析,预测该2 000 bp区间内GC含量高(>50%),存在1个CpG岛(1 666~1 944 bp)(图3)。
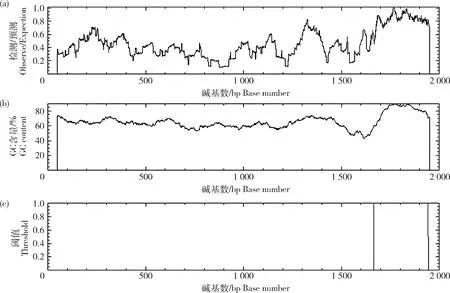
(a) CpG的出现率(观测值/期望值);(b) GC含量百分比;(c)阈值,图中两竖线分别位于CpG岛的起始和终止位置。(a) The occurrence rate of CpG dinucleotides (Observed/Expected); (b) GC content percentage; (c)Threshold.In the figure, the two vertical lines are located at the starting and ending positions of the CpG island, respectively.图3 IHH基因启动子区域CpG岛预测Fig.3 CpG island prediction of IHH gene promoter region

表4 鸡IHH基因启动子预测Table 4 Chicken IHH gene promoter prediction
2.3 IHH基因在不同组织中差异表达分析
qRT-PCR检测IHH基因在不同组织中的表达情况,IHH基因和GAPDH基因的扩增曲线具有明显的指数增长期,融解曲线均为单一主峰,排除引物二聚体和非特异性扩增对荧光定量结果的影响,说明设计的引物特异性较好,PCR反应条件合适。qRT-PCR分析表明(图4),IHHmRNA在采集的所有组织中均有表达,在软骨组织中的表达量最高,与其他组织差异显著(P<0.05),其次为十二指肠、肺和肝脏,在胸肌中的表达量最低。

不同小写字母表示差异显著(P<0.05)。The difference between the lowercase letters showed significant difference (P<0.05).图4 IHH在鸡各组织中mRNA表达量Fig.4 IHH mRNA expression in different chicken tissues
2.4 鸡IHH氨基酸相似性分析
相似性分析表明,鸡IHH氨基酸序列与环颈雉、鸭和黑天鹅的相似性较高,均在95%以上,与其他物种相似性较低,在76.4%~78.4%。氨基酸遗传距离分析显示,禽类(环颈雉、鸭和黑天鹅)与人、小鼠、猪、长臂猿和骆驼等的遗传距离介于0.010~0.276,禽类中鸭与黑天鹅的遗传距离最短为0.010 7。鸡与其他禽类的遗传距离在0.017~0.040,与人、鼠和猪等哺乳类动物的遗传距离介于0.238~0.270。NJ分析结果表明,哺乳动物和禽类形成了明显的2个分枝,结合相似性和遗传距离的分析可知,IHH基因在禽类中具有较高的保守性(图5)。
面对静宁县农村饮水困难问题突出、供水工程建设任务繁重的形势,要积极谋划,发挥公共财政对水利的主导作用,在争取公共财政投资和金融支持建设主体工程的同时,多渠道筹集资金,鼓励农民自愿投资投劳建设供水入户工程,吸引社会资金投入提高供水入户标准。建立以公共财政投入和金融支持、农民投资投劳、社会资本参与为主要支撑的农村供水工程投资稳定增长机制。力争到“十三五”末彻底解决静宁县农村供水问题,全面提升饮水安全标准,为改善民生、促进经济社会又好又快发展奠定基础。
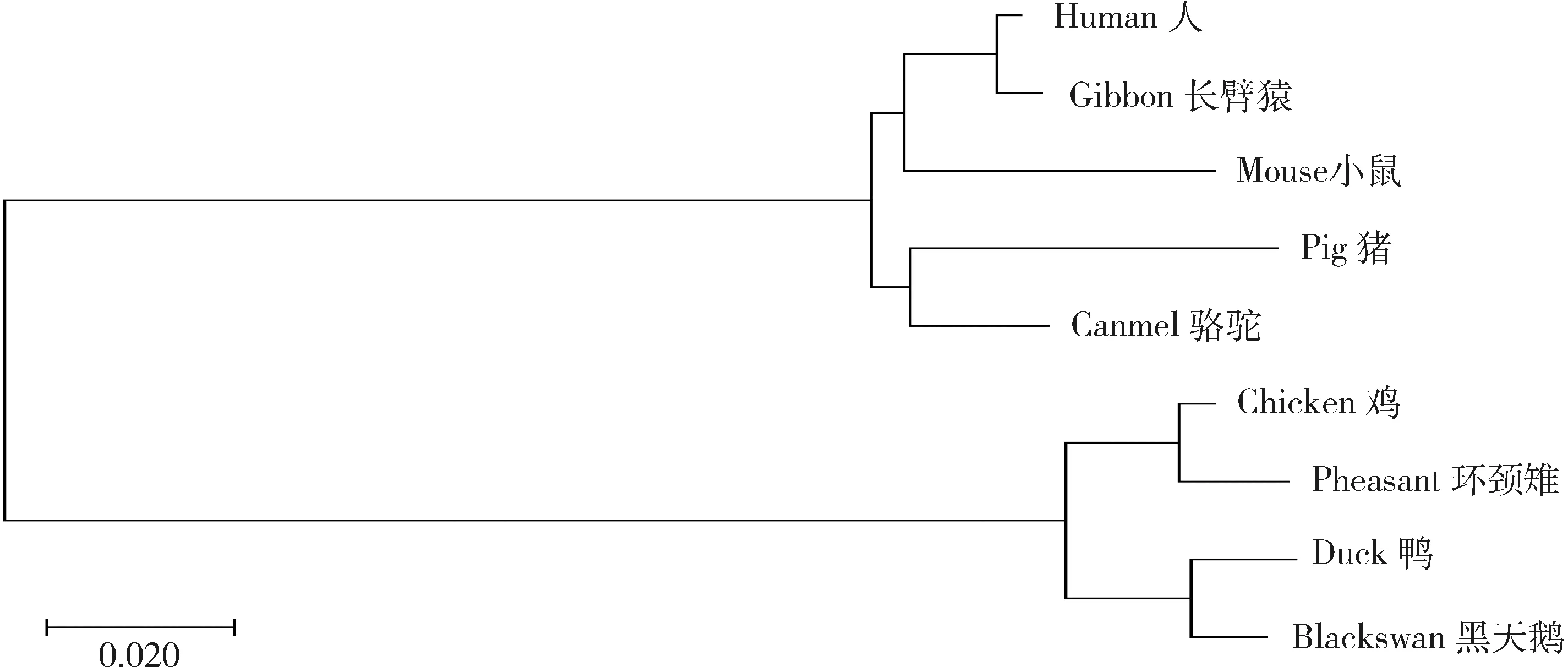
图5 9个物种IHH氨基酸序列构建NJ树Fig.5 IHH amino acid sequences of 9 species constructed the NJ trees
2.5 鸡IHH蛋白基本理化性质分析
IHH蛋白大小为44.829 36 ku,理论等电点为9.38;相对分子质量为44 778,分子式为C1998H3142N586O563S14。在组成IHH蛋白的20种氨基酸里,亮氨酸(Leu)的占比最高(11.5%),色氨酸(Trp)的占比最低(1.5%)。IHH蛋白的脂肪系数为83.73,不稳定指数为33.38(小于40),预测为热稳定性蛋白。另外,疏水性预测也发现,IHH蛋白只有7个位点具有疏水性,其中Ile疏水性最强(4.500),总平均疏水性参数为-0.254(图6)。综合推测,IHH蛋白为亲水性蛋白。

图6 IHH蛋白亲疏水性预测Fig.6 The hydrophilic and hydrophobic prediction of IHH protein
2.6 鸡IHH蛋白信号肽、跨膜结构和亚细胞定位预测
信号肽预测表明,C值为0.475,Y值为0.656,mean-S-score值为0.906(大于0.5),最可能的剪切位点在23~24(图7(a))。跨膜区分析表明,IHH蛋白位于细胞膜表面,在6~23氨基酸位点有一段跨膜端(图7(b))。IHH蛋白亚细胞定位结果表明,IHH蛋白主要定位在胞外(Extracellular)和高尔基体(Golgi apparatus)上。综上可知,IHH蛋白为分泌蛋白。
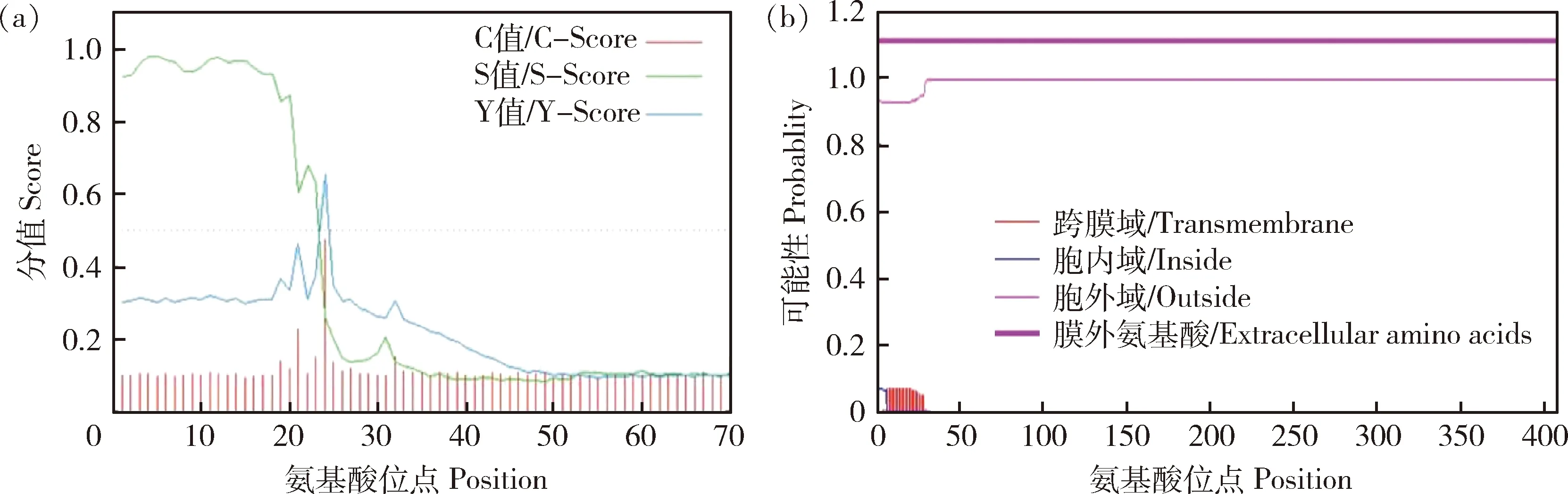
图7 IHH蛋白信号肽预测(a)和跨膜区域分析(b)Fig.7 IHH protein signal peptide prediction (a) and transmembrane region analysis (b)
2.7 鸡IHH蛋白其他修饰位点预测
修饰位点预测提示,IHH蛋白具有11个丝氨酸磷酸化位点、14个苏氨酸磷酸化位点和5个酪氨酸磷酸化位点(图8(a))。同时,鸡IHH蛋白第278氨基酸残基处有1处N型糖基化位点(图8(b)),另有6处O型糖基化位点。
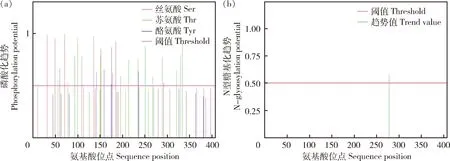
图8 蛋白磷酸化位点(a)和N型糖基化(b)预测Fig.8 Prediction of protein phosphorylation site (a) and N-type glycosylation (b)
2.8 鸡IHH蛋白结构预测
IHH蛋白的二级结构分析显示(图9(a)),α-螺旋比例为25.00%,延伸链比例为22.30%,β-转角比例为8.58%,无规则卷曲占比最高(44.12%)。同序列构建三级结构模型(图9(b)),QMEAN为-0.14,接近于0,与模板蛋白相似度较高。功能结构域预测在IHH蛋白的24~185氨基酸处存在HH-Signal功能域(图9(c)),可能与胚胎细胞分化所需的分泌信号传导有关。

(a)IHH蛋白二级结构预测。蓝色,α-螺旋;紫色,无规则卷曲;红色,延伸链;绿色,β-转角;(b)IHH蛋白三级结构预测;(c)IHH蛋白结构功能域预测。(a) Secondary structure forecast of IHH protein. Blue, alpha helix; Purple, random coil; Red, extended strand; Green, beta turn; (b) Tertiary structure forecast of IHH protein; (c) IHH protein structure function domain prediction results.图9 鸡IHH蛋白结构预测Fig.9 The structure forecast of IHH protein in chicken
3 讨 论
家禽生产性能的高低与长骨的变化呈强正相关,而家禽长骨形成的方式是软骨内成骨[20]。IHH基因已被证明在鸡软骨内成骨的多个方面都起着重要作用[21-22],作为鸡软骨形成标记基因被广泛应用于骨骼相关研究中[23-26]。Vortkamp等[21]发现鸡IHH基因的错误表达会极大地影响软骨分化过程。利用环巴胺抑制IHH后,鸡软骨细胞的增殖降低[10]。使用逆转录病毒降低鸡后肢发育过程中IHH的表达,会导致长骨长度减少6%[27],而给予IHH蛋白可诱导鸡骨生长[28]。金四华[14]发现鸡IHH基因的缺失与匍匐性状紧密相关。Ye等[29]推测IHH基因参与BMP6对鸡软骨细胞增殖和分化的调控。上述研究表明,IHH基因的表达对家禽生产性能和疾病发生具有重要影响,因此对鸡IHH基因的深入研究尤为重要。
基因结构可为进一步探究基因介导的调控机制提供重要参考。本研究利用生物信息学软件对序列进行分析,发现鸡IHH基因有3个外显子,数目与牦牛[5]和人[30]的相同,编码蛋白的大小与人IHH蛋白相近[30]。氨基酸相似性分析表明,IHH蛋白在家禽中较为保守,系统进化树在不同物种间出现明显分支,这与前期在牛上的研究结果相似[31]。蛋白质的结构决定其功能。本研究分析表明,IHH蛋白是有跨膜端的分泌蛋白,表明该蛋白可能在胞外进行表达并参与生物活动,这与其生物学功能相契合。此外,鸡IHH蛋白有较多的丝氨酸和苏氨酸位点,而丝氨酸和苏氨酸在激活蛋白质的过程中具有重要作用,这提示其可能具有较强的酶活力[32]。同时,结构域预测发现,鸡与人IHH蛋白均具有3个结构域,其突变致病位点大都位于N端结构域[3,15],其中HH-Signal功能域内含大部分的磷酸化位点,与信号传导和代谢等功能有关。
组织表达分析发现,IHHmRNA在鸡软骨、心、肝、脾、肺、肾、下丘脑、胸肌、十二指肠和胸腺组织中均有表达,其中在软骨组织中显著高表达,其次为十二指肠、肺和肝脏,其在胸肌中表达相对最低,与人[33]和小鼠[34]中的研究结果基本一致。这进一步说明软骨组织是IHH基因发挥作用的重要靶器官,为深入研究IHH基因对软骨发育的调控作用提供重要依据。
4 结 论
鸡IHH基因具有多个启动子区和1个CpG岛,在禽类中保守性较高。鸡IHH蛋白是一种具有偏碱性、强热稳性和低亲水性等特点的分泌型蛋白。IHH基因具有组织表达特异性,在软骨中显著高表达。本研究可为进一步从分子和细胞水平研究鸡IHH基因对软骨发育的调控作用提供重要参考。
