基于RhoA/ROCK 通路研究miR-146a 过表达对类风湿关节炎大鼠关节损伤的修复作用
2023-09-07李刚胡立新徐昕熊敏
李刚,胡立新,徐昕,熊敏
类风湿关节炎是以关节滑膜慢性炎症为主要特征的常见全身性免疫疾病[1],临床表现为滑膜细胞肿瘤样增生、血管异常过多、炎症细胞刺激关节软骨与周围组织[2],具有持续病变、易反复发作、致残率高的特点,是临床上难治疾病之一[3-4]。miR-146a 在维持正常细胞免疫调节中发挥重要作用,miR-146a 缺失会造成细胞免疫失衡,致使炎症细胞过多释放,损伤关节组织。研究表明,通过miR-146a 抑制TRAF6 表达,从而阻断关节损伤并减少炎症细胞释放,抑制破骨细胞的生成和骨吸收活性,以减少关节破坏[5]。有研究表明,RhoA/ROCK 通路能够改变软骨细胞,从而影响软骨细胞的形态及功能[6]。本文探究基于RhoA/ROCK 通路的miR-146a 过表达对类风湿关节炎大鼠的干预效果。
1 材料与方法
1.1 研究对象及实验材料
选取40只SD 健康雄性大鼠,由吉林大学动物实验中心提供,年龄8~11 个月,平均(9.5±1.2)个月,体重218~245 g,平均(231.5±11.1)g。大鼠在相对湿度30%~36%、温度(23.5±1.3)℃的环境中喂养1 周,每日光照12 h。本研究已通过湖北医药学院附属东风医院伦理委员会批准[(2022)伦审第(10)号]。
兔抗大鼠白细胞介素-8(interleukin 8, IL-8)、白细胞介素-17(interleukin 17, IL-17)抗体(Sigma 公司);兔抗小鼠hs-CRP 抗体(Dako 公司);小鼠抗大鼠GSH-Px 抗体(Invitrogen 公司);RhoA、ROCK1、ROCK2 抗体(Abcam 公司);兔抗腺苷酸活化蛋白激酶(adenylate activated protein kinase, AMPK)、磷酸化AMPK(phosphorylated AMPK, p-AMPK) 抗 体(Millipore 公司);兔抗大鼠克隆叉头蛋白O3a(FoxO3a)、磷酸化FoxO3a(phosphorylated FoxO3a,p-FoxO3a)抗体(Cell Signaling公司)。
1.2 方法
1.2.1 建模及分组
随机选取10 只纳入正常组,不做任何处理。余下30只大鼠建立类风湿关节炎模型:参照陈璐璐等[7]研究中建模方法,并适当改动,使用Ⅱ型胶原蛋白进行造模。0.1 mol/L 冰醋酸将Ⅱ型胶原溶解之后,配制成质量浓度2 g/L 的溶液,4 ℃冰箱中放置12 h,之后加等体积弗氏完全佐剂,将二者进行冰浴混合、乳化,制成乳剂,使每1 mL 乳剂包含1 mgⅡ型胶原。将1 mL 乳剂在大鼠的右后足趾部位、尾根部位及背部皮内进行多点注射。1 周过后加强免疫1 次,注射0.5 mL,建立胶原诱导后大鼠实验性类风湿关节炎动物模型。造模后2 周,将造模成功的大鼠分为3 组,其中沉默miR-146a组尾部静脉注射30 mg/kg 有抑制剂转染miR-146a,过表达miR-146a 组尾部静脉注射30 mg/kg 无抑制剂转染miR-146a。正常组、模型组大鼠尾部静脉注射等量生理盐水。各组大鼠实验室常规饮食饮水,密切关注,定期清洗、消毒。实验过程中对动物的处置严格遵守国家科技部所规定的《关于善待实验动物的指导意见》。
1.2.2 关节炎指数(arthritis index, AI)评分
分别在研究3周、6周、9周、12周对各组大鼠进行AI评分[8]。评分标准:无关节炎为0分;出现轻度发红或者肿胀症状为1分;关节出现中度肿胀为2分;关节严重及全部肿胀为3 分;足爪出现严重变形为4 分。每只大鼠4只足爪的评分相加作为最后的AI评分。
1.2.3 蛋白质印迹法检测RhoA、ROCK1、ROCK2 及AMPK、FoxO3a蛋白表达
取关节软骨组织,放入预冷后的细胞裂解液,采用超声细胞破碎仪进行破碎,离心处理,取出上清液、蛋白定量后,十二烷基硫酸钠(sodium dodecyl sulfate, SDS)-聚丙烯酰胺凝胶电泳,之后结合一抗、稀释,孵育1 d,取出后使用TBST 液冲洗,辣根过氧化酶所标记的鼠抗兔为二抗,β-actin 为内参,60 min后清洗、显色,检测RhoA、ROCK1、ROCK2 及AMPK、FoxO3a蛋白表达情况。
1.2.4 酶联免疫法检测IL-8、IL-17、hs-CRP水平
抽取每只大鼠外周血3 mL,50 mmol/L 的碳酸盐包被缓冲液溶解,使抗原浓度达到10~20 μg/mL,每孔加入100 μL 至96 孔酶标板,加盖处理后在4 ℃冰箱内存放24 h,第2 日进行3 次洗涤,然后抛干,将稀释液(pH 为7.4,0.02 mol/L Tris-HCl 缓冲液)稀释的0.1 mL 待测标本放入每个孔中,同时放入阳性和阴性对照标本,存放在42 ℃环境中60 min,移除液体后进行3 次洗涤并抛干,在每个孔中放入IL-8、IL-17、hs-CRP抗体0.1 mL,存放60 min,移除液体后进行3次洗涤并抛干,在每个孔中放入底物液(0.1 mol/L Na2HPO4,0.05 mol/L 的枸橼酸),混匀后放入0.1 mL邻苯二胺,进行20 min 遮光,再次在每个孔内加入2 mol/L H2SO40.05 mL,终止反应。最后使用酶标仪检测IL-8、IL-17、hs-CRP水平。
1.3 统计学方法
采用SPSS 21.0软件进行统计学分析。计量资料以均数±标准差表示,多组间比较行单因素方差分析,组间比较行LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 病理组织学观察
正常组大鼠组织结构相对完整,关节软骨表面较为光滑,关节腔清晰可见,无炎性细胞浸润及纤维组织增生现象;模型组大鼠滑膜组织细胞排列不规则,出现大量炎性细胞浸润以及滑膜间质纤维化现象;沉默miR-146a 组大鼠滑膜组织细胞排列参差不齐,存在大量炎性细胞浸润;过表达miR-146a组大鼠关节滑膜组织受损情况以及炎性细胞浸润情况明显改善(图1)。

图1 各组大鼠关节病理组织学HE染色观察图(×200)
2.2 AI评分比较
模型组、沉默miR-146a 组大鼠AI 评分高于正常组,且沉默miR-146a组高于模型组,差异有统计学意义(P<0.05)。过表达miR-146a 组大鼠AI 评分高于正常组,但低于模型组和沉默miR-146a组,差异有统计学意义(P<0.05)。见表1。
表1 各组关节炎指数评分比较(±s,n=10,分)
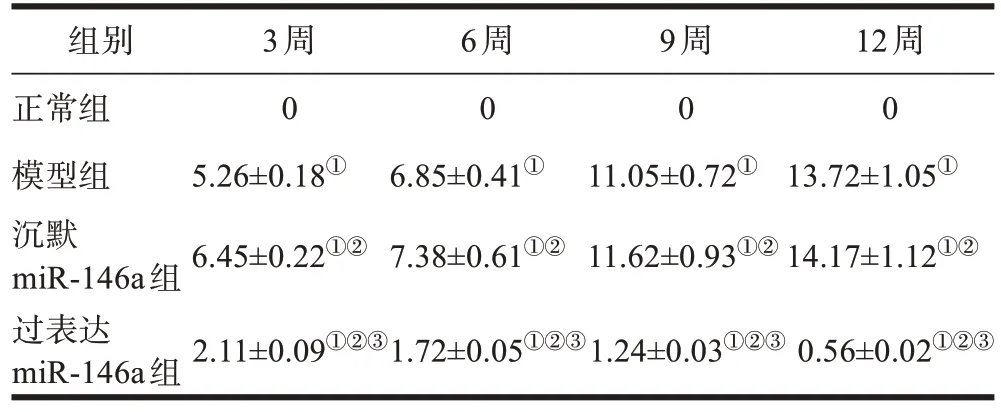
表1 各组关节炎指数评分比较(±s,n=10,分)
注:①P<0.05,与正常组相比;②P<0.05,与模型组相比;③P<0.05,与沉默miR-146a组相比。
组别正常组模型组沉默miR-146a组过表达miR-146a组3周0 5.26±0.18①6.45±0.22①②6周0 6.85±0.41①7.38±0.61①②9周0 11.05±0.72①11.62±0.93①②12周0 13.72±1.05①14.17±1.12①②2.11±0.09①②③1.72±0.05①②③1.24±0.03①②③0.56±0.02①②③
2.3 RhoA/ROCK表达水平比较
模型组、沉默miR-146a 组大鼠RhoA、ROCK1 及ROCK2 表达水平高于正常组,且沉默miR-146a 组高于模型组,差异有统计学意义(P<0.05)。过表达miR-146a 组大鼠RhoA、ROCK1 及ROCK2 表达水平高于正常组,但低于模型组和沉默miR-146a组,差异有统计学意义(P<0.05)。见表2和图2。
表2 RhoA/ROCK表达水平比较(±s,n=10)

表2 RhoA/ROCK表达水平比较(±s,n=10)
注:①P<0.05,与正常组相比;②P<0.05,与模型组相比;③P<0.05,与沉默miR-146a组相比。
ROCK2 0.61±0.11 1.24±0.14①1.35±0.11①②0.76±0.07①②③组别正常组模型组沉默miR-146a组过表达miR-146a组RhoA 0.98±0.07 2.43±0.13①2.57±0.15①②1.23±0.12①②③ROCK1 0.76±0.09 1.61±0.07①1.85±0.12①②0.93±0.10①②③

图2 RhoA、ROCK1及ROCK2表达图
2.4 IL-8、IL-17、hs-CRP水平比较
模型组、沉默miR-146a组大鼠IL-8、IL-17、hs-CRP水平高于正常组,且沉默miR-146a组大鼠高于模型组,差异有统计学意义(P<0.05)。过表达miR-146a组大鼠IL-8、IL-17、hs-CRP水平均低于模型组、沉默miR-146a组,但高于正常组,差异有统计学意义(P<0.05)。见表3。
表3 各组大鼠IL-8、IL-17、hs-CRP水平比较(±s,n=10)

表3 各组大鼠IL-8、IL-17、hs-CRP水平比较(±s,n=10)
注:①P<0.05,与正常组相比;②P<0.05,与模型组相比;③P<0.05,与沉默miR-146a组相比。
组别正常组模型组沉默miR-146a组过表达miR-146a组IL-8(pg/mL)23.85±3.14 45.91±3.72①55.38±4.25①②IL-17(ng/L)7.62±1.24 25.13±2.92①40.14±3.57①②hs-CRP(ng/mL)3.75±0.86 14.75±1.61①21.29±2.63①②7.03±1.05①②③31.19±3.16①②③12.27±1.72①②③
2.5 AMPK、FoxO3a蛋白表达情况
模型组、沉默miR-146a组大鼠AMPK、p-AMPK、FoxO3a、p-FoxO3a表达低于正常组,且沉默miR-146a组大鼠均低于模型组,差异有统计学意义(P<0.05);过表达miR-146a 组大鼠AMPK、p-AMPK、FoxO3a、p-FoxO3a表达均低于模型组、沉默miR-146a组,但高于正常组,差异有统计学意义(P<0.05)。见表4、图3。
表4 各组大鼠AMPK、FoxO3a蛋白表达情况(±s,n=10)
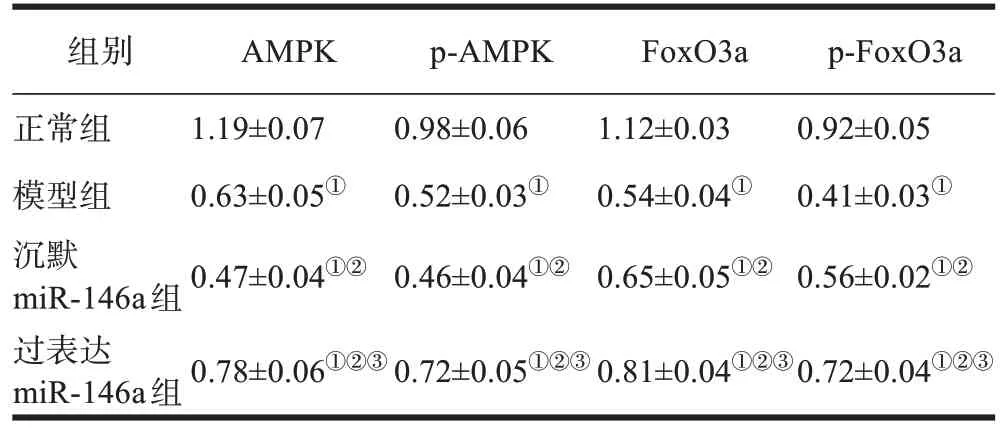
表4 各组大鼠AMPK、FoxO3a蛋白表达情况(±s,n=10)
注:①P<0.05,与正常组相比;②P<0.05,与模型组相比;③P<0.05,与沉默miR-146a组相比。
组别正常组模型组沉默miR-146a组过表达miR-146a组AMPK 1.19±0.07 0.63±0.05①0.47±0.04①②p-AMPK 0.98±0.06 0.52±0.03①0.46±0.04①②FoxO3a 1.12±0.03 0.54±0.04①0.65±0.05①②p-FoxO3a 0.92±0.05 0.41±0.03①0.56±0.02①②0.72±0.04①②③0.78±0.06①②③0.72±0.05①②③0.81±0.04①②③

图3 AMPK、FoxO3a蛋白表达图
3 讨论
类风湿关节炎是一种病因未明确的全身性疾病。研究表明,关节滑膜炎性病变和骨质的损伤严重影响类风湿关节炎的发生发展[9-10]。RhoA/ROCK通路在临床上被称为肌动蛋白细胞骨架调节器,同时也是细胞形态异质性的调节器[11]。有研究显示,RhoA/ROCK 通路能够调节细胞膜整合素表达,控制外界信号信号向细胞内传导[12]。由于类风湿关节炎机制复杂,目前在我国尚无特效治疗方法[13]。miR-146a 作为最先发现的具有免疫调节作用的miRNA,主要位于5 号染色体上,是基因表达的重要调节剂,能够在转录之后水平上对靶mRNA 进行干预调控。研究显示,miR-146a 在炎症反应中具有重要作用,能够调节炎症反应的严重程度,同时在适应性免疫疾病中发挥重要作用,是类风湿关节炎的负性调控分子[14-15]。
类风湿关节炎为慢性进展性疾病,在疾病的发展过程中,受累关节的病理变化及关节微环境也在不同变化,关节成纤维样滑膜细胞增殖及凋亡特性有可能出现相应改变[16]。AI 评分能够反映类风湿关节炎的病理基本变化,是观察大鼠关节炎变化的重要评分。本研究显示,相比正常组,类风湿关节炎大鼠AI 评分升高,说明AI 评分与类风湿关节炎大鼠病情的发生与发展存在关联。基于RhoA/ROCK 通路miR-146a 过表达的大鼠AI 评分明显降低,说明基于RhoA/ROCK 通路miR-146a 过表达能够有效控制类风湿关节炎大鼠病情进展。
RhoA蛋白作为小G蛋白超家族的亚家族的主要成员,也是谷丙转氨酶之一,能够影响细胞有丝分裂及细胞骨架调节等多种生物的生理过程[17]。ROCK分成ROCK1 与ROCK2 两个亚型,是目前研究较为清晰的效应分子[18]。通过研究RhoA/ROCK 通路有助于观察软骨细胞的生长发育与退行性病变。本研究结果显示,相比正常大鼠,类风湿关节炎大鼠RhoA、ROCK1及ROCK2表达水平明显升高,说明在大鼠类风湿关节炎发展中RhoA、ROCK1 及ROCK2参与病变过程,基于RhoA/ROCK通路miR-146a过表达的大鼠,RhoA、ROCK1及ROCK2表达水平出现下降,说明基于RhoA/ROCK通路miR-146a过表达能够抑制类风湿关节炎出现病变。
类风湿关节炎的滑膜组织中有大量炎症细胞浸润,例如T 淋巴细胞、B 淋巴细胞、巨噬细胞等[19]。有研究显示,IL-8、IL-17、hs-CRP 等炎性因子严重影响类风湿关节炎的发生发展,不仅能够直接影响关节炎症性改变,还能够刺激多种信号,造成滑膜炎症反应,从而引发关节损伤[20]。本研究结果显示,相比正常大鼠,类风湿关节炎大鼠IL-8、IL-17、hs-CRP 水平相对较高,说明炎症反应刺激着类风湿关节炎的发生,提高了关节损伤程度。基于RhoA/ROCK 通路miR-146a 过表达的大鼠,IL-8、IL-17、hs-CRP 水平较明显下降,说明基于RhoA/ROCK通路miR-146a过表达能够抑制类风湿关节炎的发生发展,降低关节损伤程度及炎症反应。
AMPK 作为一种具有多种代谢途径的中枢调节剂,在真核细胞中广泛存在,是调节能量的一种关键因子[21]。FoxO3a 在维持活性氧稳态方面具有重要作用,AMPK 激活后,可以磷酸化多条信号通路的关键蛋白,包括FoxO3a,与其协同作用能够增强动物抗应激能力及抗氧化能力[22]。本研究结果显示,相比正常大鼠,类风湿关节炎大鼠AMPK、p-AMPK、FoxO3a、p-FoxO3a 表达水平相对较低,说明类风湿关节炎影响着AMPK、FoxO3a蛋白表达情况,基于RhoA/ROCK通路miR-146a 过表达的大鼠,AMPK、p-AMPK、FoxO3a、p-FoxO3a表达水平出现上升,说明RhoA/ROCK通路miR-146a过表达能够提升修复关节损伤作用及抗氧化能力。
4 结论
基于RhoA/ROCK 通路的miR-146a 过表达对类风湿关节炎大鼠进行干预,能够控制病变,抑制类风湿关节炎的发生发展,降低炎症反应程度及关节损伤情况,提升关节损伤修复作用及抗氧化能力,为类风湿关节炎关节损伤的治疗提供新的靶点和参考依据。
【利益冲突】所有作者均声明不存在利益冲突
