颈椎间盘置换术后不同级别异位骨化对邻近节段退变的影响
2023-09-07田天谭胜芝刘涛崔凯汪东李源沙鑫姬勇谭荣
田天,谭胜芝,刘涛,崔凯,汪东,李源,沙鑫,姬勇,谭荣
目前颈椎前路椎间盘切除融合术(anterior cervical discectomy and fusion, ACDF)是目前治疗颈椎病的“金标准”,但其带来的邻近节段退变(adjacent segment degeneration, ASD)不可忽视。文献报道ACDF术后患者每年约3%发生ASD,术后10年ASD 的发生率为25.6%[1]。因此颈椎间盘置换术(cervical disc replacement, CDR)应运而生。CDR 的目的是解除神经压迫、重建脊柱稳定性的同时保留手术节段的运动功能,避免因融合手术造成的应力集中,减少ASD 的发生。诸多报道证实CDR 可获得与ACDF相同的临床效果,且保留了置换节段的活动度(range of motion, ROM)[2-4]。但是,异位骨化(heterotopic ossification, HO)是CDR 术后主要并发症,其发生率可达50%~90%[5-7],严重的HO 可造成假体ROM 丧失。目前,CDR 术后不同分级HO 对ASD的影响尚不明确。本研究通过回顾性分析一组单节段CDR 治疗的颈椎病患者的临床资料,旨在观察不同分级HO对邻近节段影像学参数的影响。
1 资料与方法
1.1 一般资料
纳入标准:①脊髓型、神经根型颈椎病及颈椎间盘突出症,适合颈椎前路手术;②进行了至少3个月的保守治疗,效果欠佳;③单节段手术;④保持门诊随访且手术前后影像学资料完整。排除标准:①年龄>60岁者;②椎间关节退变严重者[椎间隙高度(intervertebral disc height, IDH)丢失>50%、置换节段ROM<2°];③后纵韧带骨化者;④明显的颈椎不稳定者;⑤发育性颈椎管狭窄者;⑥多节段颈椎间盘退变者。
2012年7月至2018年1月战略支援部队特色医学中心进行单节段CDR的颈椎病患者94例,符合上述纳入与排除标准的患者61例,其中男28例,女33例,年龄27~58 岁,平均年龄(45.9±8.3)岁,手术节段:C3-4 7例、C4-5 11例、C5-6 36例、C6-7 7例。
本研究经战略支援部队特色医学中心伦理委员会批准([2023]02-206),并豁免患者知情同意。
1.2 手术方法
患者全身麻醉后,颈椎取中立位。手术采用经典的颈椎前入路,切除目标椎间盘,Caspar 撑开器撑开椎间隙,根据测量的宽度和深度选取试模,置入试模后,C型臂X线机透视确认大小合适后植入Mobi-C假体(Zimmer,美国),撑开器松开并适度加压后取出,冲洗伤口,置入橡胶引流条,逐层缝合切口。所有手术均由同一临床团队完成,且由同一术者担任主刀。
术后24 h拔除引流条。术后佩戴颈托2周,然后去除颈托逐步进行颈椎主动屈伸、旋转等练习,加强颈部肌肉锻炼。
1.3 随访计划及评价指标
1.3.1 随访计划
术后1个月、3个月、6个月、12个月及之后每年门诊随访,进行影像学评估。
1.3.2 评价指标
①颈椎ROM:颈椎过伸过屈位X 线片测量目标角度变化的差值,包括C2-7 ROM、手术节段ROM(图1A、B)及上位、下位邻近节段ROM(图1A、B);②颈椎曲度:C2 椎体下终板与C7 椎体的下终板形成的夹角(图1C),角度为正表示前凸,为负表示后凸;③脊柱功能单位角(functional spinal unit angle,FSU):上位椎体上终板与下位椎体下终板形成的夹角(图1C),角度为正表示前凸,为负表示后凸;④IDH:包括上、下位邻近节段IDH,即侧位X线片椎间隙上、下终板中点间的距离[8](图1D);⑤ASD 评估采用Walraevens 评分[9](表1);⑥手术节段HO 评估采用McAfee分级[10]。

图1 影像学参数测量方法
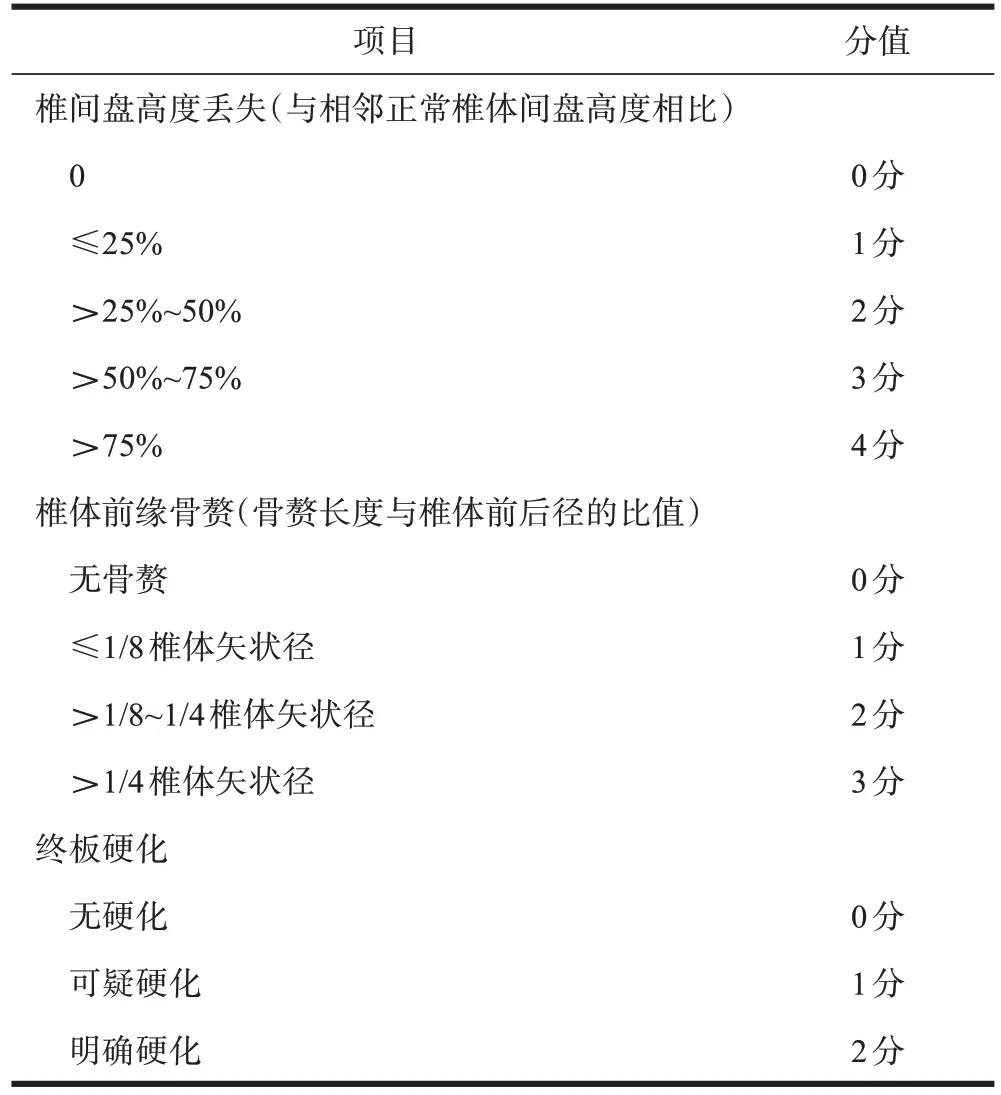
表1 Walraevens评分
术前和末次随访时在Synapse 系统上测量所有影像学参数,由2名医师分别独立测量。
1.4 统计学方法
采用SPSS 13.0软件进行统计学分析。计量数据经统计学分析符合正态分布,以均数±标准差表示。采用配对t检验比较术前与末次随访时各评价指标。以P<0.05为差异有统计学意义。
2 结果
所有患者均顺利完成手术,无神经损伤、脑脊液漏、感染、假体移位等并发症发生。随访时间4.0~8.5 年,平均(5.3±1.1)年。末次随访时未发现症状性ASD 患者,无一例患者进行翻修手术。末次随访时,手术节段HO 总发生率为77.1%(47/61),根据McAfee 分级,低级别(1~2 级)HO 发生率为36.1%(22/61),高级别(3~4级)HO 发生率为41.0%(25/61),其中3 级和4 级HO发生率分别为24.6%(15/61)、16.4%(10/61)。依据HO 分级,将61 例患者分为无HO 组、低级别(1~2 级)HO 组、3级HO组、4级HO组。术前4级HO组患者C2-7 ROM、手术节段ROM 均低于无HO 组患者,且差异均有统计学意义(P<0.05,P<0.01,表2)。

表2 不同分级OH患者术前一般临床资料比较
2.1 手术节段影像学参数比较
与术前相比,末次随访时各组患者C2-7 ROM 和颈椎曲度均保持良好(P>0.05);无HO 组、低级别(1~2级)HO组、3级HO组患者手术节段ROM 均保持良好(P>0.05),而4 级HO 组患者手术节段ROM 较术前明显降低(P<0.01)。末次随访时无HO组、低级别(1~2级)HO组患者FSU均较术前明显改善(P<0.01),而3 级HO 组、4 级HO组患者FSU与术前比较差异均无统计学意义(P>0.05)。见表3。
表3 手术节段术前与末次随访时各指标比较(±s,°)

表3 手术节段术前与末次随访时各指标比较(±s,°)
注:①P<0.01,与术前比较;②P<0.05,③P<0.01,与无HO组比较;④P<0.05,⑤P<0.01,与低级别(1~2级)HO组比较。
组别无HO组例数14 C2-7 ROM 手术节段ROM 颈椎曲度FSU术前末次随访低级别(1~2级)HO组术前末次随访3级HO组术前末次随访4级HO组22 15 10 50.62±12.65 50.08±8.56 46.25±15.53 50.85±13.09 38.79±11.36 11 7 44.43±7.21②10.54±2.73 11.23±2.98 8.80±3.97.05±3.25.93±3.97 6.50±5.81③⑤9.62±9.71 13.92±12.14 6.85±9.05 11.20±10.79 6.36±11.32 12.29±8.13 2.08±3.28 7.31±5.45①0.95±4.08 6.50±5.27①0.57±4.35 2.64±4.79②④0.31±4.09 2.15±4.81②④术前末次随访38.92±15.38 41.77±8.24③6.85±3.44 1.77±1.88①③⑤8.23±6.09 9.69±7.05
末次随访时,3 级HO 组、4 级HO 组患者C2-7ROM 均小于无HO 组患者(P<0.05);3级HO 组、4级HO 组患者手术节段ROM 均明显小于无HO 组、低级别(1~2 级)HO 组患者(P<0.01);各组患者间颈椎曲度差异均无统计学意义(P>0.05);无HO 组、低级别(1~2级)HO组FSU均优于3级HO组、4级HO组患者(P<0.05)。见表3。
2.2 邻近节段影像学参数
末次随访时,4 级HO 组患者上位邻近节段ROM较术前明显增大(P<0.01),其余组患者与术前比较差异均无统计学意义(P>0.05);各组患者下位邻近节段ROM与术前比较差异均无统计学意义(P>0.05);4级HO 组患者上位邻近节段IDH、下位邻近节段IDH 均较术前明显减小(P<0.01),其余组患者与术前比较差异均无统计学意义(P>0.05);4 级HO 组患者上位邻近节段Walraevens评分较术前明显增高(P<0.01),其余组患者与术前比较差异均无统计学意义(P>0.05);无HO 组、低级别(1~2 级)HO 组、4 级HO 组患者下位邻近节段Walraevens评分均较术前明显增高(P<0.05,P<0.01)。见表4。
表4 邻近节段术前与末次随访时各指标比较(±s)

表4 邻近节段术前与末次随访时各指标比较(±s)
注:①P<0.05,②P<0.01,与术前比较。
组别例数上位邻近节段ROM(°)下位邻近节段ROM(°)上位邻近节段IDH(mm)下位邻近节段IDH(mm)上位邻近节段Walraevens评分(分)下位邻近节段Walraevens评分(分)无HO 组14术前末次随访低级别(1~2级)HO组术前末次随访3级HO组术前末次随访4级HO组22 15 10 10.62±2.87 10.46±3.04 9.90±3.58 9.41±3.81 8.64±3.63 9.64±3.20 8.69±3.61 9.62±3.28 8.47±3.56 8.65±3.63 8.66±3.21 7.86±3.13 6.15±0.69 6.12±0.73 6.18±0.66 6.02±0.67 6.47±0.71 6.32±0.61 6.73±0.92 6.42±0.74 6.62±0.81 6.36±0.66 6.91±0.77 6.67±0.69 0.62±0.61 0.85±0.83 0.85±0.73 1.25±1.15 0.64±0.63 1.14±0.86 1.08±0.64 1.69±0.75①1.10±0.55 1.70±0.86①1.50±1.22 2.43±1.87 1.31±0.75 2.62±0.96②术前末次随访8.15±1.72 11.07±2.25②8.09±2.48 8.31±2.18 6.35±0.43 5.92±0.35②6.99±0.46 6.21±0.44②0.69±0.48 1.54±0.66②
典型病例见图2和图3。

图2 患者,女,58岁,C4-5神经根型颈椎病,采用CDR治疗
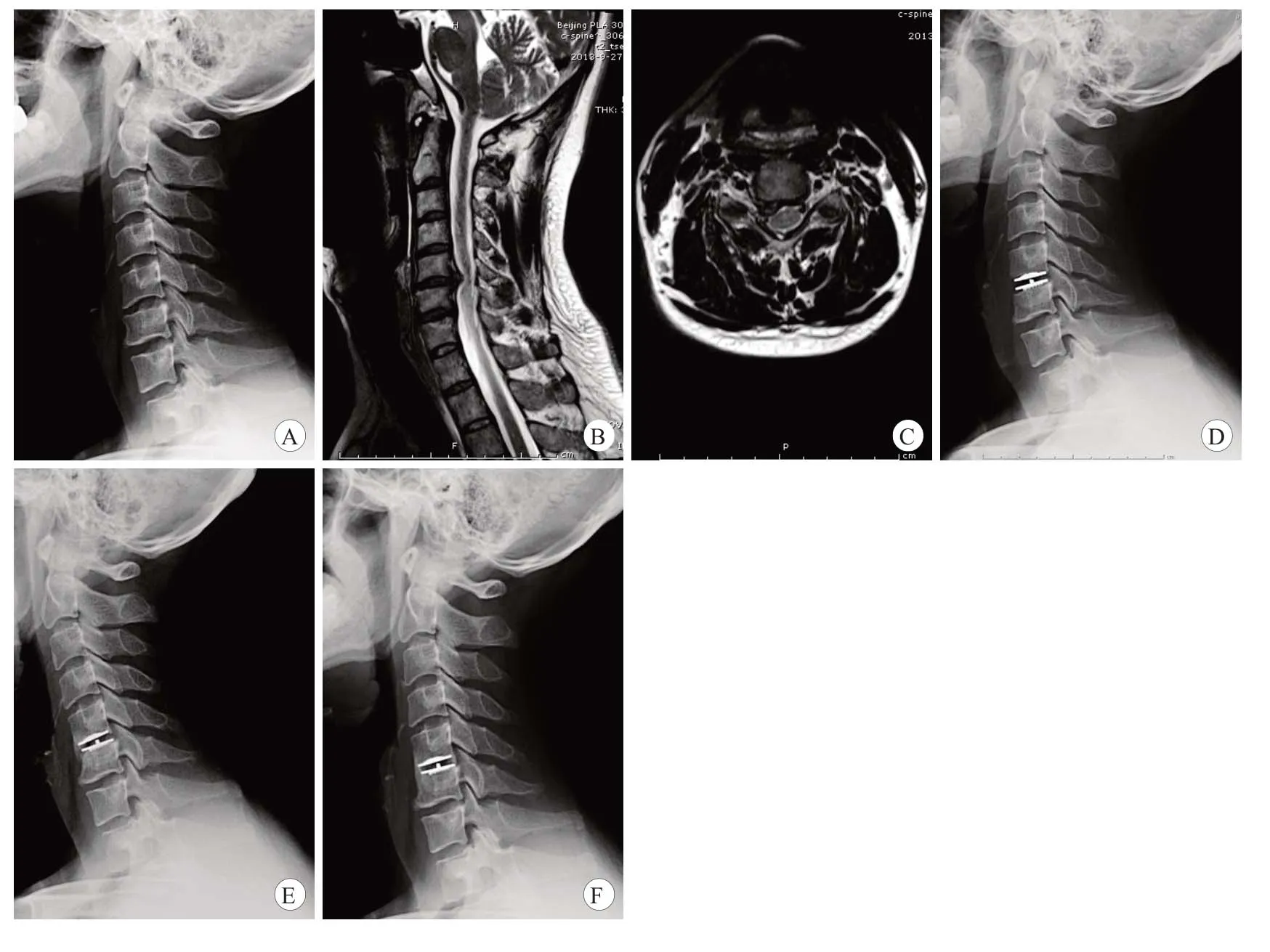
图3 患者,男,35岁,C5-6神经根型颈椎病,采用CDR治疗
3 讨论
3.1 HO对手术节段的影响
CDR的目的是保留手术节段的运动功能。中长期随访显示,Mobi-C CDR 术后假体的ROM 得到保留[11-12]。HO被认为是影响假体运动的重要因素,尤其是高级别的HO,可导致置换节段ROM减小,甚至融合[13]。
本组患者HO总发生率为77.1%,其中低级别(1~2 级)HO 发生率为36.1%,高级别(3~4 级)HO 发生率为41.0%。本课题组既往研究发现,HO 的产生与临床疗效无明显相关性[11],其他研究也得出类似结论[12]。本研究结果显示,与术前比较,末次随访时无HO 组、低级别(1~2 级)HO 组患者手术节段ROM 均保持良好,3 级HO 组手术节段ROM 虽有轻度降低,但与术前比较差异无统计学意义(P>0.05),因此83.6%(51/61)的患者在术后5 年仍能保留手术节段良好的ROM。本组患者4 级HO 发生率为16.4%,末次随访时手术节段ROM 较术前显著降低(P<0.01),但未发现手术节段因HO 导致的症状复发,无一例患者进行翻修手术。需要警惕的是,随着随访时间延长,HO 有逐渐发展的趋势,这可能会造成手术节段ROM 的进一步下降[6]。有研究报道,严重的HO 可以压迫手术节段周围的神经结构,产生新的神经症状,从而需要进行翻修手术[14]。因此,CDR 术后患者应长期规律随访。
CDR 术后HO 的发生机制尚不明确,Tian 等[15]认为,一部分HO 可能是术前存在的椎体外侧缘骨赘的进展,而不是新的骨形成;另一部分HO 可能是术后人工椎间盘的不当运动、生物力学环境的改变引起的。本课题组认为,HO 的形成可能是人体自我修复-稳定的结果,因为人工椎间盘的植入改变了术前颈椎原有的生物力学环境,人体为了对抗人工椎间盘非生理运动产生正常防御机制。
本研究发现,高级别HO尤其是4级HO组患者术前手术节段ROM 明显小于无HO 组患者(P<0.01);而末次随访时FSU 改善不佳,也预示着高级别HO 形成的风险增高。CDR 术后HO 的潜在危险因素包括高龄、男性、多节段手术[16]。也有学者认为HO与手术操作相关,如过度矫正手术节段IDH和ROM、假体-终板的覆盖面积不匹配[17-18]。此外,术前手术节段退变情况的评估尤其需要重视,包括术前IDH、ROM、椎体前后缘骨赘、钩椎关节和关节突关节的退变情况[5]。
3.2 HO对ASD的影响
颈椎人工椎间盘设计的初衷是避免因融合手术造成的邻近节段应力集中,减少ASD 的发生。多项体外研究表明,相较于ACDF,使用人工椎间盘可降低相邻节段椎间盘内压力[19-20]。一项10 年随访研究发现,与ACDF 相比,应用Byran 假体的邻近节段再手术率显著降低(9.7%vs.15.8%)[21]。另一项多中心ProDisc-C CDR 与ACDF 治疗单节段颈椎病的研究发现,ACDF 患者中有8.5%需要再次手术、翻修或补充固定,而CDR 患者再手术率只有1.8%[22]。Davis等[3]对比CDR 与ACDF 发现,术后4 年CDR 组患者ASD发生率为41.5%,而ACDF组为85.9%。近年来,越来越多的研究证实,相较于ACDF,CDR 可降低ASD的发生率,但其与ASD的关系仍有争议[18,23-27]。
高级别HO 会明显降低手术节段ROM,甚至造成自发性融合,使得CDR 达不到手术设计的目的。而手术节段ROM 丧失、应力集中,会造成类似ACDF的结局,加速ASD,这一点在4 级HO 组患者表现尤为明显。末次随访时,4 级HO 组患者上位邻近节段ROM 较术前明显增大(P<0.01),考虑为手术节段ROM丧失后的代偿机制。末次随访时,4级HO组患者上位、下位邻近节段IDH均较术前显著下降(P<0.01),上位、下位邻近节段Walraevens评分均较术前明显增高(P<0.01),提示ASD的发生。
末次随访时,无HO 组、低级别(1~2 级)HO 组患者未观察到明显的ASD 发生,上位、下位邻近节段ROM、IDH与术前比较差异均无统计学意义(P>0.05);同时,3级HO 组患者也得到同样的结果,分析原因:①手术节段虽然出现较高级别(3~4 级)HO,包括假关节形成,可能对假体运动产生一定影响,但人工假体仍然保留一定ROM,能有效地分散应力,减缓ASD 的发生;②理论上CDR 术后假体的活动功能应至少保留10 年,才能显著减少ASD 的发生率[5],ASD的进展相对缓慢,因此需要更长的观察时间。即使如此,此随访结果也是令人鼓舞的,3级HO 组患者在5年随访时未观察到明显的ASD发生,提示假体维持6°~10°的ROM 似乎能够满足临床的功能需求,也契合新型仿生假体的设计思路[28]。
ASD 有两种亚型:一种为症状性ASD,伴有相关临床表现,如脊髓病、神经根病或颈椎失稳;另一种是影像学上的ASD,表现为影像学上的改变,无相关症状。本研究在末次随访时未发现症状性ASD 患者。本课题组认为ASD 的发生是多种原因造成的:①相邻椎间盘的自然病史。术前退变越严重,术后ASD 加速越明显。②手术导致相邻节段的生物力学应力异常。目前临床应用的假体多为球窝关节假体,尚不能很好地模拟正常颈椎的生理运动,假体的非生理性运动可能造成手术节段的HO 和邻近节段的应力异常。③置换节段的曲度异常及手术操作对邻近节段的影响均可能会对ASD 的出现发挥作用[29-30]。此外,末次随访时无HO 组、低级别(1~2 级)HO 组、4 级HO 组患者下位邻近节段Walraevens评分均较术前明显增高((P<0.05,P<0.01),提示ASD是自然病程的体现。
3.3 本研究的局限性
①本研究为单中心研究,样本量较少;②ASD 的进展缓慢,需要更长期的随访时间;③如果有ACDF对照组,能进一步提高结论的可靠性;④末次随访时缺乏MRI等对ASD更加敏感的影像学检查。
4 结论
CDR 术后HO 的发生率较高,1~3 级HO 对ASD无明显影响,而4 级HO 会显著降低手术节段ROM,且加速ASD。ASD进展缓慢,需要长期随访观察。
【利益冲突】所有作者均声明不存在利益冲突
