硫色曲霉的生长特性及其产赭曲霉毒素特性研究
2023-09-07孟月丽
孟月丽 管 乐 俞 蓓 王 龑
(浙江工业大学食品科学与工程学院, 浙江 杭州 310014)
硫色曲霉是在土壤、谷物壳上分离发现并在谷物贮藏期生长繁殖产生赭曲霉毒素的一种丝状真菌。赭曲霉毒素是由曲霉和青霉产生的一种真菌毒素,是各种食品和饲料中常见的生物污染物[1]。赭曲霉毒素包括7种结构类似的化合物,其中赭曲霉毒素A(ochratoxin A,OTA)是毒性最大、污染最严重的化合物[2-3]。OTA 主要污染粮谷类[4],也可能污染咖啡豆[5-6]、苹果[7]、可可[8]、巧克力[9]、坚果[10]、葡萄[11]、香肠[12]等。OTA 的产生菌有许多种[13],其熔点为169 ℃,具有很强的热稳定性,很难轻易去除,即使加热至125 ℃也不会对OTA造成明显破坏。这表明大多数食品加工条件不能去除OTA[14],因此OTA预防难度非常大。
OTA广泛存在于环境中,可以通过食物、皮肤和呼吸吸入进入人体[15],进入人体后OTA 可引起肠道消化不良症,包括增加肠道渗透性和细菌转移,导致肝细胞退化,肠道和淋巴组织坏死[16]。有研究发现,OTA 可诱发肾损伤、DNA 损伤反应和肾细胞细胞循环阻断,进而导致多种病理[17]。OTA 还具有诱发致畸、胚胎毒性、致癌性、肝毒性、免疫毒性和肾毒性等有毒特性[18],因此其受到国家和国际一级的法律监管[13]。国际癌症研究机构将OTA 归类为可能的人类致癌物质[19]。欧盟规定未加工的粮谷物中OTA 的最高允许量为5 μg·kg-1,其他可直接食用加工制品的最高允许量为3 μg·kg-1。婴幼儿及有特殊医疗目的的食物中OTA 含量不超过0.5 μg·kg-1,葡萄酒中OTA 含量不超过2 μg·L-1。我国质量标准《GB 2761-2017 食品安全国家标准 食品中真菌毒素限量》[20]规定谷物、豆类及其制品中OTA 的最高允许量为5 μg·kg-1。鉴于OTA 的毒性和污染性,如何有效控制及预防其产生尤为关键,而OTA 的产生与所处环境和培养条件有很大关系[21-23]。因此,研究环境因子对OTA 生长和毒素产生的影响,对控制OTA的产生具有重要意义。
赭曲霉毒素可由30多种曲霉和青霉产生[13,24],近年来报道的有赭曲霉[25]、硫色曲霉[26]、蜂蜜曲霉、黑曲霉、韦氏曲霉[27]以及炭黑曲霉[28]等。刘菲等[29]研究了不同培养基对赭曲霉生长及产毒能力的影响,通过比较不同培养基上赭曲霉产毒和生长的差异性,筛选到赭曲霉生长和产毒的最佳条件。陈伦佳等[30]研究了不同条件对炭黑曲霉产赭曲霉毒素A 能力的影响,通过单因素分析和响应面优化法研究炭黑曲霉在不同条件下的产毒能力,得到了炭黑曲霉产毒的最佳条件。朱柳杨等[31]研究了黑曲霉产赭曲霉毒素A 在不同环境因素下的产量,确定了黑曲霉产赭曲霉毒素A 的最佳条件。然而,目前关于在不同条件下研究硫色曲霉产赭曲霉毒素的报道很少,硫色曲霉的生长和产毒特性也不清楚。
因此,本研究分别探讨了不同固体培养基以及不同天然培养基对硫色曲霉生长和产毒的影响,为硫色曲霉产赭曲霉毒素的研究填补了空白,以期为控制硫色曲霉的生长和产毒提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 本试验所用硫色曲霉分离自水稻种植的土壤样品,通过形态学及分子生物学鉴定方法确定为硫色曲霉GZ-R1。
1.1.2 试剂 马铃薯购自农贸市场;葡萄糖、蔗糖购自北京化工厂;定量滤纸购自杭州特种纸业有限公司;微纤维滤纸购自北京北化黎明膜分离技术有限责任公司;甲醇分析纯AR、甲醇色谱纯购自美国Thermo Fisher 公司;吐温80、甘油、琼脂粉、乙酸以及酵母提取物购自北京奥博星生物技术有限责任公司。
1.1.3 仪器与设备 HR60-IIA2型生物安全柜,青岛海尔特种电器有限公司;LS-B50L-I 型立式压力蒸汽灭菌器,江阴滨江医疗设备有限公司;ZWY-2102C 型双层恒温培养振荡器,上海智诚分析仪器制造有限公司;B5-2型恒温磁力搅拌器,上海司乐仪器有限公司;YP3002 型电子天平,上海越平科学仪器有限公司;DGG-9053A 型电热恒温鼓风干燥箱,上海森信实验仪器有限公司;SHZ-III 型循环水真空泵,上海亚荣生化仪器厂;SC18G 型冷冻离心机,美国Sigma 公司;1DW-86LZ86 型超低温保存箱,日本三洋公司;1260 型高效液相色谱仪(high performance liquid chromatography,HPLC)、荧光检测器(fluorescence detection, FLD)、TCC18 色谱柱,英国安捷伦公司;ULTRA-TURRAX T 25 digital型分散器,德国IKA 公司;SZ2-1LST型电子显微镜,日本Olympus 公司;氮气吹扫仪,杭州奥威仪器有限公司;微量进样瓶,英国安捷伦公司;0.22 μm 微孔滤器,天津科艺隆实验设备有限公司;SK06G型超声波清洗器,上海科导超声仪器有限公司;循环水真空泵,上海亚荣生化仪器厂。
1.2 试验方法
1.2.1 培养基配制 酵母浸膏蔗糖(yeast extract with supplements,YES)培养基(1 L):酵母提取物20 g、蔗糖150 g、琼脂20 g。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(1 L)∶200 g马铃薯浸出液、葡萄糖20 g、琼脂20 g。
察氏酵母膏琼脂(czapek yeast extract agar,CYA)培养基(1 L):蔗糖30 g·L-1、NaNO33 g·L-1、K2HPO41.0 g·L-1、MgSO40.5 g·L-1、KCl 0.5 g·L-1、FeSO40.01 g·L-1、酵母膏1 g·L-1、琼脂15 g·L-1。
哥伦比亚琼脂(columbia agar,CA)培养基(1 L):NaNO32 g、K2HPO41 g、MgSO4·7H2O 0.5 g、KCL 0.5 g、FeSO4·7H2O 0.01 g、蔗糖30 g、琼脂15~20 g、蒸馏水1 000 mL,pH值自然。
氯硝胺孟加拉红琼脂(double rich broth with charcoal,DRBC)培养基(1 L):购于青岛高科园海博生物技术有限公司。
天然培养基:将玉米、小麦、水稻、花生进行打碎处理,取处理和未处理的样品各25 g,置于100 mL三角瓶中。
以上培养基均置于高压蒸汽灭菌锅中121 ℃灭菌20 min。
1.2.2 菌种活化及孢子液的制备 将封存于-80 ℃甘油管的菌株在PDA培养基上复苏,28 ℃下培养6~8 d,活化备用。用灭菌棉签刮下,放到灭菌的0.1%的吐温80 中,涡旋震荡制成均匀的孢子悬液,并用血球计数板计数,稀释到1×10-7个·mL-1备用。
1.2.3 固体培养基培养以及OTA 提取 取10 μL 硫色曲霉孢子液分别滴在YES、PDA、CYA、DRBC、CA 等固体平板中心,在不同温度下(15、20、25、30、37 ℃)培养8 d,观察菌落形态,测定菌落直径。用5 mm 打孔器在距离接种点同等距离打孔,每个平板打孔取样5个。将打孔样品加入2 mL甲醇,充分振荡混匀。用0.22 μm有机微孔滤器过滤至进样瓶,高效液相色谱-荧光(high performance liquid chromatography-fluorescence detection, HPLC-FLD)检测OTA含量。
1.2.4 不同pH 值的培养 取10 μL硫色曲霉孢子液分别滴在YES培养基上,在不同pH 值下(4.5、6、8、10)培养9 d,观察菌落形态,直径大小。用5 mm 打孔器在距离接种点同等距离打孔,每个平板打孔取样5个。将打孔样品加入2 mL甲醇,充分振荡混匀。用0.22 μm有机微孔滤器过滤至进样瓶,HPLC-FLD检测OTA含量。
1.2.5 天然培养基培养和OTA 提取 取10 μL 硫色曲霉孢子液分别滴在花生、玉米、水稻、小麦天然培养基上,在不同水分活度(0.90、0.92、0.94、0.96、0.98)下培养9 d。磨碎,取1 g 粉碎的样品加入2 mL 甲醇,充分振荡混匀。用0.22 μm有机微孔滤器过滤至进样瓶,HPLC-FLD检测OTA含量。
1.2.6 液相色谱检测 提取液用0.22 μm 滤膜过滤到棕色液相进样瓶中,直接上样。选用Agilent 1260型高效液相色谱仪、C18反向色谱柱(25 cm×4.6 mm,内径5 μm)和荧光检测器;设定工作参数:激发波长333 nm,发射波长460 nm;进样量20 μL;流动相为乙腈∶水∶酸(99∶99∶2);流速1 mL·min-1;柱温30 ℃[32]。
1.3 数据处理
所有处理均设3 个重复,数据处理采用SPSS 21.0软件进行单因素方差分析(one-way ANOVA)分析,使用最小显著差异法(least significant difference,LSD)进行显著性分析(P<0.05);所有分析图均采用GraphPad Prism 8.0软件绘制。
2 结果与分析
2.1 不同培养基下硫色曲霉的生长情况
硫色曲霉在YES、PDA、CYA、DRBC、CA 培养基上培养到第8 天时,菌落大小差异较大,颜色多呈黄、白色,孢子产量一般或极少,都有不同程度褶皱。菌落形态观察如图1-A所示。测量不同固体培养基上硫色曲霉的直径,结果如图1-B所示。
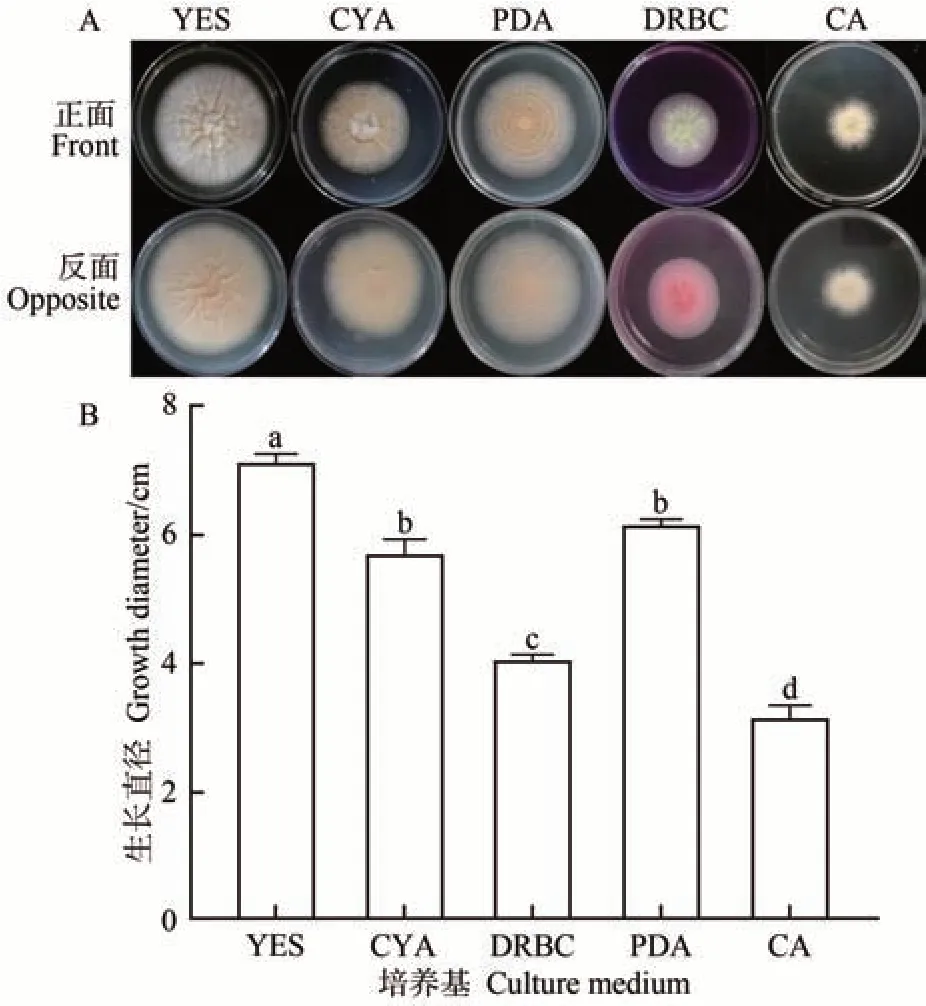
图1 硫色曲霉在不同固体培养基平板上培养8 d的生长情况Fig.1 Growth of A. sulphureus in different culture medium after incubated eight days
由表1 可知,硫色曲霉在YES 培养基上生长最快,菌落直径最大,为7.15 cm,且有褶皱,菌丝发达,适宜用于观察硫色曲霉的生长情况。硫色曲霉在PDA 和CYA 培养基上的生长速度仅次于YES 培养基,菌落直径分别为6.20 和5.75 cm,这两种培养基适用于硫色曲霉生长特性的研究,且CYA培养基孢子产量最高,适于孢子计数。硫色曲霉在DRBC和CA培养基上长势相对较慢,且无褶皱,菌落直径分别为4.10 和3.20 cm,DRBC 培养基上几乎不产生孢子,这两种培养基不适宜观察硫色曲霉的生长特性,但可用于硫色曲霉的分离和计数。
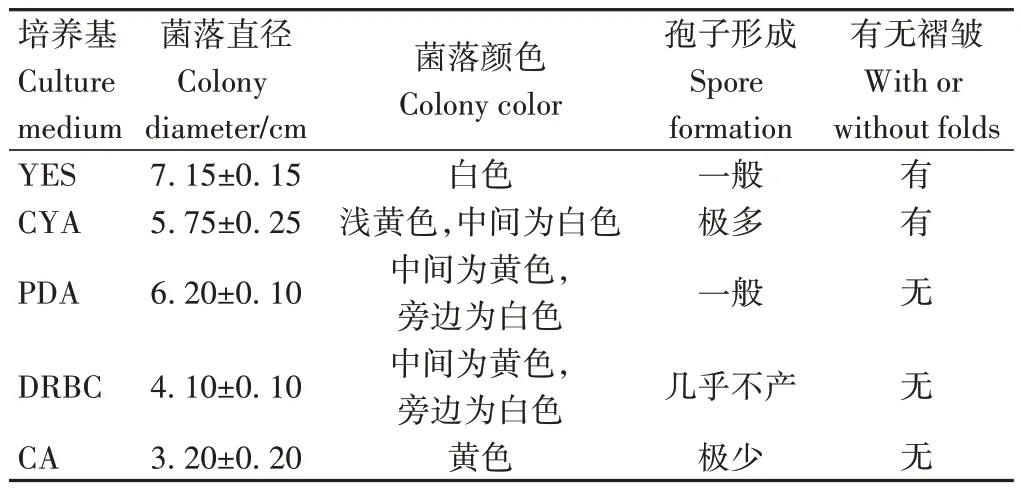
表1 硫色曲霉在不同培养基上第8天的生长情况Table 1 Growth situation of A. sulphureus on the eighth day in different medium
2.2 不同培养基上培养时间对硫色曲霉生长情况的影响
由图2-A 可知,在YES、PDA、CYA、DRBC、CA 培养基中,随着培养时间的延长,硫色曲霉的生长直径呈现逐渐增加的趋势,菌落直径越来越大,培养第8 天时,生长直径最大。由图2-B可知,随着培养时间的延长,硫色曲霉的生长速率呈现波动降低的趋势,均在第4 天时最大,此时生长最快的是YES 培基,生长速率为61%,最慢的是CA 培养基,生长速率为33%;在不同培养基上,硫色曲霉生长速率始终呈现正值,在第5、第6天时生长速率在20%~30%左右,在第7、第8天时生长速率为15%左右,在第8天时,除CA 培养基外,其他培养基的生长速率均降至最低。
2.3 不同pH值对硫色曲霉生长情况的影响
硫色曲霉在YES 培养基上有最大生长直径,因此在YES 培养基上培养硫色曲霉并观察不同pH 值对硫色曲霉生长情况的影响。培养到第8 天时,在YES 培养基上不同pH 值下硫色曲霉的生长情况如图3 所示。pH 值为4.5 时,硫色曲霉不生长,随着pH 值的增加,硫色曲霉的生长直径变大,在pH 值为8 时,有最大生长直径5.80 cm,在pH 值为10 时,生长直径又变小。表明偏中性和弱碱性环境适合硫色曲霉生长,酸性环境抑制硫色曲霉生长。

图2 硫色曲霉在不同培养基上的生长直径(A)和生长速率(B)Fig.2 Growth diameter (A) and Growth rates (B) of A. sulphureus on different media
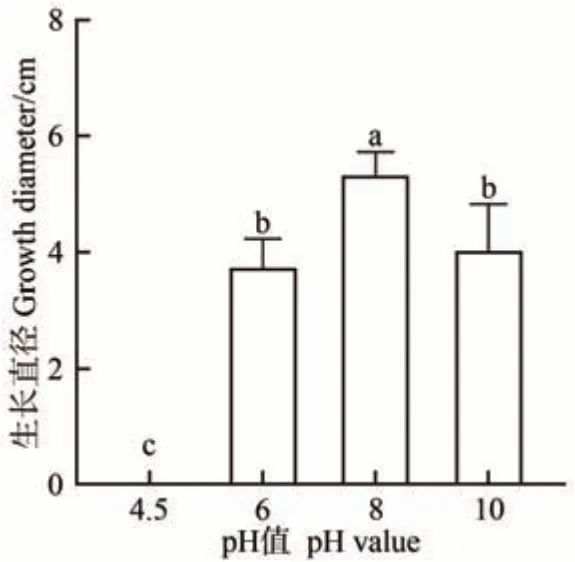
图3 在YES培养基下硫色曲霉在不同pH时培养第8天的生长直径Fig.3 Growth diameter of A. sulphureus in YES medium at different pH values after incubated eight days
2.4 不同培养基上硫色曲霉的产毒能力
硫色曲霉在不同固体培养基上的产毒差异明显,由此可知硫色曲霉的产毒条件和外界环境是密不可分的。由图4可知,培养9 d时硫色曲霉在PDA 培养基上产毒量最高,OTA 含量为10.03 mg·kg-1,这是因为PDA 培养基主要成分为马铃薯淀粉和葡萄糖,可以为硫色曲霉提供丰富的营养物质和碳源,提高其代谢产物的产量。其次是DRBC、CA 培养基上产毒量较高,OTA含量分别为6.77 和6.16 mg·kg-1,而 在CYA 和YES培养基上未检测到OTA毒素。
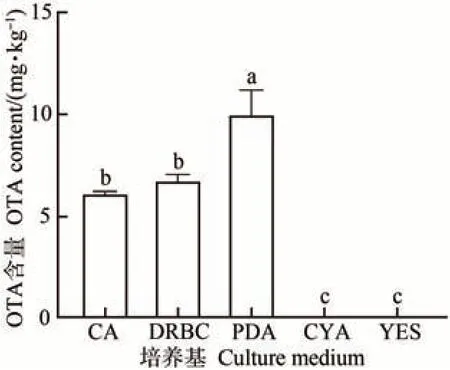
图4 硫色曲霉在不同培养基上培养第9天的OTA含量Fig.4 The OTA content of A. sulphureus in different medium after incubated nine days
2.5 不同天然培养基上硫色曲霉的产毒能力
低水分活度的天然培养基不产生毒素。为了提高培养基的水分活度,向天然培养基中加入适量的水。表2显示了加水后天然培养基上的水分活度(aw)变化,加水后24 h天然培养基上的水分活度大幅度增高,花生、玉米、小麦、水稻初始aw分别为0.26、0.34、0.33、0.33,加水3 d 后aw均稳定在0.97~0.98 范围内,水分活度基本保持不变,此时可用于研究硫色曲霉的产毒能力。
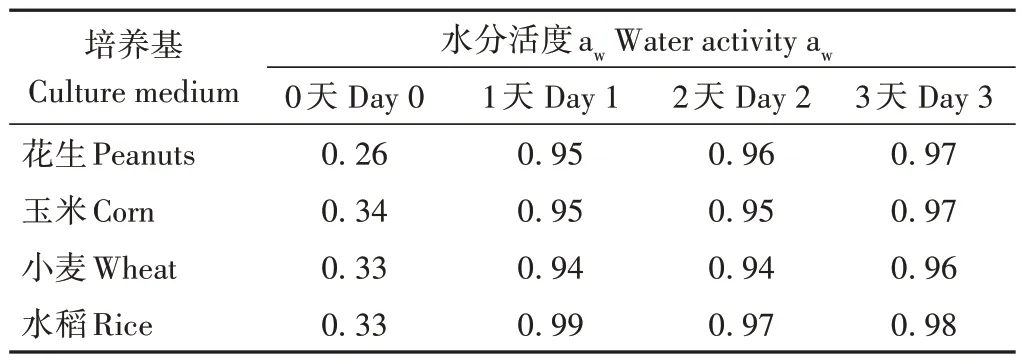
表2 天然培养基上水分活度的变化Table 2 Variation of water activity on natural media
图5 显示了培养9 d 时,硫色曲霉在不同天然培养基上的OTA 产毒能力。用花生、玉米、小麦、水稻作为天然培养基进行产毒试验,硫色曲霉在花生培养基上产毒量最高,OTA 含量为14.04 mg·kg-1;其次是小麦培养基,OTA 含量为9.02 mg·kg-1;玉米和水稻培养基上产毒基本相当,OTA含量分别为6.41和6.00 mg·kg-1。
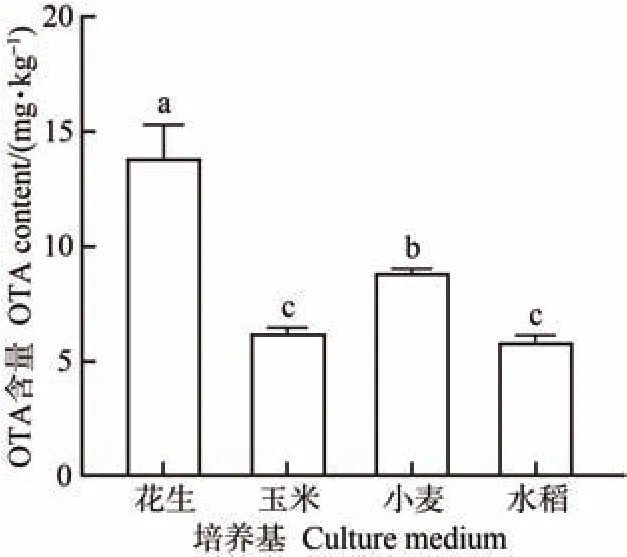
图5 硫色曲霉在不同天然培养基上培养第9天的OTA含量Fig.5 The OTA content of A. sulphureus in different natural media after incubated nine days
3 讨论
3.1 不同固体、天然培养基中硫色曲霉的生长情况
为研究硫色曲霉的生长条件和产毒情况,本研究分别在不同固体培养基、天然培养基中培养硫色曲霉,观察其菌落形态、生长速率和产毒条件,结果表明,硫色曲霉在YES 培养基上生长最好,菌丝发达,在PDA培养基上生长仅次于YES 培养基,可能是因为YES 培养基上的酵母浸膏营养丰富,含有多种有利于微生物分泌代谢产物的因子,如多肽、氨基酸、碳源、氮源和微量元素等,同时有蔗糖作为碳源,从而使硫色曲霉生长较好[33];而PDA 培养基中虽然碳源充足,但氮源与无机盐较少,故长势相对较弱,但两者均可为菌体提供充足的营养成分,用来观察硫色曲霉的生长特性。前期研究表明,硫色曲霉在YES 培养基上生长最好,因此选择YES 培养基培养硫色曲霉并改变培养基中的pH值,结果发现不同pH 中的硫色曲霉生长差异较大,在pH 值为8 时,硫色曲霉有最大的生长直径,这可能是因为环境中不同的pH值会影响到细胞膜所带的电荷,从而导致细胞对营养物质的吸收也出现差异性[34]。Akkermans 等[35]在2017 年研究了pH 对微生物生长的抑制作用,发现pH 为中性和弱碱性时,微生物的生长速率较高。这与本研究中硫色曲霉在弱碱性条件下有最大生长直径,而在酸性和碱性条件下,其菌落直径会减小的结果也较为一致。固体培养基中,硫色曲霉在PDA 培养基上产毒最佳,可能是因为PDA 培养基中含有马铃薯和葡萄糖,而马铃薯中含有淀粉、蛋白质、脂肪、粗纤维,还含有丰富的钙、磷、铁、钾等矿物质及VC、VA和B 族类维生素,营养丰富[36];其次是因为葡萄糖作为优质碳源可为硫色曲霉生长提供丰富的碳源,进而使其产毒量较高,所以PDA 是观察硫色曲霉产毒的最佳培养基。硫色曲霉在CYA 和PDA 培养基上生长较好,仅次于YES培养基,但在CYA和YES培养基上不产毒,这是因为尽管CYA培养基中所含有的碳源可以满足硫色曲霉的生长,但其培养基中所含有的硝酸钠会抑制OTA 的产生[37],所以CYA 和PDA 培养基可用于观察硫色曲霉的生长,而PDA 培养基可同时用于观察硫色曲霉的生长和产毒。
3.2 硫色曲霉在天然培养基上的产毒量比较
天然培养基不适宜观察硫色曲霉的生长情况,因为天然培养基本身的成分会对硫色曲霉DNA和RNA的提取造成影响,也不利于观察其孢子形态。硫色曲霉在天然培养基上的产毒量较高,在花生培养基上产毒量最高,可以达到14.04 mg·kg-1,小麦、玉米、水稻也会因为硫色曲霉的污染而产生赭曲霉毒素,但花生中更容易因硫色曲霉污染而产生赭曲霉毒素,这可能是由花生中脂肪、蛋白质含量最为丰富所致[38]。高婧等[39]研究不同群体密度的赭曲霉孢子侵染粮食的规律时发现,低密度和高密度赭曲霉污染花生、大豆、玉米、小麦等农作物后,花生和大豆的发芽率下降最多,说明脂肪及蛋白质含量高的粮食可能更容易受到赭曲霉的污染,这与本研究发现的硫色曲霉的侵染规律类似。
4 结论
本研究发现,固体培养基上,硫色曲霉在YES 培养基上生长最好,菌丝最发达,但不产毒,可用于观察硫色曲霉的生长特性。改变YES 培养基的pH 发现,pH 值为8 时最适宜硫色曲霉生长,偏中性和弱碱性环境适合硫色曲霉生长,酸性环境抑制其生长。在PDA培养基上的生长情况仅次于YES 培养基,同时有最高产毒量,所以PDA 培养基可用于OTA 的生长和产毒特性研究。谷物等农产品会因为硫色曲霉的污染而产生赭曲霉毒素,硫色曲霉在天然培养基上的OTA 产毒能力表现为花生>小麦>玉米>水稻。
