1-甲基环丙烯对根用芥菜贮藏品质及抗氧化性的影响
2023-09-06刘亚平林文艳狄建兵贺伟春
刘亚平 林文艳 狄建兵 贺伟春 任 纲 王 伟 王 愈
(山西农业大学食品科学与工程学院,山西 太谷 030801)
根用芥菜(Brassica junceavar. megarrhiza Tsen et Lee)为十字花科芸薹属植物[1],含有丰富的营养物质和多种生物活性成分,具有抑菌、降血脂、抗衰老、提神醒脑的作用[2],同时含有丰富的纤维素,可促进肠道蠕动[3]。由于根用芥菜生长的季节性较强,采后呼吸作用强,采摘和运输过程中容易造成机械损伤,同时在贮藏过程中极易发芽,从而加速了衰老,并造成大量营养物质的损失[4]。
迄今为止,芥菜的研究主要集中在芥菜发酵[5]、菌株分离[6]等方面,对其贮藏保鲜研究较少,且贮藏方法主要集中在传统方法,如埋法、地窖法及低温贮藏等[7]。目前各种采后保鲜方法,包括低温[8]、生化处理[9]、物理处理[10]等,已被广泛用于延缓果蔬衰老、延长保质期、保持果蔬品质。然而,这些保存方法存在一些缺点和局限性,包括低温保存时间短、物理处理成本高、化学保存可能产生潜在的危害和污染问题等[11]。1-甲基环丙烷(1-methylcyclopropene,1-MCP)是一种乙烯受体抑制剂[12]。相比于传统保鲜剂,1-MCP 具有无毒、稳定性好、易于合成、使用浓度低等优点[13],已广泛用于一系列水果和蔬菜产品的采后保鲜[14]。然而,目前关于1-MCP 处理对根用芥菜贮藏品质、发芽及抗氧化酶活性的影响机制尚不明确。本研究以晋中地区栽培较多的根用芥菜品种光头芥为试验材料,研究不同浓度1-MCP 对低温贮藏过程中根用芥菜贮藏品质、发芽率及抗氧化作用的影响,旨在确定最佳浓度,为根用芥菜的贮藏技术和采后生理研究提供依据。
1 材料与方法
1.1 材料和试剂
根用芥菜品种:光头芥,采摘于山西省晋中市太谷区,采后立即运回实验室,去除茎叶,然后将根部表面土除去,选择无机械损伤、无病虫害,大小一致的样品放置到预冷间预冷12 h。
1-MCP 泡腾片(质量分数为0.18%),台湾龙杏生技制药股份有限公司;抗坏血酸、2,6-二氯靛酚钠,江苏奥福生物科技有限公司;草酸、三氯乙酸,分析纯,天津市鼎盛化工有限公司;亚油酸、吐温20,上海源叶生物科技有限公司;聚乙烯吡咯烷酮,乌兰察布市珂玛新材料有限公司;30% H2O2,南京化学试剂股份有限公司;硫代巴比妥酸,上海弘顺生物科技有限公司;愈创木酚,济南乐奇化工有限公司。
1.2 仪器与设备
TEL-7001气体成分检测仪,北京阳光亿事达科技有限公司;DHG-9040E 电热鼓风干燥箱,上海松岛仪器有限公司;HHS-21-6 电热恒温水浴锅,上海博讯实业有限公司医疗设备厂;V-1200 型可见分光光度计,上海美谱达仪器有限公司;Cary60 UV-vis 紫外分光光度计,安捷伦科技(中国)有限公司;Centrifuge 5804R高速冷冻离心机,德国艾本德股份公司;TMS-Pro 质构仪,南京铭奥仪器设备有限公司。
1.3 试验方法
1.3.1 材料及处理方法 将芥菜随机分为4 组,每组105 个果实,对照组不做处理直接在(16±1)℃环境下密封24 h,处理组用不同浓度(1.0、1.5、2.0 µL·L-1)的1-MCP 于(16±1)℃环境下密封熏蒸处理24 h。24 h 后将对照和处理组的芥菜用0.03 mm 聚乙烯保鲜袋包装,于温度1 ℃、相对湿度65%条件下贮藏80 d,每20 d 取根用芥菜清洗干净,取中心部位测定相关指标,每个指标重复3 次。其中每组75 个芥菜,每个处理重复25个芥菜用于评估发芽。
1.3.2 呼吸强度的测定 利用气体成分检测仪测定呼吸强度(mg·kg-1·h-1),计算公式如下:
式中,M表示气体相对分子质量;N表示CO2浓度;T表示环境温度;V 表示呼吸室体积;m 表示样品质量;h表示测定时间。
1.3.3 失重率和发芽率的测定 采用称重法测定失重率[15],每组固定初始质量为m(g),20 d测定一次,计算公式如下:
式中,m1为贮藏中的质量(g)。
发芽率指用游标卡尺测量的长度大于1 mm 芽的生长情况[16],计算公式如下:
1.3.4 硬度、木质素和抗坏血酸含量的测定 使用质构仪进行硬度测试[17],单位为N。
木质素测定参照赵玉雪等[18]的硫代硫酸钠滴定法,单位为%。
抗坏血酸含量参照曹建康[19]的研究,采用2,6-二氯靛酚滴定法测定。
1.3.5 细胞膜透性和丙二醛(malonaldehyde, MDA)含量的测定 细胞膜透性参考魏雯雯等[20]的方法,采用相对电导率表示根用芥菜细胞膜透性。MDA 含量参照曹建康[19]的方法测定。
1.3.6 酯氧合酶(lipoxidase, LOX)和苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)活性的测定 LOX活性测定参照柯有剑等[21]的方法;PAL 活性测定按照索莱宝试剂盒说明书进行,单位为U·g-1。
1.3.7 过氧化氢酶(catalase, CAT)和超氧化物歧化酶(superoxide dismutase, SOD)活性的测定 CAT活性的测定参照Zhang 等[22]的方法,单位为U·g-1;SOD 活性测定按照索莱宝试剂盒说明书进行,单位为U·g-1·min-1。
1.3.8 过氧化物酶(peroxidase, POD)和抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性的测定 参照曹建康等[19]的研究采用愈创木酚比色法测定POD 活性,单位为U·g-1·min-1;APX 活性按照索莱宝试剂盒说明书进行测定,单位为U·g-1。
1.4 数据处理
采用SPSS Statistics 23 软件,利用Duncan 法进行多组样本间差异显著性分析,所有结果均用平均值±标准差表示。
2 结果与分析
2.1 1-MCP对根用芥菜呼吸强度的影响
由图1 可知,在低温环境下贮藏,随着贮藏时间的延长,芥菜的呼吸强度先迅速下降后缓慢上升。贮藏第20 天,各组芥菜的呼吸强度均达到最低值,其中1.0 µL·L-1的1-MCP 处理芥菜的呼吸强度最低,为4.79 mg·kg-1·h-1,与对照组(8.81 mg·kg-1·h-1)差异显著(P<0.05),且整个贮藏期间,1-MCP处理组呼吸强度均显著低于对照组(P<0.05)。表明1-MCP 处理可有效抑制芥菜的呼吸强度,1.0 µL·L-11-MCP 处理组的效果最佳。

图1 1-MCP 对根用芥菜呼吸强度的影响Fig.1 Effect of 1-MCP on respiratory intensity of root mustard
2.2 1-MCP对根用芥菜失重率和发芽率的影响
由图2-A可知,随着贮藏时间的延长,芥菜的失重率逐渐增加。整个贮藏期间,对照组的失重率均显著高于各处理组(P<0.05),其中1.0 µL·L-11-MCP 处理组优于其他两处理组。由图2-B 可知,贮藏40~80 d 1-MCP处理显著抑制了芥菜的发芽率(P<0.05)。贮藏第80 天时,对照组发芽率分别是1.0、1.5、2.0 µL·L-11-MCP 处理组的4.6、3.2、2.8 倍。其中,1.0 µL·L-11-MCP处理组发芽率显著低于1.5、2.0 µL·L-11-MCP处理组(P<0.05)。表明1-MCP 处理对芥菜的失重率和发芽率有明显的抑制作用,其中1.0 µL·L-11-MCP 处理组抑制效果最好。

图2 1-MCP 对根用芥菜失重率 (A) 和发芽率 (B) 的影响Fig.2 Effect of 1-MCP on weight loss (A) and germination rate (B) of root mustard
2.3 1-MCP 对根用芥菜硬度、木质素和抗坏血酸含量的影响
由图3-A 可知,在贮藏过程中芥菜硬度整体呈现下降趋势。其中0~60 d,芥菜硬度呈先下降后上升的趋势,在第40 天达到最低值,此时对照组硬度显著低于1.0、1.5 µL·L-11-MCP处理组(P<0.05)。由图3-B可知,芥菜的木质素含量在贮藏过程中呈上升趋势,整个贮藏期1.0 µL·L-11-MCP 处理组木质素含量显著低于对照组(P<0.05)。抗坏血酸是果蔬机体内重要的营养成分之一,其含量也是反映果蔬贮藏情况的重要参考[23]。由图3-C 可知,在贮藏期间,芥菜的抗坏血酸含量呈下降趋势,其中0~20 d,对照芥菜的抗坏血酸损失最多,与鲜样相比损失率高达30.4%,而1.0、1.5、2.0 µL·L-11-MCP处理组的损失率分别为13.0%、18.8%、22.2%。整个贮藏期间,各处理组与对照组均存在显著差异(P<0.05),其中1.0 µL·L-11-MCP 处理组抗坏血酸含量显著高于其他两处理组(P<0.05)。表明1-MCP处理可以有效维持芥菜抗坏血酸含量。
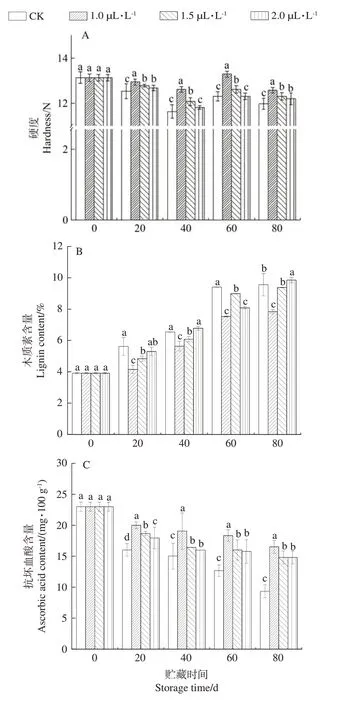
图3 1-MCP对根用芥菜硬度(A)、木质素(B)和抗坏血酸含量(C)的影响Fig.3 Effect of 1-MCP on hardness (A),lignin (B) and ascorbic acid content (C) of root mustard
2.4 1-MCP 对根用芥菜细胞膜透性和MDA 含量的影响
植物组织的相对电导率反映了细胞膜的损伤程度。由图4-A可知,随着贮藏时间的延长,芥菜的相对电导率整体呈增加趋势。与鲜样相比,贮藏第80 天时,芥菜的相对电导率分别上升了3.9、0.7、1.1、1.8个百分点。与对照相比,1-MCP 处理显著抑制了芥菜相对电导率(P<0.05),而各1-MCP处理组之间差异不显著(P>0.05)。由图4-B 可知,贮藏过程中,各组芥菜MDA含量均呈现先上升后下降的趋势。贮藏第60天时,各组芥菜MDA 含量达到高峰,其中1.0 µL·L-1和1.5 µL·L-1处理组的MDA 含量较低,为0.083、0.084 µmol·g-1,显著低于对照组(0.11 µmol·g-1) (P<0.05)。表明1-MCP处理可以缓解芥菜细胞膜损伤。

图4 1-MCP对根用芥菜相对电导率 (A)和丙二醛含量(B)的影响Fig.4 Effect of 1-MCP on relative electrical (A) and MDA content (B) of root mustard
2.5 1-MCP对根用芥菜氧化酶活性的影响
2.5.1 LOX 和PAL 活性 LOX 是引起果蔬采后衰老的酶之一,能反映果蔬贮藏的衰老进程[24]。由图5-A可知,采后贮藏期芥菜LOX 活性整体呈现上升趋势,0~40 d,对照组LOX 活性快速上升,40 d 后缓慢上升,而1-MCP 处理组在整个贮藏期间均缓慢上升,但整体显著低于对照组(P<0.05)。PAL参与木质素的合成和积累,随着PAL 活性的增加,木质素含量增加[25]。由图5-B 可知,芥菜PAL活性呈先上升后下降的趋势,贮藏第20 天时,各组芥菜PAL 活性达到峰值,其中对照组PAL 活性最高,为11.71 U·g-1,其次是2.0 µL·L-1(10.41 U·g-1)、1.5 µL·L-1(10.36 U·g-1)1-MCP 处理组,1.0 µL·L-11-MCP 处理组的PAL 活性最低,为9.84 U·g-1。直到贮藏结束,各处理组芥菜PAL始终低于对照组,且与对照组之间差异显著(P<0.05)。

图5 1-MCP对根用芥菜脂氧合酶活性 (A) 和苯丙氨酸解氨酶活性(B)的影响Fig.5 Effect of 1-MCP on LOX activity (A) and PAL activity (B) of root mustard
2.5.2 CAT 和SOD 活性 CAT 可促使H2O2分解为氧和水,从而使细胞免遭H2O2的毒害,是生物防御体系的关键酶之一[26]。由图6-A 可知,对照组和1-MCP 处理组芥菜CAT 活性变化趋势一致,均随贮藏时间延长呈下降趋势。在贮藏第20 和第80天时,1.5 µL·L-1和2.0 µL·L-11-MCP 处理组CAT 活性显著高于对照组,在贮藏40~60 d,两组CAT 活性高于对照组,但差异不显著(P>0.05),而1.0 µL·L-11-MCP 组整个贮藏期芥菜CAT 活性始终显著高于对照(P<0.05)。SOD 是植物体内重要的抗氧化酶,可催化O2-生成无毒害的H2O和O2,防止细胞的脂膜过氧化及内容物的渗漏,延缓衰老[27]。由图6-B 可知,随着贮藏时间的延长,芥菜的SOD 活性呈现先上升后下降的趋势,整个贮藏期间1-MCP 处理组SOD 活性均显著高于对照组(P<0.05),其中1.0 µL·L-11-MCP 处理组的SOD 活性始终显著高于其他两处理组(P<0.05)。

图6 1-MCP对根用芥菜过氧化氢酶活性(A)和超氧化物歧化酶活性(B)的影响Fig.6 Effect of 1-MCP on CAT activity (A) and SOD activity (B) of root mustard
2.5.3 POD 和APX 活性 POD 具有清除细胞内过氧化物的作用,可将过氧化氢分解为对细胞无伤害的水和氧气,同时也是植物酶性保护系统的主要成分之一[28]。由图7-A 可知,在贮藏期间,芥菜POD 活性整体呈现先上升后下降的趋势。在贮藏20 d时,各组芥菜POD 活性达到峰值,之后呈下降趋势,其中1.0 µL·L-11-MCP 处理组活性最高,为259.75 U·g-1;其次是1.5 µL·L-11-MCP 处理组,为208.98 U·g-1,最低的是对照组,为118.48 U·g-1。整个贮藏期,1.0 µL·L-11-MCP 处理组POD 活性显著高于其他处理组(P<0.05)。APX 是清除活性氧的重要抗氧化酶之一,也是抗坏血酸代谢的关键酶之一[29],可以延缓果蔬衰老。由图7-B 可知,芥菜的APX 活性整体呈下降趋势。0~20 d,各组APX 活性快速下降,与对照组相比,处理组变化幅度较缓。之后,对照组APX 活性变化趋于平缓,而处理组呈上升趋势。整个贮藏期1-MCP 处理组APX 活性显著高于对照组(P<0.05),其中1.0 µL·L-11-MCP处理组APX活性最高。
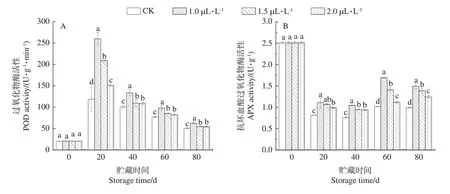
图7 1-MCP对根用芥菜过氧化物酶活性 (A)和抗坏血酸过氧化物酶活性(B)的影响Fig.7 Effect of 1-MCP on POD activity (A) and APX activity (B) of root mustard
2.6 基于PCA 对不同浓度根用芥菜贮藏品质和抗氧化的区分
为了更大限度地区分组间差异,分别选取了贮藏初期(0 d)、中期(40 d)和末期(80 d)3个有代表性、间隔较远的贮藏时间进行主成分分析。图8 为对照和1-MCP处理组在不同贮藏时间下芥菜贮藏品质和抗氧化主成分分析(principal components analysis,PCA)得分图,其中第1主成分的贡献为57.4%,第2主成分的贡献为31.4%,累计贡献率为88.8%。对照组分布在横坐标正半轴,而鲜样和1-MCP 处理组分布在横坐标的负半轴,表明对照组和处理组分离效果较好,差异性较大。

图8 不同浓度1-MCP处理根用芥菜的PCA得分Fig.8 PCA of root mustard treated with different concentrations of 1-MCP
3 讨论
根用芥菜属于根菜类蔬菜,其水分含量较高、呼吸代谢旺盛,在贮藏期间容易失水和发芽,加速衰老进程,降低其商品价值[17]。据报道,蔬菜发芽与乙烯含量有关,乙烯可以促进发芽[30]。1-MCP 是一种乙烯受体抑制剂[31],已广泛应用于一系列的果蔬的采后贮藏[32]。萌发是一个伴随着呼吸作用增强的复杂生理过程[33-35]。本研究中,采后芥菜呼吸强度旺盛,随着田间热散去,呼吸强度减弱,但随着贮藏时间的延长,根用芥菜呼吸强度增加,这可能是由芥菜发芽所致。经1-MCP 处理的光头芥呼吸强度和发芽率显著低于对照组,其中1.0 µL·L-11-MCP处理最低,这与Luo等[36]和苑宁等[37]的研究结果一致。失重率和硬度是判断果蔬品质最直观的指标,而果实软化是因为原果胶酶将原果胶分解为果胶[38]。本研究发现,1-MCP 处理组的根用芥菜失重率和硬度显著低于对照组。此外,前人对鲜切山药[37]和苹果[39]的研究表明,1-MCP可以通过降低多醛酸和中性糖的增溶作用来限制细胞壁水解活性,维持果实细胞壁果胶含量和硬度,延缓其软化过程,这些结果也证实了本研究的结论。
MDA 作为膜脂过氧化的重要产物,可以一步破坏生物膜,而LOX 是引起膜脂过氧化的关键酶,在降解过程中产生活性氧(reactive oxygen species,ROS),其中LOX活性的升高会促使MDA积累,加速果实衰老和成熟[40]。李辉等[41]研究表明,1-MCP 可以抑制LOX活性,进而减少MDA 的积累。本研究发现,芥菜MDA含量和LOX 活性呈上升趋势,这是因为芥菜器官随着贮藏时间的延长不断衰老,造成细胞膜脂过氧化。与对照组相比,1-MCP 能够抑制芥菜LOX 活性、减少MDA 的积累,其中1.0 µL·L-11-MCP 处理组优于其他1-MCP 处理组。ROS 的积累会引起细胞氧化损伤,最终导致植物衰老。同时在种子发芽期间,ROS 参与缓解休眠和种子萌发,抑制ROS 的产生可以延缓发芽[42]。CAT、SOD、POD和APX等抗氧化酶是清除植物体内ROS 的关键酶,其中SOD 可以将O2-转化为H2O2,H2O2可以进一步通过POD、CAT 和APX 分解为H2O 和O2[43]。据报道,1-MCP 处理可以增加果蔬CAT、SOD、POD 和APX 活性,抑制ROS 的产生,从而延缓果蔬衰老,抑制发芽,延长贮藏期[32,44-45]。本研究发现,芥菜CAT 和APX 活性整体随贮藏时间的延长而不断下降,可能是由于芥菜衰老导致过氧化氢不断积累,当积累量达到一定程度未及时清除,就可能抑制CAT 和APX的活性。贮藏期间芥菜POD 和SOD 活性呈上升趋势,这可能是由于采后芥菜活性氧失衡,不断产生超氧阴离子自由基,从而诱导POD 和SOD 活性增加。与对照相比,1-MCP 处理芥菜CAT、SOD、POD 和APX 的活性处于较高水平,降低了发芽率,表明1-MCP 可以通过增加ROS 代谢酶的活性来减少ROS 的积累,降低芥菜块茎的发芽率,从而延缓其衰老。
4 结论
本研究利用1.0、1.5、2.0 µL·L-11-MCP 处理根用芥菜,结果发现,与对照相比,1-MCP 处理降低了芥菜失重率、木质素含量,抑制了呼吸强度,保持了较高的硬度和抗坏血酸含量,同时抑制了LOX 和PAL 活性,减少了细胞渗透率和MDA 含量的积累,提高了CAT、SOD、POD 和APX 活性,降低了芥菜的发芽率,从而延缓了其衰老,其中1 µL·L-11-MCP的效果最佳。
