酶解-磷酸化协同改性对猪血红蛋白功能特性和结构的影响
2023-09-06苏克楠刘丽莉王梦雨
苏克楠 刘丽莉 杨 乐 王梦雨
(河南科技大学食品与生物工程学院/食品加工与安全国家级教学示范中心/食品加工与质量安全控制河南省国际联合实验室,河南 洛阳 471023)
猪血中富含蛋白质、维生素、氨基酸、矿物质和酶等生物活性物质,其中猪血红蛋白(porcine hemoglobin,Hb)为主要部分,占全蛋白含量的75%[1]。目前我国对猪血资源的利用主要分为两部分,一小部分是以血粉形式供做动物饲料,但大部分都被遗弃。由于猪血红蛋白敏感易变性的特性,开发新的、高附加值的产品较为困难,并且与猪血相关的产品都比较单一,这在一定程度上造成了我国猪血资源利用率低的现状。因此,选择合适的技术对其加以改良成为亟待解决的问题。
通过对蛋白质进行修饰改性可改善蛋白质的功能特性,使其适用于工业化生产。因其具有良好的功能特性也可将其作为食品添加剂应用在食品加工中。蛋白质的改性方法[2-4]主要有三大类,分别是物理改性、化学改性、生物改性。其中酶法改性较为温和、简便,并且因其可以改变蛋白质的功能结构而运用较多。姚伦欢等[5]采用多种酶对猪血红蛋白的酶解进行了研究,认为胰蛋白酶水解脱色的效果更好,可用于调整食品的口感以及强化营养成分。郭善广等[6]对猪血红蛋白进行脱色酶解改性处理后发现,在适宜的酶解程度下,猪血红蛋白乳化性能显著提升。吴素娟等[7]对猪血红蛋白进行酶解改性并从分子层面进行分析,发现水解过程中蛋白质会暴露出更多的疏水基团,从而使多肽在空气-水界面上的融合速率和吸附能力得到提升,且溶解性与乳化性能呈现正相关关系。马露燕等[8]通过湿法糖基化反应制备豌豆蛋白-低聚木糖复合物,发现其乳化特性及乳化稳定性有极大提升。不同的改性方法可以改善蛋白质不同的功能特性,采用两种改性方法协同改性,会对蛋白质的多个功能特性有显著影响[9]。将糖基化和亚硝基改性组合后,运用到肉肠中可以改善色泽,起到降低亚硝酸盐残留的作用,可考虑作为天然色素替代亚硝酸钠在肉制品中的使用[10]。将糖基化和酰基化结合起来协同改性,可以改善蛋白质的功能特性,且改性的蛋白质稳定性与糖基化的糖源有关[11]。使用磷酸化亚硝基协同改性处理血红蛋白后,发现其具有亚硝基改善色泽的效果,也具有磷酸化的增加保水性的效果[12-13]。此外,磷酸化改善蛋白质功能特性的效果与使用的磷酸盐有关,Ma等[14]研究了三聚磷酸钠(sodium tripolyphosphate,STP)对亚硝基血红蛋白的磷酸化修饰及其对蛋白质结构和稳定性的影响,发现STP 处理过的亚硝基血红蛋白稳定性得到极大提升,有利于探究蛋白质在极端条件下的应用。上述研究表明,协同改性综合了两种单一改性的优点,是一种较为理想的改性方法。
国内外研究大多运用单一改性的方式改善猪血红蛋白质的功能特性,使用协同改性的方法对猪血红蛋白进行改性的研究较少。河南科技大学食品生物技术与畜禽及其副产物的综合加工利用实验室主要进行畜禽副产物精深加工与综合利用的研究。前期针对鸡蛋卵白蛋白协同改性进行了大量研究,结果表明卵白蛋白的功能特性经协同改性后得到增强[15-16],证明协同改性可以改善蛋白的功能特性。酶法改性条件温和,同时磷酸化反应可以增强蛋白质的功能特性[17-20],因此本研究采用酶解-磷酸化协同改性的方法对猪血红蛋白(porcine haemoglobin,Hb)进行改性,探究酶解-磷酸化协同改性猪血红蛋白(phosphorylated porcine haemoglobin,HP-Hb)的功能特性和结构特性的变化,旨在为蛋白质的协同改性提供试验依据,同时拓宽猪血红蛋白在食品工业中的应用。
1 材料与方法
1.1 材料与试剂
猪血红蛋白,伊卡试剂主营店,南京;三聚磷酸钠,武汉生物试剂商城;氢氧化钾,西陇试剂厂;磷酸氢二钠、磷酸二氢钾,方正试剂厂,天津;KBr,天津化工研究所;碱性蛋白酶,隆科特酶制剂有限公司,山东。均为分析纯。
1.2 仪器与设备
YRLG-10A 型真空冷冻干燥机,德国CHRIST 公司;H1850离心机、LC-LX-H165A 型均质机,安徽力辰科技公司;RSA5065-TG 型FT-IR 红外光谱仪,北京VNA 矢量网络公司;N9010A 型差示扫描量热仪,深圳弗布斯公司;XSP-H1600 型电子扫描显微镜,湖南奥斯维公司;SN-CJB-M1 磁力搅拌器,浙江艾科仪器设备有限公司。
1.3 试验方法
1.3.1 HP-Hb的制备 取Hb配置成5%的溶液,调节pH 值至8.2,碱性蛋白酶的添加量为5 500 U·g-1,在恒温水浴锅中以52.5 ℃的温度反应5 h。反应结束后,将反应物置于90 ℃的水浴锅中加热5 min,使酶钝化,冷却至室温,4 500 r·min-1离心10 min,取上清液冷冻干燥,得到猪血红蛋白肽(enzyme digestion of porcine haemoglobin,H-Hb)。
取上述H-Hb 溶于0.02 mol·L-1pH 值7.4 的磷酸盐缓冲溶液中,配制成1 g·100 mL-1的蛋白质溶液,调节pH 值至8.0,添加9%的STP,在磁力搅拌器上保持恒温30 ℃搅拌4 h,得到HP-Hb溶液,透析脱盐除酶后冷冻干燥备用。
1.3.2 HP-Hb、H-Hb和Hb功能特性的测定
1.3.2.1 溶解度的测定 参考彭倩[21]的方法测量溶解度(solubility,S),凯氏定氮法测定含氮量。氮溶解指数(nitrogen soluble index,NSI)计算公式如下:
式中,N0为样品中总氮含量(mg·mL-1);N1为溶于2%的KOH上清液氮含量(mg·mL-1)。
1.3.2.2 乳化特性的测定 参考张根生等[22]的方法测定乳化活性指数(economic access index,EAI)和乳化稳定性指数(environmental sustainability index,ESI)。相关计算公式如下:
式中,A0、A10为乳浊液在0、10 min 的吸光值;φ 为油相体积分数(油的体积/乳浊液的体积,%);ρ 为蛋白质质量浓度(g·mL-1)。
1.3.2.3 起泡性的测定 参考占福朝[23]的方法测定蛋白溶液起泡性指数(foamability index,FAI)和起泡稳定性指数(foam stability index,FSI)。相关计算公式如下:
式中,H0为起始高度;H1为10 000 r·min-1均质2 min后的高度;H2为静置10 min后再次记录的高度。
1.3.3 HP-Hb、H-Hb 和Hb 的结构特性分析 (1)傅里叶红外光谱(fourier transform infrared spectrometry,FT-IR):将KBr 于50 ℃干燥12 h,分别与Hb、H-Hb、HP-Hb 冻干样按质量比100∶1 混合研细,压片后制成透光片,设置为400~4 000 cm-1波长区间进行扫描。
(2)差示扫描量热仪(differential scanning calorimetry,DSC):称量(5.0±0.1)mg 的Hb、H-Hb、HP-Hb 于铝坩埚中,3 组样品的温度范围为30~300 ℃,参数设置为10 ℃·min-1,做空白对照组和重复3次试验。
(3)扫描电镜(scanning electron microscope,SEM)分析:制样后,设置参数放大1 000 倍,加速电压为20 kV,观察样品微观结构。
1.4 数据分析
试验所涉及的测定结果均做3 次重复,利用OMIC、Origin2021软件进行统计分析。
2 结果与分析
2.1 协同改性前后Hb的功能特性分析
2.1.1 溶解性分析 由图1可知,HP-Hb在偏酸性和偏碱性的时候溶解度较大,在pH 值为4.0~5.0 时溶解度较低。Hb 和H-Hb 在pH 值5.0~6.0 之间溶解度最低,与其等电点相差不大。当pH值与等电点相差较小时,蛋白质与水分子间的力所带净电荷最少,且易形成聚集体,相互作用力也最小,易形成蛋白质沉淀[24]。在pH 值>4.8时,Hb和H-Hb的溶解度均小于HP-Hb,可能是由于磷酸化处理引进了磷酸根基团,这些磷酸根基团可与水结合形成氢键,导致整个蛋白质体系电负性增加,蛋白质分子之间的静电斥力提高,使其体系更加分散,溶解性更大。这与张功圣[25]对大豆蛋白进行多糖糖基化修饰所得到的结论一致,说明酶解-磷酸化协同改性有效提高了Hb的溶解性。
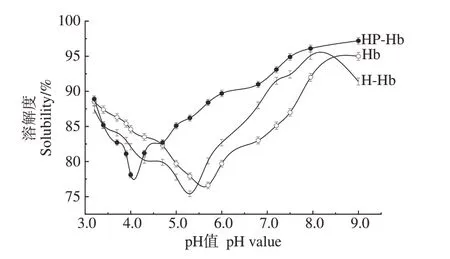
图1 Hb、H-Hb和HP-Hb的溶解性随pH的变化Fig.1 Changes of solubility of Hb,H-Hb and HP-Hb with pH
2.1.2 乳化性和乳化稳定性分析 由图2 可知,乳化活性指数表现为HP-Hb(43.39 m2·g-1)>H-Hb(49.51 m2·g-1)>Hb(55.81 m2·g-1)(P<0.05);乳化稳定性表现为HP-Hb(55.14%)>H-Hb(58.47%)>Hb(61.51%)(P<0.05)。猪血红蛋白肽肽链在酶解后打开,结合油滴的能力增强,肽中疏水基团也增加,亲水基团进入水相增多,相比Hb,H-Hb 的乳化能力变强。这可能是由于磷酸基团会增强液滴之间斥力,体现亲油性,暴露疏水基团,磷酸化及磷酸基团嵌入后,蛋白质分子在界面的扩散重排速度加快,乳化性增强[26]。蛋白质的溶解性与乳化活性和乳化稳定性有着一定关系,溶解性增强使乳化活性和乳化稳定性增强,向水油界面扩散的能力增强[27]。

图2 Hb、H-Hb和HP-Hb的乳化性和乳化稳定性分析Fig.2 Emulsifiability and emulsifying stability analysis of Hb,H-Hb and HP-Hb
2.1.3 起泡性和泡沫稳定性分析 由图3 可知,起泡性表现为HP-Hb(59.41%)>H-Hb(55.48%)>Hb(51.82%)(P<0.05);起泡稳定性表现为HP-Hb(59.12%)>H-Hb(61.57%)>Hb(65.99%)(P<0.05)。分析原因,可能是酶解后的H-Hb 链结构打开,蛋白质部分肽链在界面上通过肽键相互作用形成了二维保护网络,使得界面膜得以加强,促进泡沫的形成与稳定[28]。磷酸化后在蛋白分子中引入带负电荷的磷酸基团,提高了水/气界面电荷,形成了致密的电负性界面层,从而构成空间屏障抑制泡沫间的聚集,进而提高了泡沫稳定性。蛋白质的高溶解度是具有良好起泡性和起泡稳定性的先决条件[29],HP-Hb的溶解度大幅度增加,等电点前移,在等电点时,分子间的静电吸引作用使吸附在气液界面上的薄层厚度和硬度增大,起泡稳定性增大。

图3 Hb、H-Hb和HP-Hb的起泡性和起泡稳定性分析Fig.3 Analysis of foaming ProPerty and foaming stability of Hb,H-Hb and HP-Hb
2.2 协同改性前后Hb的结构分析
2.2.1 傅里叶红外光谱分析 由图4 可知,Hb、HHb、HP-Hb 的红外光谱图存在差异,说明三者的结构产生变化。酰胺Ⅰ带(3 400~3 200 cm-1)中,HP-Hb 有特征吸收,HP-Hb 与H-Hb 和Hb 相比峰位红移,且酰胺Ⅰ带可能是C—O 的伸缩振动或N—H 之间的氢键,原因是猪血红蛋白肽中的肽链断裂,肽上的-NH 与葡聚糖发生羰基反应,影响了C—O 的伸缩振动,从而使酰胺Ⅰ带处的峰发生了位移。1 330~1 220 cm-1为酰胺Ⅲ带,HP-Hb在此处吸收峰红移,这是因为H-Hb和三聚磷酸钠反应,产生了共价键结合。PO43-的红外特征吸收峰在1 100 cm-1左右,P—N的吸收峰在500 cm-1[30]。HP-Hb 在1 100、500 cm-1处有较大吸收峰,说明改性后磷酸根接入蛋白质,且连接到N 原子上。HP-Hb 在900 和700 cm-1处的吸收峰与500 cm-1处峰的增加有关,原因可能是与三聚磷酸钠反应后,磷酸根增加,负电荷升高,所以吸收峰发生了偏移,透光率也发生了变化,产生了新的吸收峰。
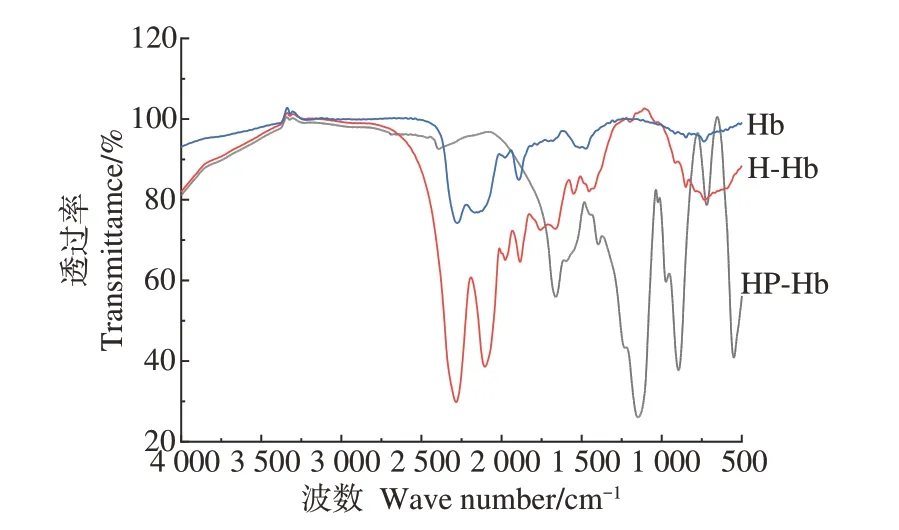
图4 Hb、H-Hb和HP-Hb的FT-IR分析Fig.4 The FT-IR analysis of Hb,H-Hb and HP-Hb
2.2.2 差示扫描量热分析 由图5 可知,Hb、H-Hb和HP-Hb均出现了放热峰,热变性温度表现为HP-Hb(86.90 ℃)>H-Hb(72.90 ℃)>Hb(66.23 ℃),原因是温度过高时,蛋白质会产生由于变性导致的分子构象变化。同时,氨基酸的组成也会影响蛋白质的热稳定性,与亲水性氨基酸相比,疏水性氨基酸的蛋白质稳定性较强。而且蛋白质变性需要热能大于分子间氢键的结合能,由于酶解破坏了Hb 的球状结构,分子间的疏水基被释放出来,同时磷酸基团的大量接入增强了分子间的离子相互作用,其变性所需热能增加,则HPHb 热稳定性增强,由此说明酶解-磷酸化协同改性提高了猪血红蛋白的热稳定性。

图5 Hb、H-Hb和HP-Hb的DSC分析Fig.5 DSC analysis of Hb,H-Hb and HP-Hb
2.2.3 SEM 分析 由图6-A 可知,Hb 经过预冷冻后再进行真空冷冻干燥,为块状蛋白,表面光滑;由图6-B可知,H-Hb 因肽键断裂,结构上遭到了破坏,形成薄片状结构,并有不规则的碎片;由图6-C 可知,Hb 经过酶解-磷酸化协同改性处理后,微观结构发生了较为明显的变化,由于磷酸根和蛋白结合,使蛋白的结构发生了变化,形成了堆叠的块状结构,周围有较小的颗粒杂乱分布。

图6 Hb、H-Hb和HP-Hb的扫描电子显微镜图(×1 000)Fig.6 Scanning electron micrographs of Hb,H-Hb and HPHb(×1 000)
3 讨论
本研究通过对猪血红蛋白进行酶解-磷酸化协同改性处理,发现协同改性后的功能特性得到很大提升。蛋白质的功能特性与其结构相关,功能特性中的溶解性又直接影响到乳化性和起泡性。原因是蛋白质的溶解度可反映其等电点,酶解后的猪血红蛋白肽链打开,蛋白颗粒粒径和疏水性降低,等电点前移,蛋白质在水中所带电荷较大,不易形成聚集体和蛋白沉淀。在实际生产中,溶解度较高的蛋白质表现出更好的理化特性,更加占优势。蛋白质的乳化性、乳化稳定性与蛋白质的溶解度之间存在一定的相关关系,不溶性的蛋白质对蛋白乳化无影响,溶解性是蛋白质具有乳化性的先决条件,只有具有溶解性,蛋白质才具有向油水界面扩散的能力[31]。磷酸化可在猪血红蛋白分子中引入带负电荷的磷酸基团,提高了气/水界面电荷,形成结构致密的电负性界面层,从而构成有效的空间屏障抑制泡沫间的聚集,进而提高泡沫稳定性。彭倩等[32]发现,猪血红蛋白的溶解性、乳化性能和起泡性能在磷酸化处理后显著提升;李逢振[3]发现酶解处理后的猪血红蛋白的功能特性得到明显提升。本研究采取酶解-磷酸化协同改性处理猪血红蛋白,发现协同改性具备了酶解以及磷酸化改性后的优点,并且两种改性可能具有相互促进的作用。功能特性的变化也与结构上的变化密切相关。磷酸化改性后,反应产生共价结合,磷酸根的接入增强了溶液的电负性,使红外谱图中的峰发生了偏移,而产生了共价作用后,蛋白质变性所需的肽键断裂的能量增加,更加不易断裂,热变性温度升高,热稳定性增强。
在实际生产中,食品企业主要是利用猪血红蛋白的护色作用、保水性能、乳化性能。护色作用主要依靠猪血红蛋白本身的颜色,而协同改性后的猪血红蛋白热稳定性升高,护色效果更好;保水性主要应用在肉糜、肉块,磷酸化后的保水性能增强;乳化性能主要应用在肉肠,有相关研究发现将血红蛋白修饰后加入香肠中可以改善乳化性,增强色度,有一定抑菌作用[33];酶解后1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH)清除率高于猪血红蛋白[34]。本研究发现协同改性后的猪血红蛋白溶解性、乳化性能和起泡性能得到增强,推测其抑菌作用和抗氧化作用也会发生变化,需要在后续研究中进一步证实。
4 结论
本研究以猪血红蛋白肽和猪血红蛋白为对照,对酶解-磷酸化协同改性猪血红蛋白的功能特性及结构变化进行了研究,发现与H-Hb 和Hb 相比,HP-Hb 的溶解度呈现优势,乳化性能和起泡性能也有显著提升;结构分析表明,Hb-Hb 的热稳定性增强,分子结构由紧密的块状结构变成了松散的块状结构,该结构能够结合更多的磷酸根基团,有利于更好地发挥其功能特性。因此,酶解-磷酸化协同改性对猪血红蛋白的功能特性有明显提升,这为协同改性在蛋白中的应用以及猪血红蛋白在食品工业中的应用提供了理论基础及参考。
