FLS基因调控玉兰与紫玉兰花色形成的机制研究
2023-09-06戴梦怡石从广任明杰马晶晶申亚梅
吴 超 戴梦怡 张 超 石从广 任明杰 马晶晶,* 申亚梅,*
(1浙江农林大学风景园林与建筑学院,浙江省园林植物种质创新与利用重点实验室,浙江 杭州 311300;2浙江省林业科学研究院,浙江 杭州 310023)
玉兰属(Yulania)植物是园林绿化中应用广泛的观花植物,该属植物花色丰富,主要有白色、紫色、红色、黄色、粉红色等。特异花色是玉兰属植物最重要的观赏形状之一,也是玉兰属新品种改良及培育的重要目标之一。影响植物花色的色素主要有三类:类黄酮、类胡萝卜素和甜菜碱[1]。类黄酮是影响花色的主要物质,自然界中已经发现了超过10 000种类黄酮化合物,根据其结构性质可以分为6 个亚类:黄烷酮类、黄酮类、异黄酮类、黄酮醇类、原花青素类和花青素类[2-3]。玉兰属植物花被片中影响花色的类黄酮化合物包含2 种花青素苷元(矢车菊素和芍药花素)和3 种黄酮醇苷元(鼠李糖苷、葡萄糖苷和芦丁糖苷)[4]。进一步研究发现,矢车菊素和芍药花素分别使玉兰属植物花被片呈现紫红色和紫色,而黄酮醇作为一种助色素,发挥辅助着色作用[5-6]。
黄酮醇代谢途径起始于苯丙氨酸,是类黄酮化合物代谢途径的一个分支[7]。黄酮醇合成酶(flavonol synthase,FLS)是重要的节点酶,与二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase,DFR)竞争共同底物二氢黄酮醇,影响黄酮醇合成支路对代谢流的竞争能力,进而影响黄酮醇的积累[8]。当类黄酮代谢流主要流向黄酮醇合成支路时,会极大影响花青素苷合成支路,造成花青素苷的积累过少,引起花色变化[9-10]。Holton 等[11]在矮牵牛(Petunia hybrida)中首次克隆出FLS基因,发现反义表达能显著减少花瓣中黄酮醇含量,花瓣颜色明显加深;在烟草(Nicotiana tabacum)中转录后沉默PhFLS基因,黄酮醇含量减少25%~93%[12]。在其他物种中FLS的功能得到进一步验证,如王族海棠(Malus spectabilisRoyalty)和火焰海棠(M.spectabilisFlame)叶片中瞬时过表达McFLS基因,黄酮醇含量显著上升,花青素含量显著下降[13];在苹果(Malus domestica)愈伤组织中过表达MdFLS1显著增加了黄酮醇含量,而花青素含量明显降低[14]。玫瑰(Rosa rugosa)RrFLS1[15]、桃(Prunus persica)PpFLS[15]、茶(Camellia sinensis)CsFLS[16]、菊花(Chrysanthemum morifolium)CmFLS[17]、杨梅(Myrica rubra)MrFLS[18]在烟草中过表达,烟草花冠颜色变浅,黄酮醇含量显著增加,花青素苷含量明显减少。由此可见,FLS基因具有调控植物组织黄酮醇积累的功能,从而影响花青素苷合成支路的代谢流分配,在植物组织的呈色机制中发挥重要作用[19]。
目前对玉兰花色调控机制的研究主要集中于花青素苷[5-6,20],而黄酮醇的相关研究鲜有报道。因此,本研究通过测定玉兰和紫玉兰花被片黄酮醇含量变化,并对黄酮醇合成途径关键结构基因FLS的表达模式及功能进行分析,以期为木兰科植物花色形成机制及新品种选育提供理论依据。
1 材料与方法
1.1 试验材料
选择浙江省杭州市浙江农林大学东湖校区25 年生玉兰与紫玉兰实生苗为试验材料。分别于2020 年2—9 月陆续采集玉兰和紫玉兰花蕾期、露色期、初开期、半开期、盛开期的最外轮的花被片(图1)及老叶、嫩叶、茎和根。采集材料后立即放入液氮中,再转移到-80℃冰箱中保存。每份样品取3个生物学重复。

图1 玉兰与紫玉兰五个不同的开花时期Fig.1 Different stages of flowering in Y. denudata and Y. liliiflora
黄酮醇标准品槲皮素3-O-芸香糖苷(芦丁)购自上海源叶生物科技有限公司;pMD™18-T 载体购自TaKaRa 有限公司(日本);大肠杆菌感受态细胞DH5α和农杆菌感受态细胞GV3101 购自上海唯地生物技术有限公司;过表达载体pORE_R4 和烟草NC89(N.tabacumNC89)无菌苗均由浙江农林大学浙江省园林植物种质创新与利用重点实验室保存。
1.2 花被片中黄酮醇提取与含量测定
分别称取0.1 g玉兰与紫玉兰各开花时期冻存的花被片样品,利用液氮研磨至粉末,加入1.5 mL 提取液(2%甲酸、70%甲醇),摇匀,在4℃条件下10 000 r·min-1离心10 min,吸取上清液,使用0.22 µm 有机过滤膜进行过滤,后装入1.5 mL进样瓶。
黄酮醇定量分析采用ACQUITY UPLCH-Class 超高效液相色谱仪(Waters,美国),采用C18 色谱柱(粒径1.8 µm,2.1 mm✕100 mm,Waters,美国),进样体积2 µL,流速0.4 mL·min-1,色谱柱温度设置为35℃。流动相A相为0.3%甲酸水,B相为纯乙腈,C相为纯甲醇,D 相为10%甲醇。洗脱梯度:0 min,95% A,5% B;2 min,82% A,18% B;10 min,70% A,30% B;11 min,10% A,90% B;12 min,95% A,5% B;16 min,95% A,5% B。在350 nm 波长处检测黄酮醇组分,得到色谱图。
使用外标法得出玉兰与紫玉兰花被片中黄酮醇含量。黄酮醇标准品为槲皮素3-O-芸香糖苷(芦丁)。通过外标法,将标准品稀释成5、50、125、250、500、1 000 µg·mL-1的标准溶液,对各浓度标准品进行分析。以标准品的不同梯度浓度作为横坐标,各浓度对应的峰面积作为纵坐标,绘制标准曲线y=10 533x+12 592。随后根据所测样品的分析结果中所得到的各个峰面积,通过标准曲线计算样品中对应的标准品物质的浓度,以此计算每克冻存的花被片中所含有的黄酮醇含量。
1.3 FLSs基因克隆及生物信息学分析
根据已有的玉兰与紫玉兰转录组数据库(GenBank SRA accession: PRJNA922720、PRJNA922723),查找黄酮醇合成酶基因序列,分别命名为YdFLS、YlFlS,使用Primer Premier 5.0 设计特异性引物(表1)。用混合的5 个时期花被片cDNA 为模板进行特异克隆。PCR 的反应体系为20 µL:cDNA 2 µL,上游引物1 µL,下游引物1 µL,Premix Taq 10 µL,ddH2O 6 µL。PCR 扩增程序:95 ℃预变性5 min;95 ℃变性30 s,56.8 ℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃再延伸10 min,10 ℃保持。使用琼脂糖凝胶DNA 提取试剂盒(TaKaRa,日本)对目的条带进行切胶回收。将切胶回收的产物连接到pMD™18-T 载体,后转化大肠杆菌DH5α 感受态细胞。经过氨苄青霉素抗性筛选并进行菌检,将阳性菌液进行测序比对,确定基因的最终序列。
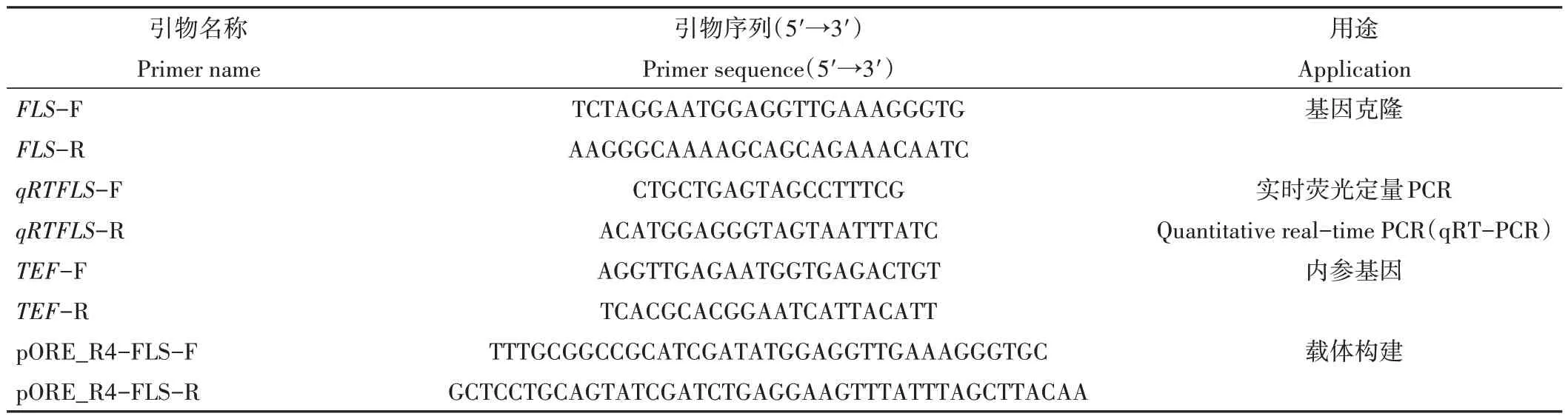
表1 玉兰和紫玉兰FLS基因克隆、表达和构建载体引物Table 1 Primers for cloning FLS gene,expression analysis and vectors construct of Y. denudata and Y. liliiflora
利用ProtParam 在线网站(https://web. expasy. org/protparam/)分析FLSs 氨基酸组成、理论分子量和等电点;利用ProtScale 在线网站(https://web. expasy. org/protscale/)预测FLSs 蛋白的亲疏水性;利用CLC Sequence 8.0 对YdFLS 与YlFLS 的开放阅读框(open reading frame,ORF)和氨基酸序列进行比对;利用在线网站NCBI CD-search(https://www. ncbi. nlm. nih. gov/Structure/bwrpsb/bwrpsb.cgi)对FLSs氨基酸保守结构域预测;利用SOPMA网站(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat. pl?page=npsa_sopma. html)对FLSs进行蛋白二级结构预测。
1.4 FLSs多序列比对及系统进化树分析
使用CLC Sequence 8 软件对YdFLS 和YlFLS 进行多序列比对;通过MEGA 11 软件的邻接法(neighborjoining method,NJ)对YdFLS、YlFLS、芦笋(Asparagus officinalis)AoFLS、洋葱(Allium cepa)AcFLS、水仙(Narcissus tazetta)NtFLS、参薯(Dioscorea alata)DaFLS、沉水樟(Cinnamomum micranthum)CmFLS、芒果(Mangifera indica)MiFLS、茶(Camellia sinensis)CsFLS、马铃薯(Solanum tuberosum)StFLS、苹果(M. domestica)MdFLS、葡萄(Vitis vinifera)VvFLS、拟南芥(Arabidopsis thaliana)AtFLS 建立系统发育树,并采用Bootstrap 法(重复1 000次)评估检测系统进化树。
1.5 FLSs表达分析
利用RNAperp Plant Kit 试剂盒(诺和致源,北京)提取玉兰和紫玉兰花、茎、嫩叶、老叶和根的总RNA,使用Reverse Transcriptase M-MLV(TaKaRa,日本)试剂盒反转录合成cDNA。利用Primer Premier 5.0 软件设计qRT-PCR 引物(表1)。选用望春玉兰MdTEF作为内参基因[21]。qRT-PCR 反应使用LightCycler 480Ⅱ荧光定量仪(Roche,瑞士),反应体系共10 µL:上下游引物各0.4 µL,cDNA 模板2 µL,BCG qPCR Master Mix荧光染料(百凯基生物,北京)5 µL,ddH2O 2.2 µL。两步法扩增程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃复性30 s,40个循环;95 ℃持续5 s,60 ℃持续1 min,95 ℃持续15 s。采用2-△△Ct方法计算玉兰和紫玉兰不同组织和不同发育阶段花被片的FLSs基因的表达量。
1.6 FLSs亚细胞定位
利用同源重组的方法构建pORE_R4-YdFLS 和pORE_R4-YlFLS 重组质粒,后将两个重组质粒分别转入农杆菌感受态细胞GV3101 中。选择阳性菌液于发根农杆菌液体培养基中28 ℃ 200 r·min-1过夜震荡培养,用侵染液重悬菌体至OD600=0.1,28 ℃黑暗环境震荡3 h 待用。选择外表无破损的洋葱(A. cepa),28 ℃恒温培养箱暗培养2~3 d。利用去针头的1 mL无菌注射器将侵染液注射至洋葱内表皮细胞,28 ℃条件下暗培养3 d,使用Axio Imager A2正置荧光显微镜(ZEISS,德国)观察绿色荧光蛋白(green fluorscent protein,GFP)成像。
1.7 FLSs功能验证
通过叶盘转化法[22],将含重组pORE_R4-YdFLS质粒、pORE_R4-YlFLS 质粒和空载体pORE_R4 质粒的农杆菌菌液分别侵染烟草,在含有100 mg·L-1Kana和800 mg·L-1Carb 的筛选培养基中进行分化和生根,T0代转基因植株用于功能验证。使用十六烷基三甲基溴化铵(cetyltrimethylammonium ammonium bromide,CTAB)法提取转基因烟草的DNA,进行阳性苗鉴定。对阳性苗植株的表型和黄酮醇合成酶基因表达进行分析。使用超高效液相色谱技术(ultra-high performance liquid chromatography,UPLC)测定烟草花冠中黄酮醇的含量,方法同1.2。参照Stevenson 等[23]的方法提取烟草花冠中花青素苷,用紫外分光光度计测定530 和657 nm处的吸光值并计算花青素苷含量:
花青素苷含量=(A530-0.25✕A657)/花冠质量。
1.8 数据分析
黄酮醇含量、花青素苷含量和基因表达分析使用SPSS 21.0 软件并采用单因素方差Duncan 检验进行显著差异性分析(P<0.05);使用Origin 2021、SigmaPlot 14.0作图。
2 结果与分析
2.1 玉兰与紫玉兰花瓣黄酮醇含量分析
使用UPLC 系统在波长350 nm 处检测玉兰与紫玉兰五个花开放时期花被片中黄酮醇的含量(图2-A),并分别对玉兰与紫玉兰五个不同开花时期黄酮醇的含量进行分析。结果表明,玉兰在花蕾期黄酮醇含量最低,后逐渐升高,至初开期最高,且显著高于其他阶段,随后降低,盛开期有所回升;紫玉兰黄酮醇含量在花蕾期最高,且显著高于其他阶段,随着花开放,黄酮醇含量持续下降(图2-B)。除此之外,紫玉兰花被片黄酮醇含量从露色期起低于玉兰(图2-B)。
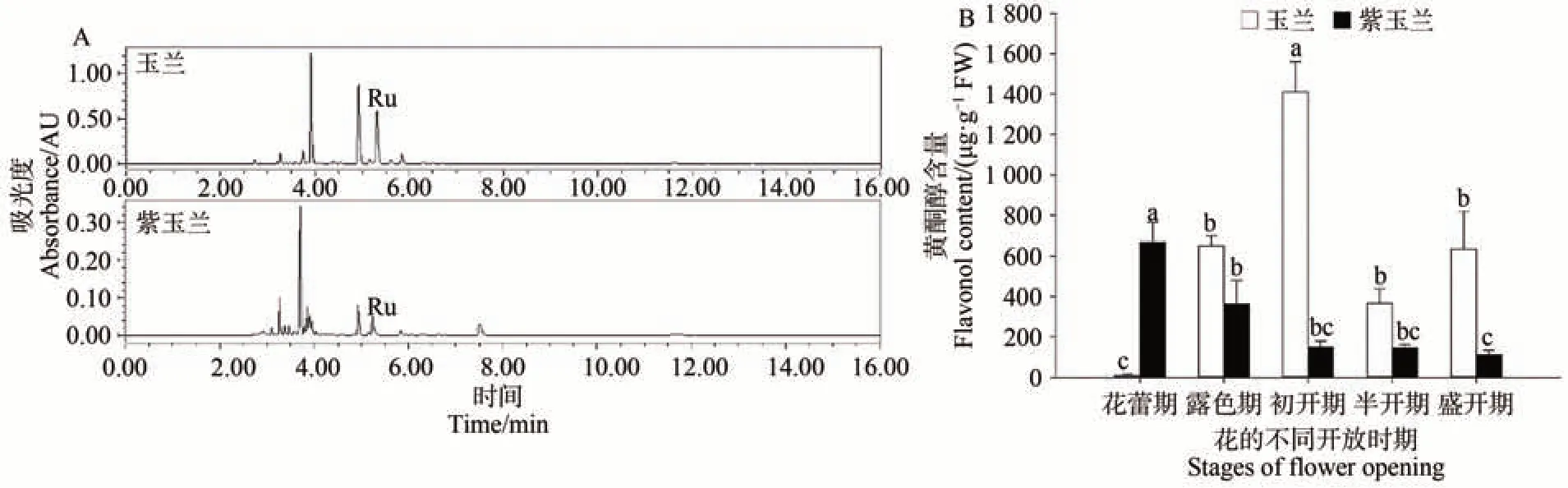
图2 玉兰与紫玉兰初开期UPLC色谱图(A)和不同时期黄酮醇含量图(B)Fig.2 The initial stage UPLC chromatogram (A) and different flowering stages flavonol content of Y. denudata and Y. liliiflora (B)
2.2 FLSs克隆及生物信息学分析
YdFLS与YlFLS的ORF 序列均为1 008 bp,编码335个氨基酸残基;YdFLS蛋白质分子式为C1728H2672N444O501S10,相对分子质量为38.003 5 kDa,理论等电点为9.72,该蛋白不稳定系数为35.97,脂肪系数为86.96,总平均亲水性(grand average of hydropathicity,GRAVY)值为-0.368,属于稳定蛋白;YlFLS 蛋白质分子式为C1726H2670N444O506S10,相对分子质量为38.057 46 kDa,理论等电点为5.17,该蛋白不稳定系数为38.98,脂肪系数为85.22,GRAVY值为-0.404,属于稳定蛋白。
YdFLS与YlFLS的ORF 重复率为98.51%(图3-A),氨基酸重复率为98.21%(图3-B),对YdFLS 和YlFLS 氨基酸序列进行保守结构域预测,结果表明具有3 个相同的保守结构域,PLN02704 为黄酮醇合成酶结构域,说明其具有合成黄酮醇合成酶的功能;20GFell_Oxy 表明属于20G-FeII 加氧酶家族;Pcbc 表明属于α-同戊二酸依赖性双加氧酶超家族(图3-C),差异的氨基酸不影响其保守结构域;对其进行二级蛋白结构预测,二者二级蛋白结构基本一致(图3-D)。以上结果表明,YdFLS 与YlFLS 功能基本一致,FLS基因在玉兰属植物中具有序列保守性。
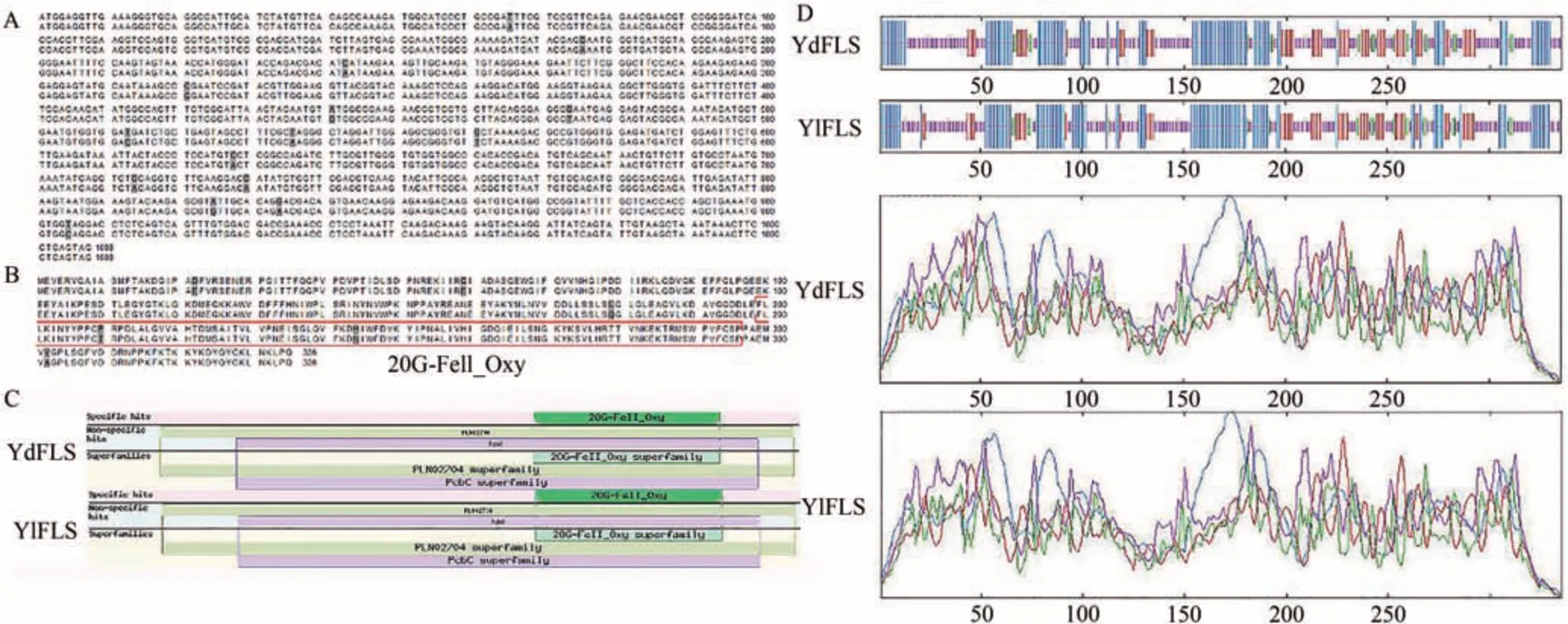
图3 YdFLS与YlFLS生物信息学分析图Fig.3 The bioinformatics analysis of YdFLS with YlFLS
2.3 FLSs多序列比对与系统进化树分析
氨基酸序列分析表明,YdFLS 和YlFLS 都具有相对保守的二氢槲皮素(dihydroquercetin,DHQ)底物特异结合位点:苯丙氨酸132(Phe132)、苯丙氨酸134(Phe134)、赖氨酸202(Lys202)、苯丙氨酸293(Phe293)、丝氨酸295(Ser295);2-氧代戊二酸(2-oxoglutarate)结合位点:精氨酸287(Arg287)、丝氨酸289(Ser289);亚铁离子(Fe2+)结合位点:组氨酸221(His221)、天冬氨酸223(Asp223)以及FLS特异性基序“SxxTxLVP”(x 代表任意的氨基酸残基)(图4)。玉兰与紫玉兰FLS氨基酸序列高度保守的结合位点与其他物种的FLS 蛋白相似,推测其与其他物种FLS 的功能一致。
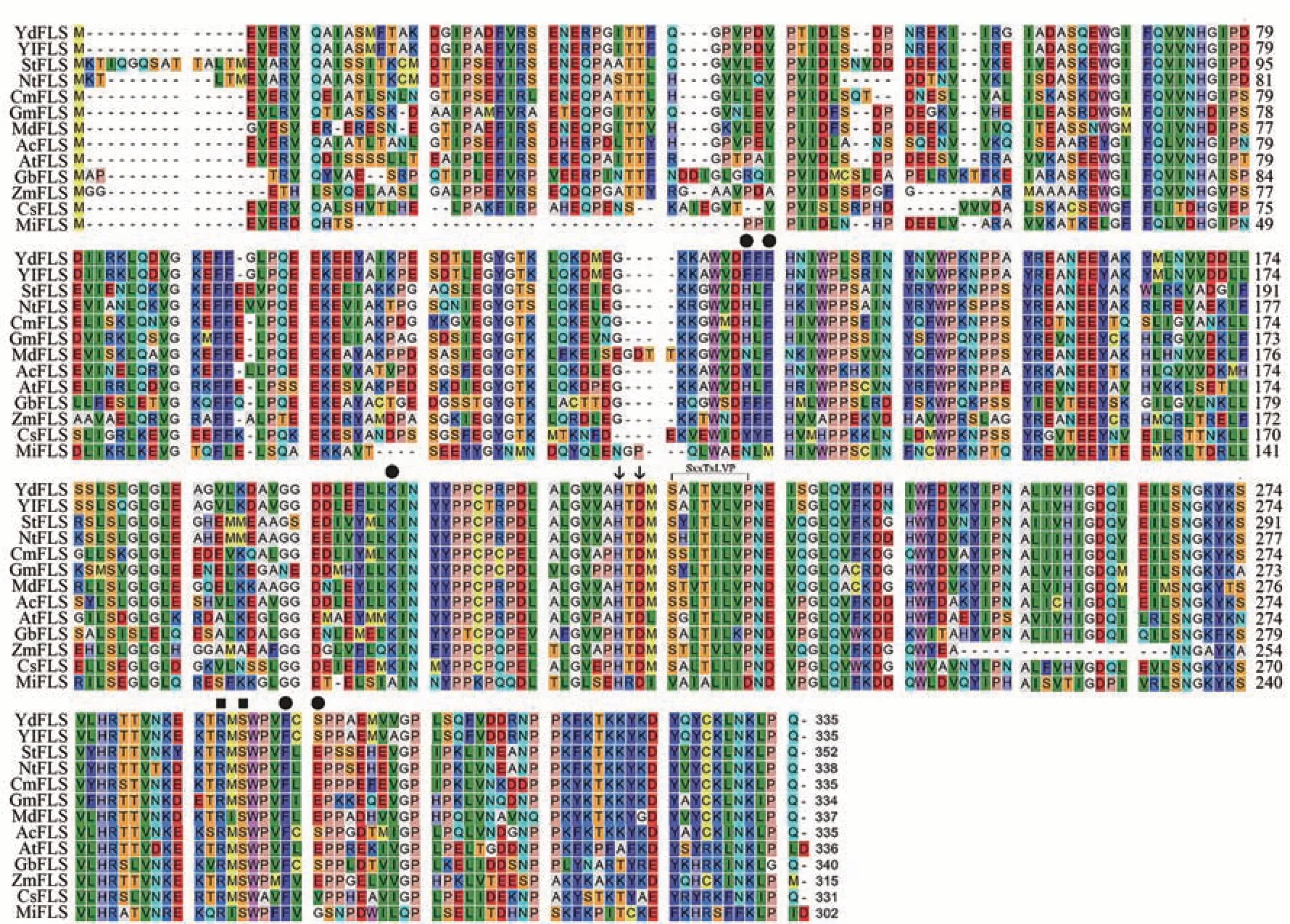
图4 YdFLS、YlFLS与其他植物FLSs氨基酸序列的比对Fig.4 The amino acid sequence homology alignment in YdFLS,YlFLS with other plants
为了进一步探究FLSs 的系统进化关系,本研究利用13 个物种的FLS 蛋白序列建立系统发育进化树。结果显示YdFLS 和YlFLS 与樟科植物沉水樟CmFLS聚为一类,表明其亲缘关系较近(图5)。

图5 YdFLS、YlFLS蛋白与其他植物FLS蛋白系统进化树Fig.5 Phylogenetic tree in YdFLS,YlFLS with other plants
2.4 FLSs组织特异性和时空表达分析
为了探究FLS基因在玉兰、紫玉兰的表达模式,分别对YdFLS和YlFLS的组织特异性和时空表达模式进行分析。组织特异性结果表明,FLSs基因在不同组织中均有表达,YdFLS在花中表达量最高,显著高于其他组织,其次是嫩叶;YlFLS在嫩叶中表达量最高,显著高于其他组织,其次是老叶;FLSs在根中表达量均极低(图6-A)。
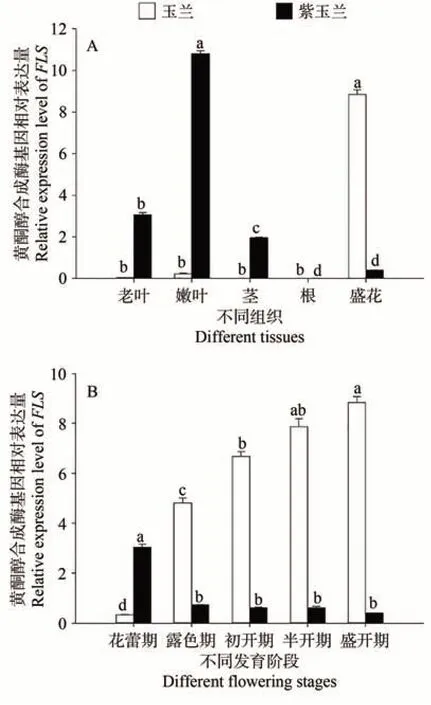
图6 玉兰与紫玉兰不同组织(A)及不同发育阶段(B)花被片的FLSs基因表达量Fig.6 Expression of FLSs genes in different tissues (A) and petals at different flowering stages (B) of Y. denudata and Y. liliiflora
时空表达分析结果表明,YdFLS的表达量随着花开放过程中逐渐升高,在盛开期最高;YlFLS的表达模式完全相反,在盛开期最低(图6-B)。说明FLS基因在玉兰与紫玉兰花被片呈色过程中具有不同的表达模式。FLSs基因表达模式的差异影响玉兰属花被片黄酮醇物质的积累,从而影响玉兰与紫玉兰不同花色的形成。
2.5 FLSs亚细胞定位分析
为了确定FLSs 蛋白在细胞中的定位,将YdFLS与YlFLS分别构建到带有GFP标签的pORE_R4植物表达载体中,以pORE_R4空载为对照。通过注射洋葱表皮细胞观测荧光蛋白定位情况,结果表明,YdFLS 与YlFLS均定位于细胞质内(图7)。

图7 FLSs在洋葱中的亚细胞定位图Fig.7 The subcellular localization of FLSs in onion
2.6 YdFLS、YlFLS 转基因烟草表型及基因表达定量分析
将YdFLS与YlFLS构建在超表达载体pORE_R4上,转化烟草,各获得转基因烟草阳性苗15棵。YdFLS和YlFLS转基因烟草与野生型和空载型烟草比较,花冠颜色变浅(图8-A、图9-A)。qRT-PCR 结果表明,转基因株系FLSs基因表达量明显高于野生型和空载对照(图8-B、图9-B),说明FLSs基因在烟草中超表达。UPLC试验结果表明,转基因烟草花冠中黄酮醇含量相对于对照组明显提高(图8-C、图9-C),花青素苷含量相对于野生型明显降低(图8-D、图9-D)。

图8 转基因烟草表型(A)、转基因烟草表达量(B)、花冠黄酮醇含量(C)、转基因烟草花冠花青素苷含量(D)Fig.8 Transformation phenotype (A),expression of YdFLS (B),flavonol content (C),anthocyanin content (D)
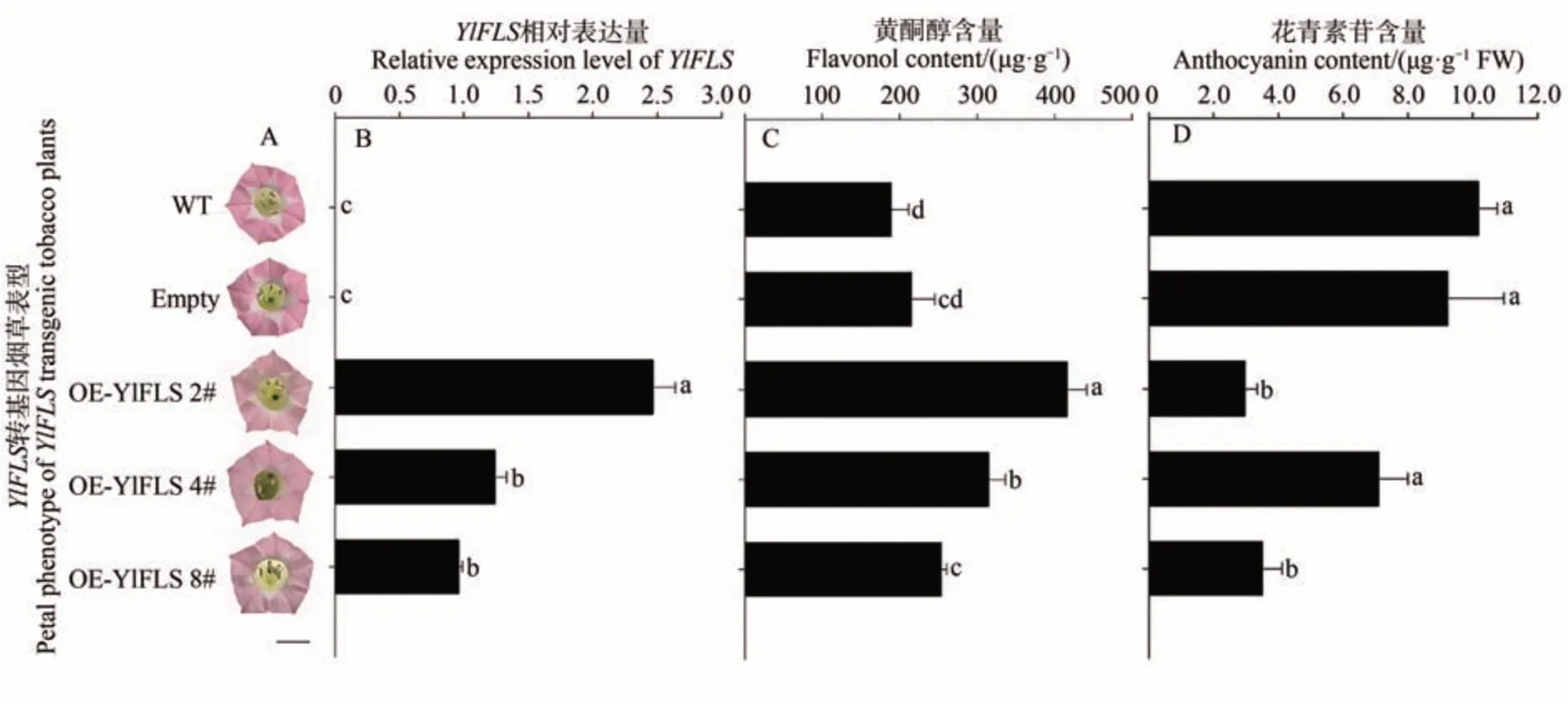
图9 转基因烟草表型(A)、转基因烟草表达量(B)、花冠黄酮醇含量(C)、转基因烟草花冠花青素苷含量(D)Fig.9 Transformation phenotype (A),expression of YlFLS (B),flavonol content (C),anthocyanin content (D)
3 讨论
黄酮醇作为一种重要的辅助色素物质,能够与花青素结合形成稳定的色素结构,影响花瓣的着色;另外还可以单独发挥作用,赋予花瓣白色、浅黄及黄色[24]。它作为类黄酮化合物的一类,与花青素拥有共同的前期合成途径,影响花色的形成[25]。为了探究黄酮醇对玉兰属植物花色形成的作用机制,本研究利用UPLC技术测定玉兰与紫玉兰成花过程中黄酮醇的含量,发现黄酮醇含量是一个动态的变化过程,玉兰花开放过程中花被片黄酮醇积累表现先升高后降低趋势,在初开期含量最高;而紫玉兰黄酮醇含量持续下降,在花蕾期含量最高(图2);在花开放过程紫玉兰黄酮醇积累较早,在花蕾期达到峰值,此时含量高于玉兰,但花蕾期之后紫玉兰黄酮醇迅速降解,含量明显低于玉兰(图2)。表明黄酮醇的积累可以影响玉兰属花被片的着色,且不同植物的黄酮醇的代谢规律具有很大差异,前人在花色丰富的芍药花属、杜鹃花属植物中发现了相似的规律[26-27]。
黄酮醇合成途径关键基因功能验证是解析黄酮醇调控花色形成的关键一步。本研究分别从玉兰与紫玉兰中克隆出YdFLS与YlFLS基因,氨基酸序列分析结果表明FLS家族蛋白氨基酸序列保守性较高(图3、4),在不同物种间生物学功能具有保守性[28]。系统发育树聚类结果显示YdFLS 与YlFLS 高度同源,且与沉水樟CmFLS 亲缘关系最近(图5)。qRT-PCR 结果表明FLSs基因的表达具有明显的组织特异性,YdFLS在花中表达量最高,与玉兰花被片主要呈色物质为黄酮醇有关。YlFLS在嫩叶中表达量最高,花中表达较低,推测是与黄酮醇能保护幼嫩组织免受紫外光的伤害有关[29]。在花开放不同阶段,FLSs具有不同的表达模式,YdFLS的表达量持续上升,在盛开期表达量最高;YlFLS表现出相反的表达模式;且从露色期开始,YdFLS的表达量高于YlFLS(图6),与UPLC 试验结果一致。表明FLS基因与玉兰、紫玉兰花色的形成呈现紧密的联系,其表达量影响着黄酮醇合成支路对类黄酮代谢流的竞争能力,进而影响黄酮醇的含量,前人在葡萄风信子[30]、牡丹[31]中也发现FLS的表达量与黄酮醇的含量呈正相关。
亚细胞定位试验发现FLSs 位于细胞质,说明其在细胞质中发挥作用(图7)。本研究分别将YdFLS、YlFLS在烟草中过表达,转基因株系花色相对于对照组变浅,黄酮醇的含量显著提高,花青素苷的含量减少(图8、9),表明FLSs基因的高表达促进了黄酮醇的合成,并抑制了花青素苷的生成,该结果与茶(CsFLS)[16]、杨梅(MrFLS)[18]转基因表型一致,但在其他植物如拟南芥中发现FLS具有多个成员,而且不同成员的表达模式不一致,功能有所差异,如AtFLS1在花、果中高表达,其他成员在所有组织中低表达,其中AtFLS1 蛋白催化活性最强[32]。玉兰属中是否存在多个FLS家族成员,及成员发挥的功能还有待研究。
以上结果表明FLS基因既可通过直接合成黄酮醇(助色素)来影响花色,又可以通过竞争共同底物二氢黄酮醇来影响花青素苷的合成。FLS基因表达量影响着黄酮醇支路代谢流的强弱,YdFLS基因高表达,使得类黄酮代谢流主要流向黄酮醇方向,使得玉兰的花被片呈现白色;而紫玉兰则相反,YlFLS低表达,造成代谢流主要流向花青素苷方向,花青素苷大量积累,花被片呈紫色。目前FLS基因已在多种植物中被鉴定,上游调控网络也得到初步阐明,如中国水仙(Narcissus tazetta)中的NtMYB12[33]、苹果中的MdNAC9[34]能够结合FLS启动子促进FLS的表达,但转录复合物对FLS的调控机制仍不清晰。
4 结论
本研究分析了两种玉兰开花过程中花被片黄酮醇含量的变化,结果表明黄酮醇积累对玉兰属花被片呈色具有重要影响。对YdFLS 与YlFLS 氨基酸序列进行生物信息学分析,结果表明其序列具有保守性。通过qRT-PCR 分析FLS基因在两种玉兰中的组织和时空表达模式,表明FLS表达模式的不同是造成玉兰与紫玉兰花色差异的重要原因之一。分别将YdFLS、YlFLS在烟草中过表达,相对于对照组,转基因株系花冠花色变浅,黄酮醇含量显著增加,花青素苷明显减少,证实了FLS基因是玉兰与紫玉兰黄酮醇合成和积累的关键基因,在玉兰属中功能保守。
