可见光催化有机硫化合物的绿色合成
2023-09-05梁荣彬卢茂健朱灿明钟建基
肖 潜,梁荣彬,卢茂健,朱灿明,钟建基
(汕头大学化学化工学院,广东 汕头 515063)
0 引 言
作为一类重要的分子结构,含硫官能团如硫醚键、磺酰基团、磺酰胺基团等广泛存在具有生物活性的天然产物和商品化药物分子之中[1-3].例如,孟鲁司特是一种强效的选择性抑制剂,在预防和治疗慢性哮喘方面表现突出[4-5];兰索拉唑是治疗肠胃溃疡的常用药物,具有有效抑制胃酸分泌的效果[6];含有典型磺内酰胺的噻奈普汀可用于治疗常见的抑郁症[7-8].此外,在有机合成和材料领域,有机硫化合物也是一类重要的合成砌块,常用于构建结构复杂的高附加值化合物[9-12].因此,发展有机硫化合物的高效构建方法具有重要意义,这也是近年来有机合成领域的热点研究之一.
硫元素具有丰富的价态,并且各价态之间容易相互转换.传统上,有机硫化合物的合成方法常涉及高温、化学计量的自由基引发剂或氧化还原试剂、高能的紫外光等苛刻的反应条件,导致反应过程中存在过多的副产物及不可控的自由基反应过程,大大限制了其进一步的应用.鉴于传统方法的局限性,科研工作者逐渐将重心转移至开发更温和、更绿色的合成方法.其中,可见光氧化还原催化因其固有的绿色可持续性以及温和高选择性的特性而备受关注,经过多年的发展,现已成为构建有机硫化合物的强有力工具[13-15]. 在此,本文概述了近三年来本课题组基于可见光催化有机硫化合物合成方面的研究工作,具体包括硫醚化合物、砜类化合物和磺内酰胺化合物三类化合物的可见光催化合成方法.
1 可见光催化硫醚化合物的选择性合成
硫醚是一类重要的有机硫化合物,通常情况下,硫醇和烯烃的直接加成反应,即硫-烯反应,是构建硫醚化合物最简单且原子经济性最好的方法之一.该类反应可通过亲电途径或自由基途径进行,分别以马氏加成的方式得到支链产物或反马氏加成的方式得到直链产物. 由于硫的高反应活性,在大多数情况下,反应倾向于通过自由基途径进行,由此得到反马氏加成产物. 相比之下,马氏硫-烯反应具有一定的挑战性.受限于Kharasch 效应和有机硫化合物对金属催化剂的毒化作用,可见光氧化还原催化的马氏硫-烯加成反应鲜有报道[16]. 2021 年,我们课题组基于导向基团协助的策略,以吖啶盐和钴肟配合物为催化剂,通过光/钴协同催化,以优秀的区域选择性实现了硫醇和苯乙烯的马氏加成反应(图式1)[17].该反应具有广泛的底物适用范围和良好的官能团耐受性,芳环上带有给电子或吸电子基团的底物以及各种市售的烷基硫醇均可以很好地兼容该催化体系,以54%-93%的收率得到对应的硫醚化合物. 此外,将反应放大至克级规模,仍可以得到令人满意的产率,具有一定的实用性.通过荧光淬灭实验、自由基捕获实验和氘代实验的探究,我们提出了反应可能的机理.首先,通过磺酰胺基的导向作用,钴催化剂与底物配位,同时活化烯烃,生成Co(III)中间体;另一方面,激发态的光催化剂氧化底物硫醇产生光催化剂自由基阴离子和硫自由基;随后,Co(III)中间体被光催化剂自由基阴离子被还原,产生的Co(II)中间体捕获硫自由基得到硫钴中间体. 接着,该中间体以烯烃的马氏选择性迁移插入,生成Co(III)-C 中间体;最后,该中间体再质子化得到最终产物.
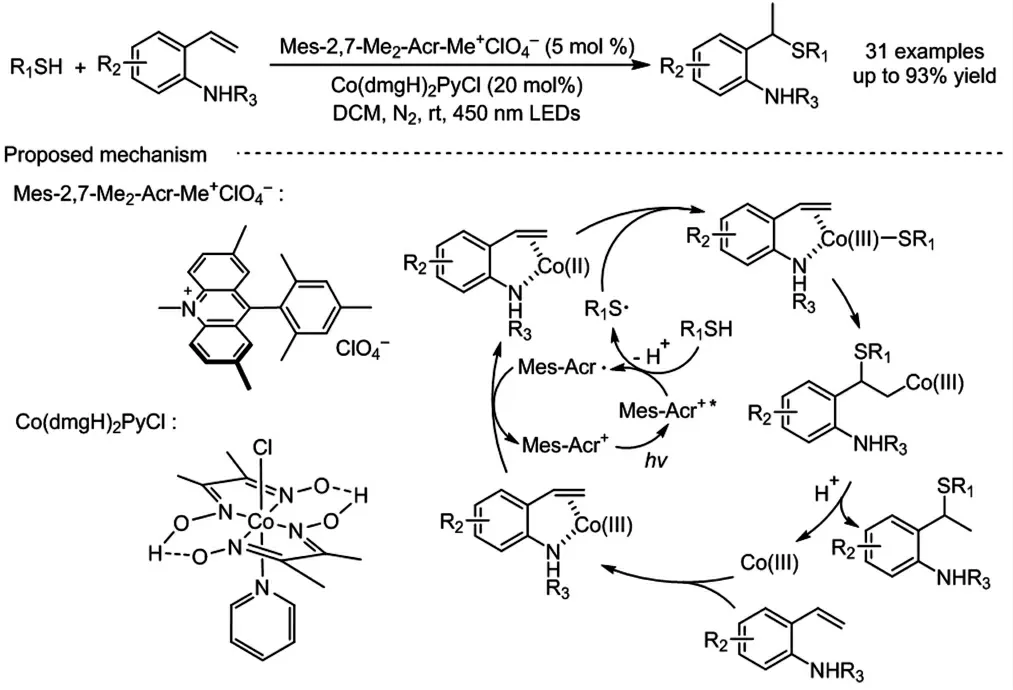
图式1 光/钴协同催化的马氏硫-烯反应
大部分的硫-烯反应,仅在烯烃上引入一个官能团,得到结构单一的硫醚化合物.在取得上述研究成果后,我们尝试进一步在硫-烯反应的过程中,引入额外官能团,以期实现烯烃的硫代双官能团化反应.2021 年,我们课题组发展了一例可见光促进烯烃的羟硫化反应,一步选择性构建一系列β-羟基硫醚化合物(图式2)[18].该反应基于三级胺协助的策略,不需要催化剂参与,并以氧气作为绿色的氧化剂,具备绿色高效的特点.各类常见的硫酚和烯烃都能以良好到优秀的产率参与反应的转化,展示出优秀的官能团兼容性.值得注意的是,相比于先前报道的工作,带有吸电子基团的烯烃也可以兼容该反应.此外,我们也成功地在标准反应条件下开展了克级规模的放大反应和结构复杂的乙烯基雌酮衍生物的后期羟硫化反应,进一步展示该反应体系的应用潜力.根据一系列实验机理探究的结果,我们认为反应的可能机理如下:首先,在氧气氛围中,硫酚自氧化生成硫自由基,进攻烯烃得到烷基自由基中间体;接着,该中间体与氧气反应,再通过氢原子转移过程生成过氧化物中间体;最后,在叔胺的协助下,过氧化物中间体被直接还原为产物β-羟基硫化物.从对照实验可知,可见光作为驱动力,在抑制副产品二硫化物的产生和促进反应效率方面发挥了重要作用.
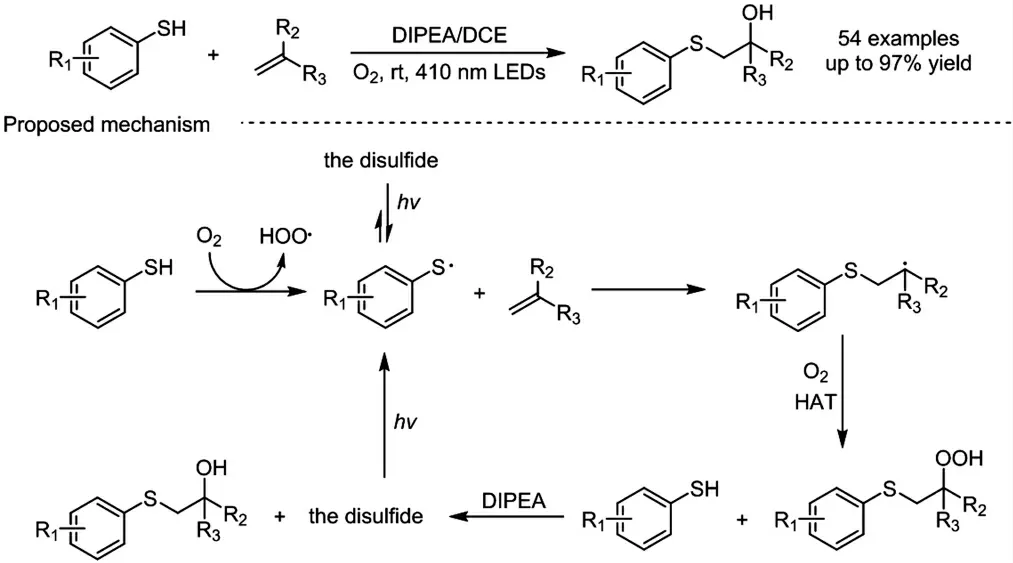
图式2 可见光诱导烯烃的羟硫化反应
在实现了上述烯烃羟硫化反应的基础上,我们尝试在改进反应局限性的同时,丰富官能团种类,如烷氧基、氨基等,以此构建更为多样性的硫醚化合物.由于硫的高反应活性,在前期的研究工作中,氧气的使用容易导致烯烃羟硫化反应过程中存在不理想的副反应,近期,我们组通过引入N-硫代芳基邻苯二甲酰亚胺(phthSAr)作为硫自由基的前体,解决了这一问题,开发了一例烯烃参与的三组分区域选择性硫化羟基化反应、硫化烷氧基化反应和硫化氨基化反应(图式3)[19].该反应具备条件温和,选择性高,底物适用范围广泛等特点.克级规模反应和生物活性分子的后期官能团修饰的顺利进行,表明该反应具有一定的合成应用潜力.反应所用的phthSAr 是一种常用的亲电硫试剂,但作为硫自由基前体却鲜有报道[20-22].我们以N-硫代苯邻苯二甲酰亚胺phthSPh 为研究对象,测得其还原电位为-1.32 V(vs.SCE),可与激发态Ir(ppy)3的还原电位(EPC+/PC*=-1.73 V vs.SCE)匹配.因此,当以Ir(ppy)3为光催化剂,在450 nm 波长的可见光照射下,激发态的光催化剂便可被phthSPh 氧化淬灭,生成硫自由基和四价铱光催化剂;接着,硫自由基与烯烃发生自由基加成,得到的烷基自由基被四价态铱光催化剂氧化为碳正离子,同时,光催化剂完成催化循环;随后,碳正离子中间体可以被杂原子亲核试剂捕获,生成相应的产物.通过这种光催化自由基加成/亲核进攻的方法,能够避免使用氧气或额外的氧化剂,大大减少反应的副产物.此外,通过改变不同的杂原子亲核试剂,不仅可以实现烯烃的硫化羟基化反应,还可以实现烯类的硫化烷氧基化或硫化氨基化反应.
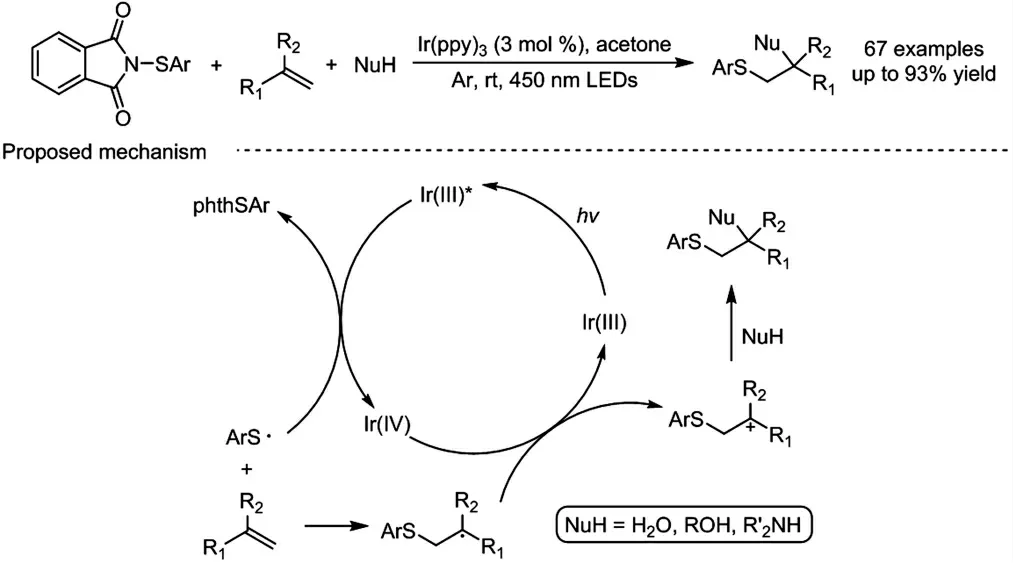
图式3 光催化烯烃三组分区域选择性硫化反应
受上述工作的启发,近期,我们通过巧妙的底物设计,将反应历程中的分子间亲核成键过程设计为分子内的反应,由此构建了一系列硫代环醚化合物,其中包括五元、六元和七元环醚化合物(图式4)[23].反应以phthSAr 作为硫自由基的前体,芳基烯醇为自由基受体,在蓝光的照射下,激发态的4-CzIPN 光催化剂可将phthSAr 单电子还原,生成的硫自由基中间体选择性地加成到芳基烯醇双键的端基位,由此得到的碳自由基中间体可被单电子氧化为碳正离子中间体,随后底物中的羟基进攻碳正离子发生分子内亲核环化得到硫代环醚产物.相比于以往构建环醚化合物的方法,该反应具有操作简便、绿色温和、无需金属参与以及良好的官能团兼容性和区域选择性等特点.
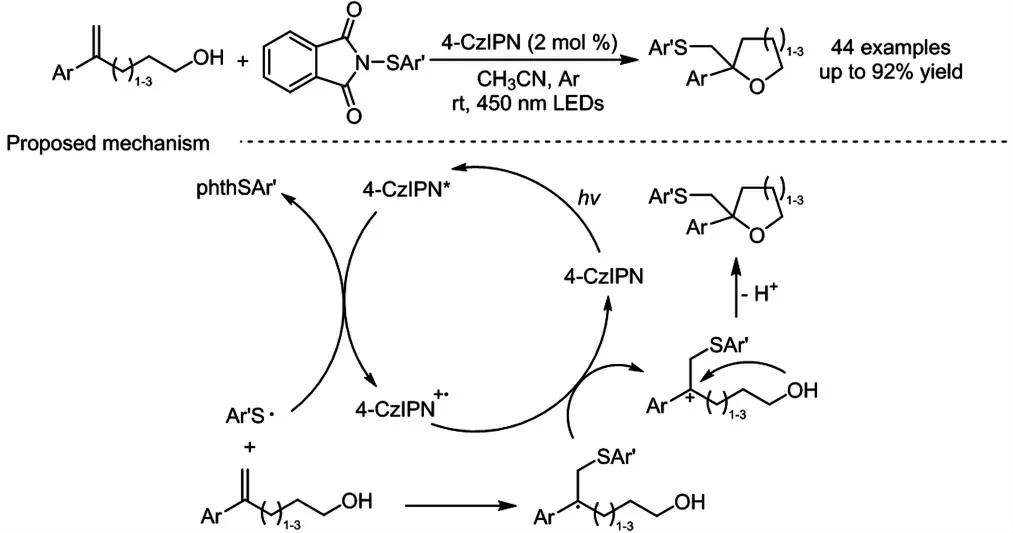
图式4 硫代环醚化合物的光催化合成
以四氢呋喃为代表的环醚结构是一类重要的结构单元,广泛分布在各类高价值化合物中.因此,以其为直接原料,开发含有四氢呋喃骨架结构的硫醚化合物的绿色高效构建方法具有重要意义[24-25]. 然而,四氢呋喃的α-C-H 键具有一定的化学惰性,针对该C-H 键的直接选择性官能团化是一个充满挑战性的课题.尽管利用过渡金属催化策略和氢原子转移(HAT)策略能够在一定程度上实现四氢呋喃α-C-H 键的直接官能化,但是,相关的反应通常需要紫外光照射、使用高毒性或昂贵的过渡金属催化剂、引入当量氧化剂或氢原子转移试剂等,一定程度上限制了上述方法的进一步应用[26-30].近期,我们以4-CzIPN 为可见光催化剂,商品化廉价的四丁基溴化铵为助催化剂,N-硫代烃基邻苯二甲酰亚胺(phthSR)作为亲自由基体,发展了一例绿色温和,无过渡金属参与的光催化体系,实现四氢呋喃α-C-H 键的高效、高选择性C-S 键交叉偶联反应,构建了一系列含有四氢呋喃骨架结构的硫醚化合物(图式5)[31]. 该反应具有良好的底物适用范围,芳环上带有给电子或吸电子基团的硫酚自由基前体和一级硫醇自由基前体都可参与反应,以良好的产率获得目标产物.此外,其它具有代表性的醚类化合物,如异色满、乙醚和乙二醇二甲醚等也能够兼容该反应体系.我们通过一系列的机理探究实验,推测反应涉及溴自由基和α-烷氧基自由基参与过程. 可能的反应机理如下:首先,通过激发态4-CzIPN 或光敏化产生单线态氧的氧化下,体系中的溴离子可转化为关键的溴自由基中间体;随后,溴自由基攫取四氢呋喃的α-位的氢原子,生成α-位碳自由基,进一步与phthSR 发生偶联,从而生成硫醚产物和邻苯二甲酰亚胺氮自由基中间体;最后,该中间体与4-CzIPN 自由基阴离子发生单电子转移,完成4-CzIPN 的光催化循环.

图式5 光催化下溴自由基促进的四氢呋喃选择性α-C-H 官能团化反应
2 光/钴协同催化选择性合成烯丙基砜化合物
烯丙基砜结构是有机合成领域中一类重要的合成砌块,同时该结构也存在于多种具有生物活性的分子中,因此,关于烯丙基砜化合物的绿色高效合成研究备受关注.目前,该类化合物的构建方法主要通过磺酰化合物和烯丙基类化合物的反应得到,但是,烯丙基类化合物的预官能团化限制了该类反应的进一步应用. 在先前研究工作的基础上[32],2021 年,我们课题组报道了一例磺酰肼与烯烃的烯丙基化反应,高效、高选择性地构建了一系列烯丙基砜化合物(图式6)[33].反应基于光氧化还原和钴肟协同催化的策略,相比前人的报道,避免了额外当量的氧化剂和预官能团化的烯丙基前体的使用,具有绿色、高原子经济性和高选择性的特点.典型的磺酰肼,包括芳基磺酰肼和烷基磺酰肼,以及各种α-甲基苯乙烯化合物均可参与反应,并以中等到优秀的产率得到相应的目标产物.根据荧光淬灭实验和自由基捕获实验的结果,我们提出了可能的反应机理:首先,激发态的eosin Y 光催化剂被底物磺酰肼还原淬灭,生成eosin Y 自由基阴离子和磺酰基自由基中间体;随后,该中间体与烯烃发生加成反应产生新的碳自由基中间体;与此同时,三价钴肟催化剂被eosin Y 自由基阴离子还原为二价钴肟催化剂,并捕获碳自由基,形成Co(III)-C中间体;该物种可发生选择性β-消除产生最终的烯丙基化合物和Co(III)-H 中间体;最后,在质子或烯烃的作用下该中间体转化为三价钴肟催化剂完成催化循环.
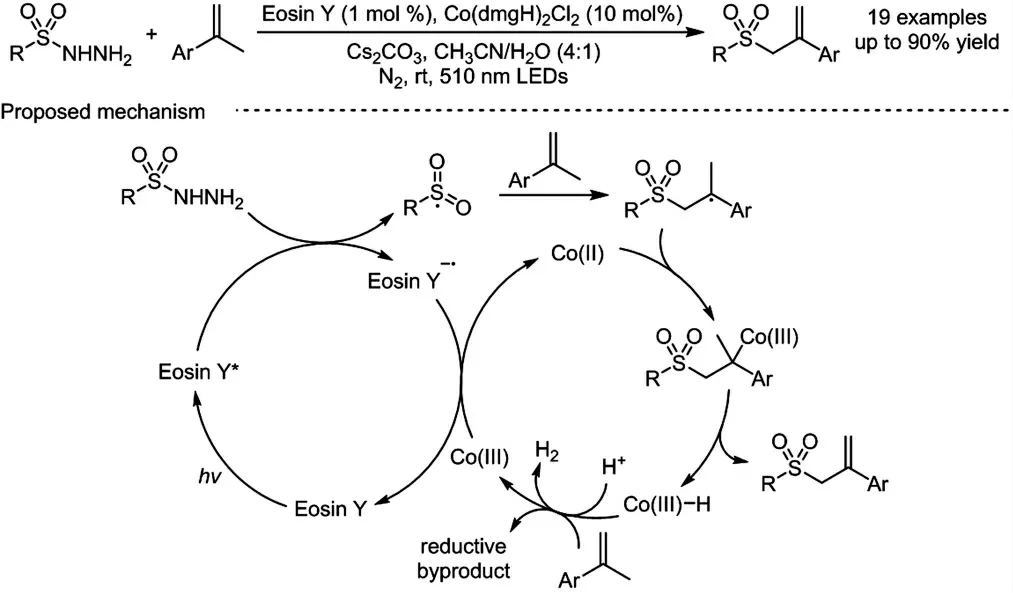
图式6 光/钴协同催化磺酰肼与烯烃的烯丙基化反应
3 光诱导自由基串联环化反应构建二氧二苯并硫杂吖庚因化合物
二氧二苯并硫杂吖庚因衍生物是一类重要的七元磺内酰胺化合物,该类骨架结构存在于许多具有生物活性的药物分子中.过渡金属催化的Heck 类偶联反应和路易斯酸促进的Friedel-Crafts 环化反应是传统上合成该类化合物的常用方法,但其中存在诸多缺陷,如高温、强酸和重金属催化剂的使用等.因此,二氧二苯并硫杂吖庚因衍生物的绿色高效合成方法仍有待发展[34].2021 年,我们组基于自由基串联环化策略,以4-CzIPN为可见光催化剂,商品化廉价易得的溴代二氟烷烃为自由基前体,在可见光氧化还原体系中,实现了二氟烷基取代的二氧二苯并硫杂吖庚因衍生物的高效合成(图式7)[35].除了各种典型的溴代二氟烷烃底物外,芳环上连接烷基、卤素以及酯等官能团的磺酰胺基苯乙炔底物均可参与反应的进行.此外,该反应无需高毒性且难以完全去除的重金属试剂参与,并且能够以良好收率在克级规模下进行,具有潜在的应用价值.我们通过荧光淬灭实验和自由基捕获实验,明确反应过程中涉及二氟烷基自由基的参与,基于此,提出可能的反应机理:首先,激发态的4-CzIPN 与溴代二氟烷烃发生单电子转移,产生4-CzIPN 自由基阳离子和二氟烷基自由基中间体;接着,该中间体进攻底物端基炔,生成的烯烃自由基中间体随即发生分子内自由基串联环化,由于二氟烷基与分子中的另一芳香环的位阻因素,因此,可以单一的区域选择性得到七元磺内酰胺骨结构;随后,4-CzIPN 自由基阳离子或底物溴代二氟烷烃将其氧化为阳离子中间体;最后,在吡啶的作用下脱去质子得到最终产物.

图式7 光催化自由基串联环化反应构建二氧二苯并硫杂吖庚因化合物
4 结论
基于有机硫化合物在有机合成、药物化学和材料科学等领域的重要性,近年来,本课题组针对目前硫醚化合物、砜类化合物和磺内酰胺化合物在合成中存在的若干问题,利用可见光氧化还原催化体系绿色温和、高原子经济性、高选择性的特点,成功开发了一系列极具特色的可见光催化反应,用于构建结构多样性的有机硫化合物.目前,有机硫化合物的绿色高效构建仍是有机合成领域的研究热点,进一步寻求更简单、更廉价的反应底物以及更绿色、更高效的光催化体系合成结构更为独特的有机硫化合物将是本课题组今后研究的主要方向.
