小麦Tappc3A基因克隆及功能预测
2023-09-02向桂丽乌日娜YamamotoNaoki吴一超廖明莉魏淑红彭正松杨在君
向桂丽,乌日娜,Yamamoto Naoki,吴一超,蒋 进,廖明莉,魏淑红,彭正松,杨在君
(1.西华师范大学 生命科学学院,西南野生动植物资源保护教育部重点实验室,四川 南充 637000;2.西华师范大学 环境科学与工程学院,四川 南充 637000;3.南充市农业科学研究院,四川 南充 637000;4.西昌学院 农业科学学院,四川 西昌 615013)
小麦(TriticumaestivumL.)是典型的C3植物,也是世界绝大多数地区的主要粮食作物之一[1-2]。在过去的几十年里,以半矮秆小麦育种为代表的“绿色革命”使小麦的产量大幅度提高,在很大程度上保障了过去几十年全世界的粮食安全[3]。但由于人口的迅速增加以及生物和非生物胁迫等因素的影响,到2050年小麦产量仍需每年增加1.7%左右方可满足全球的需求[4]。因此,提高小麦的单产水平仍然是小麦育种的根本目标。与其他谷类作物一样,小麦花器官的发育直接影响其产量,而花器官异常可以为改良小麦产量提供独特的遗传资源[5]。三雌蕊小麦(TP)具有3个正常的雄蕊和3个可育的雌蕊,能结3颗种子,具有显著的穗粒数优势[6]。从TP与中国春(CS)的杂交后代中筛选出的雄蕊同源转化为雌蕊突变体(HTS-1)除具有三雌蕊性状外,其雄蕊全部或部分同源转化为雌蕊,自然结实率仅为12%左右,而正常雌蕊和完全转化的雌蕊发育正常,一朵小花中可结3~4粒种子[7]。因此,TP和HTS-1在提高小麦产量和创制杂交小麦中具有较大的潜力。
磷酸烯醇式丙酮酸羧化酶(PEPC;EC4.1.1.31)催化磷酸烯醇式丙酮酸(PEP)发生不可逆的β-羧基化反应,生成草酰乙酸(OAA)和无机磷酸(Pi)。PEPC在植物、藻类和细菌中广泛存在,但在动物和真菌中缺失[8]。在植物中,PEPC起着变构酶的作用,并被PEPC蛋白激酶磷酸化[9-10]。在C4植物和景天酸代谢途径(CMA)的植物中PEPC得到了广泛而深入的研究,因为在光合作用中它是催化大气中CO2固定初始反应的关键酶[11-12]。在非光合细胞和C3植物中PEPC也发挥着重要作用,例如:补充由脂质合成、生物合成和氮同化等过程消耗的三羧酸循环(TCA)中间体,参与果实成熟、种子形成和发芽等生物过程[12-13]。该酶还在保卫细胞的气孔开放和固氮豆科植物的根瘤中发挥特殊作用[14-15]。基因组分析表明,C3植物中包含一个小的PEPC家族,主要由植物型PEPC(PTPC)和细菌型PEPC(BTPC)2种类型组成[16]。与植物型PEPC不同,细菌型PEPC在其N端不存在丝氨酸磷酸化结构域。
C4植物在低CO2浓度、高温、强光和干旱胁迫条件下具有更高的光合作用水平、水和氮的利用效率以及更高的生物产量。因此,将C4基因转入C3作物,以提高C3植物的光合速率和耐热性。PEPC是C4途径的第一个关键酶,它一直是C3植物的转化靶点[17-18]。研究表明[19],通过将C4植物玉米(ZeamaysL.)的PEPC基因转入C3植物小麦中,可以增强转基因小麦光化学和抗氧化酶活性,上调光合作用相关基因的表达,延迟叶绿素的降解,改变小麦中脯氨酸和其他代谢物的含量,并最终提高其耐热性。到目前为止,尚无关于PEPC参与小麦器官发育的报道。Yamamoto等[20]研究表明,小麦Tappc3基因在雌蕊中表达量较高,因此,推测其与雌蕊的发育相关。近期,笔者从Yang等[21]利用HTS-1的正常雌蕊(P)、雌蕊化雄蕊(PS)和TP的正常雄蕊(S)为材料构建的RNA-Seq数据库中筛选出一个在PS和P中表达量异常高的基因,经序列比对分析发现,该基因与节节麦(AegilopstauschiiCoss.)和大麦(HordeumvulgareL.)中编码PEPC3蛋白的基因同源,由于该基因位于3A染色体上,因此命名为Tappc3A。
在本研究中从HTS-1和三雌蕊近等基因系CM28TP中克隆了Tappc3A基因,并对其表达模式、共表达基因及原核表达后酶的活性进行了分析。结果表明,Tappc3A可能参与小麦雌蕊发育,它在雄蕊中的过量表达可能与HTS-1的雄蕊同源转化为雌蕊性状形成有一定的关联。本研究为进一步阐明Tappc3A基因的功能及其小麦雌蕊发育的调控机制奠定了基础。
1 材料和方法
1.1 试验材料
本研究选用三雌蕊小麦CM28TP和小麦雄蕊同源转化雌蕊突变体HTS-1为试验材料。CM28TP是小麦三雌蕊突变体(TP)与川麦28(Chuanmai 28,CM28)杂交后与CM28回交7代后获得的三雌蕊小麦株系[22]。HTS-1是从TP与中国春(Chinese spring,CS)的杂交后代中筛选出的一个雄蕊同源转化为雌蕊的突变体,其雄蕊部分或完全转变为雌蕊,因此具有4~6个雌蕊。因此,HTS-1与CM28TP中均含有控制小麦三雌蕊性状的关键基因Pis1。小麦进入孕穗期后,分别取采集长度为0.2~0.5 cm(二棱期至小花分化期),0.5~0.7 cm(雌雄蕊原基分化期)和0.7~1.0 cm(药隔时期)的3个阶段幼穗[23]。同时采集HTS-1的雌蕊(P)、雌蕊化雄蕊(PS)及CM28TP雄蕊(S)。将上述材料浸入RNA保存液(TaKaRa,中国大连)中,置于-80 ℃超低温冰箱中保存备用。
1.2 总RNA提取和cDNA合成
利用LABGENETMplant RNA isolation Kit(兰博基因,中国江苏)分别提取HTS-1和CM28TP 3个阶段的幼穗及P、PS、S的总RNA,具体提取方法参照生产商提供的说明书执行。利用1%琼脂糖凝胶电泳和NaroDrop 2000c微量分光光度计检测RNA的纯度和浓度。以上述提取的RNA为模板,利用PrimeScriptTMRT Reagent Kit(TaKaRa,中国大连)参照说明书提供的方法进行反转录,并将得到的cDNA溶液置于-20 ℃的冰箱中保存备用。
1.3 Tappc3A的克隆测序
基于小麦TraesCS3A02G306700.1序列,利用Primer Premier 6.0 设计Tappc3A扩增引物(表1)。以HTS-1和CM28TP药隔时期幼穗cDNA作为PCR扩增的模板,退火温度56 ℃。将扩增纯化后的PCR产物连接到pMD19-T载体上,导入DH5α感受态细胞中,最后涂布于含100 μg/mLAmp+的LB固体培养基上,37 ℃静置培养过夜。阳性克隆菌液送至生工生物工程(上海)股份有限公司测序,利用DNAMAN 9.0和Chromas对测序结果进行分析。
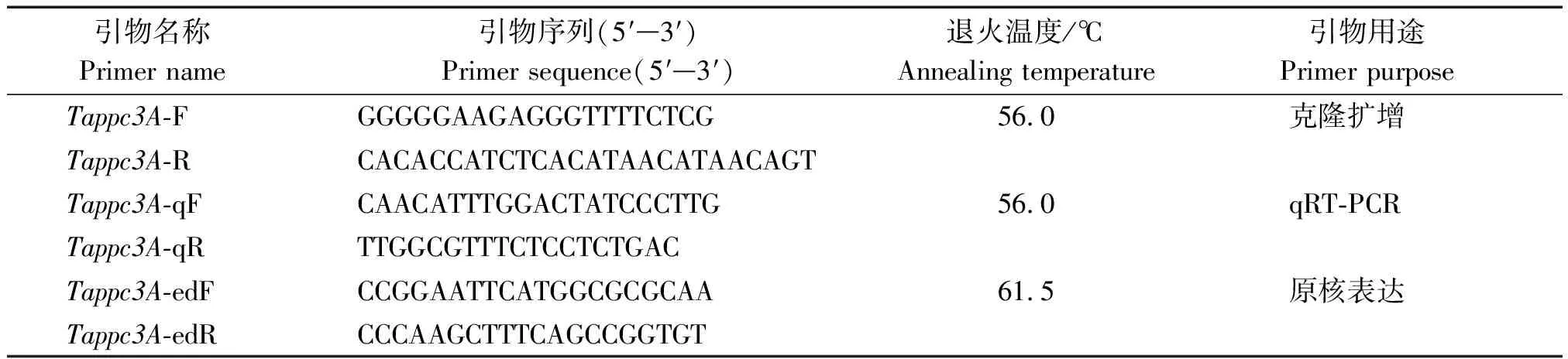
表1 Tappc3A基因克隆、qRT-PCR及原核表达引物序列
1.4 Tappc3A氨基酸序列分析及系统进化树的构建
获得的cDNA序列利用NCBI在线软件ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)进行开放阅读框的分析,DNAMAN 9.0软件进行氨基酸序列比对;利用NCBI的蛋白结构域数据库(Conserved domain database,CDD,https://www.ncbi.nlm.nih.gov/cdd)和InterPro在线分析工具(http://www.ebi.ac.uk/interpro/)分析蛋白保守结构域及功能域;使用ExPasy(https://web.expasy.org/protparam/)分析蛋白的分子量、理论等电点和蛋白质的亲疏水性;采用NovoPro网站(https://www.novopro.cn/tools/)预测蛋白的二级结构;运用NCBI的Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)搜索同源基因,使用ClustalX 1.83软件进行多重序列比对,再使用MEGA 7.0软件中的邻近相连法构建系统发育树,并进行Bootstrap检测。
1.5 荧光定量PCR(qRT-PCR)分析
利用Primer Premier 6.0 设计Tappc3A的qRT-PCR引物,引物序列如表1所示。以1.2中的cDNA作为模板,利用CFX 96 PCR仪(Bio-Rad,美国加州)进行qRT-PCR,具体操作参照SsoFastTMEva Green Supermix(Bio-Rad,美国加州)的说明书进行。以小麦Actin基因作为内参(GenBank ID:AB1811991)[20],利用2-ΔΔCt的方法计算各样品中Tappc3A基因的相对表达量[24]。利用Graphpad软件作图。
1.6 重组表达载体pET-28a-Tappc3A的构建及诱导表达
根据Tappc3A基因的ORF序列分别设计带有EcoR Ⅰ(5′-G↑AATTC-3′)和HindⅢ(5′-A↑AGCTT-3′)限制性内切酶位点的引物(表1)。以1.3中克隆且测序正确的菌液为模板进行菌落PCR,退火温度61.5 ℃。利用EcoRⅠ和HindⅠ对扩增回收产物和pET-28a质粒进行双酶切,再利用T4DNA连接酶连接,获得pET-28a-Tappc3A重组载体。利用热激法将重组载体转入大肠杆菌DH5α中,利用PCR和双酶切进行验证。最后将验证正确的菌液送生工生物工程(上海)股份有限公司测序。将测序正确的重组质粒pET-28a-Tappc3A转化到大肠杆菌BL21(DE3)中,获得的pET-28a-Tappc3A-BL21重组菌株在LB(含100 μg/mL Kan)液体培养基中,180 r/min,30 ℃培养。培养至OD值0.6左右加入终浓度为0.2 mmol/L的IPTG诱导剂,30 ℃诱导5 h。12 000 r/min,4 ℃离心10 min收集菌液细胞。按照钰博生物的大肠杆菌总蛋白提取试剂盒提取融合蛋白,通过冰浴超声得到大肠杆菌总蛋白样品。按照磷酸烯醇式丙酮酸羧化酶(PEPC)试剂盒(苏州科铭生物技术有限公司)说明书操作,在340 nm测定NADH减少速率,从而计算PEPC酶活性。
1.7 挖掘与Tappc3A共表达的基因
利用中国春小麦(CS)及其近等基因系17种RNA-Seq数据库中获得TPM值,挖掘与Tappc3A共表达的基因[20]。这些共表达基因包括抽穗期和开花期的旗叶,开花早期和晚期的茎、根、雌蕊、雌蕊化雄蕊、雄蕊、子房,孕穗期的茎和穗,种子萌发期的胚芽鞘、胚、根尖以及幼苗期叶片。计算Tappc3A与其他基因之间表达量的Pearson相关系数(PCCs)。将正相关的Pearson相关系数阈值设定为0.7[25]。利用agriGO(http://bioinfo.cau.edu.cn/agriGO/index.php)对与Tappc3A共表达的基因进行GO富集分析。利用bioinformatics在线工具(http://www.bioinformatics.com.cn/)绘制GO富集的气泡图。
2 结果与分析
2.1 Tappc3A基因克隆及序列分析
以HTS-1和CM28TP药隔时期幼穗cDNA作为PCR扩增的模板,克隆获得一条约3 000 bp的单一条带,与预期结果相符(图1-A)。经测序和比对分析后发现从HTS-1和CM28TP中克隆得到的目的基因序列完全一致。克隆得到的Tappc3A长度为2 970 bp,开放性阅读框(ORF)长度为2 901 bp,编码966个氨基酸残基(图1-B)。通过NCBI上的BlastN比对后发现,该基因序列与其他植物的PEPC基因序列具有77.14%~99.93%的相似性,其中与小麦中国春品种3A染色体上的PEPC基因(XM_044485447.1)具有99.93%的一致性,与二穗短柄草(Brachypodiumdistachyon,XM_014898420.2)和酸枣(Ziziphusjujubavar.spinosa,XM_048471538.1)的PEPC基因分别具有89.77%和78.54%的一致性。因此,将该基因命名为Tappc3A,并将该序列上传NCBI数据库(登录号:OP615936)。
运用DNAMAN 9.0软件进行氨基酸序列多重比对分析发现,目的基因与中国春(XP_044341382.1)、二穗短柄草(XP_014753906.1)、水稻(Oryzasativa,XP_015630901.1)、高粱(Sorghumbicolor,P15804.2)、黄花菊(Flaveriatrinervia,P30694.2)的氨基酸序列相似度分别为99.69%,91.54%,90.82%,73.17%,81.11%。比对结果显示(图2),Tappc3A基因编码蛋白序列在N端具有保守的丝氨酸(Ser,S)可逆磷酸化位点(SIDAQLR),C端具有植物型PEPC蛋白特征序列(QNTG),氨基酸序列第774位是C3型PEPC的丙氨酸(Ala,A)而非高粱和黄花菊C4型PEPC的丝氨酸(Ser,S),表明小麦Tappc3A蛋白是植物型C3型PEPC。
2.2 Tappc3A蛋白的特征性分析与系统进化树构建
在CDD数据库中对Tappc3A结构域进行预测,发现该蛋白在氨基酸序列163—966位具有一个磷酸烯醇式丙酮酸羧化酶(PEPase)保守结构域,属于磷酸烯醇式丙酮酸羧化酶超级家族成员(图3-A)。进一步分析显示,在该结构域中具有2个PEPase活性位点,分别在氨基酸序列第168—179位(PS00781,VLTAHPTQSVRR)和第592—604位(PS00393,VMIGYSDSGKDAG),在这2个活性位点中分别含有与酶活性有关的氨基酸残基赖氨酸(Lys,K)和组氨酸(His,H),同时具有7个保守的PEPcase亚催化结构域(图2)。该蛋白质分子式C4917H7778N1356O1442S35,相对分子质量为110.08 ku,理论等电点为6.02,不稳定系数45.18,总平均亲水性为-0.358,因此,该蛋白属于酸性亲水性蛋白。二级结构分析预测,该蛋白含有62.84%的α-螺旋、4.35%的β-转角、5.69%的延伸链和27.12%的无规则卷曲(图3-B、C)。为了进一步了解Tappc3A基因的生物学功能,采用MEGA 7.0软件N-J构建植物Tappc3A蛋白氨基酸序列的系统进化树(图4)。结果表明,相同光合作用途径且亲缘关系近的物种首先聚为一类,Tappc3A基因氨基酸序列与乌拉尔图小麦(Triticumurartu)、野生二粒小麦(Triticumdicoccoides)、大麦(Hordeumvulgare)等的亲缘关系最近,同属于C3型分支。
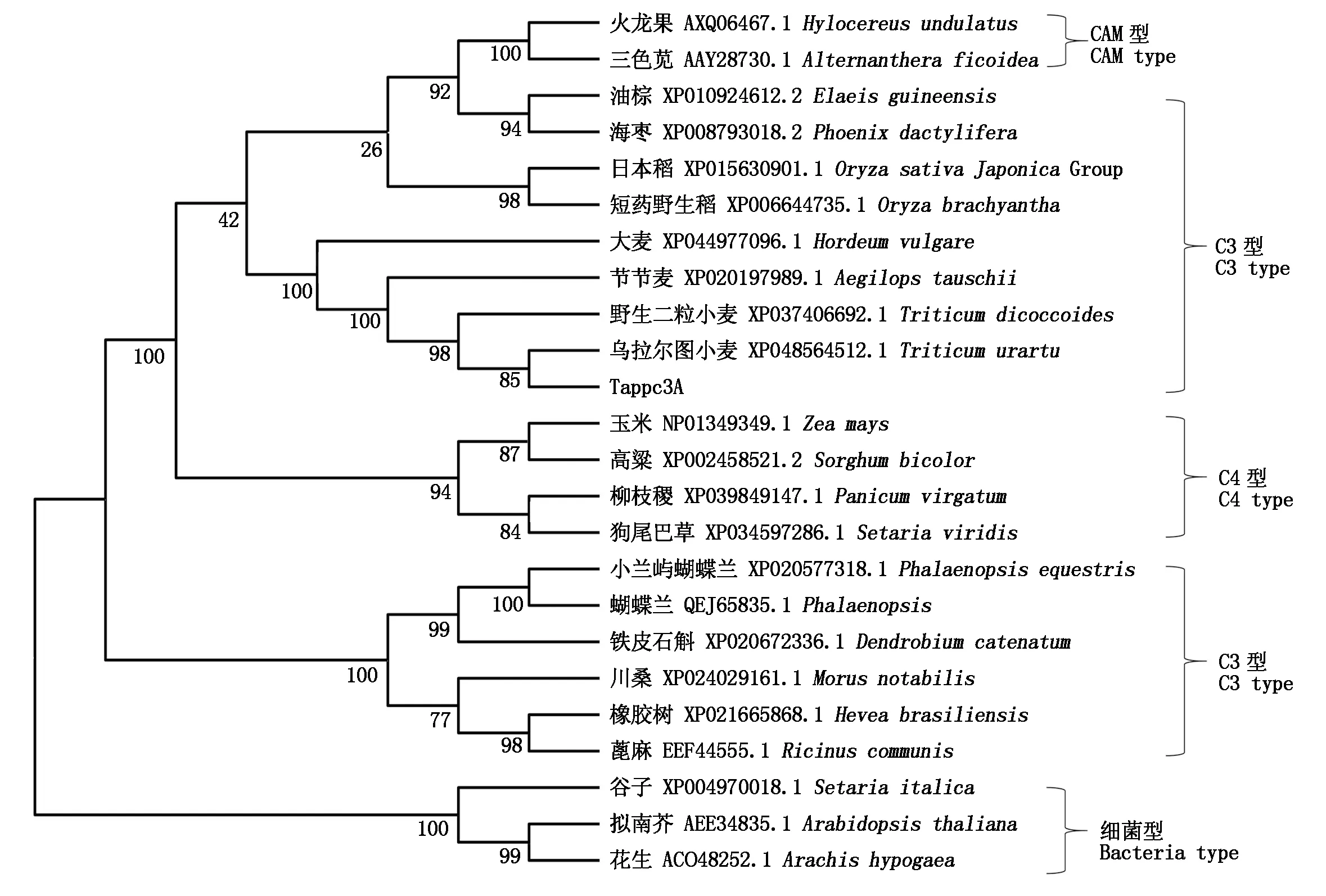
图4 Tappc3A与其他植物PEPC的系统进化树
2.3 Tappc3A基因qRT-PCR分析
进一步探讨克隆得到的Tappc3A基因在CM28TP和HTS-1中的表达是否有差异,通过qRT-PCR对CM28TP和HTS-1 3个阶段的幼穗及P、PS、S的表达量进行分析(图5)。结果显示,Tappc3A基因在2种材料及P、PS、S中均有表达,但各个时期及P、PS、S表达量有显著差异。在CM28TP小穗中,Tappc3A的表达量在雌雄蕊原基分化期(0.5~0.7 cm)最高,其次是二棱期至小花分化期(0.2~0.5 cm),表达量最低的是药隔时期(0.7~1.0 cm)。在HTS-1小穗中,Tappc3A的表达量在二棱期至小花分化期最高,雌雄蕊原基分化期和药隔时期表达量相近。在二棱期至小花分化期和药隔时期,HTS-1小穗中Tappc3A的表达量都要显著高于CM28TP,而在雌雄蕊原基分化期无显著差异。Tappc3A在P和PS中的表达量显著高于S的表达量。

1.二棱期至小花分化期0.2~0.5 cm;2.雌雄蕊原基形成期0.5~0.7 cm;3.药隔期0.7~1.0 cm;P.雌蕊;PS.雌蕊化雄蕊;S.雄蕊。不同字母的均值表示存在差异显著(P<0.05)。图6同。
2.4 重组蛋白诱导表达及PEPC活性分析
构建的pET-28a-Tappc3A重组质粒,经双酶切和电泳检测后获得2条带,一条大小为5 300 bp左右(pET-28a载体),一条大小为2 900 bp左右(目的条带),而未经双酶切的pET-28a-Tappc3A线性质粒只有一条大小8 000 bp左右的条带,条带大小与预测的一致(图6-A)。重组质粒测序结果与目的基因序列一致,证明重组质粒pET-28a-Tappc3A构建成功。将重组质粒转化到大肠杆菌BL21(DE3)中,活化获得pET-28a-Tappc3A-BL21重组菌株。对IPTG诱导浓度、诱导时间及诱导温度进行优化,pET-28a-Tappc3A-BL21在30 ℃、IPTG终浓度为0.2 mmol/L时,诱导5 h后,Tappc3A蛋白表达量最大。表达菌液经超声破碎后取上清部分,测定融合蛋白中PEPC的活性。结果表明(图6-B),pET-28a空载体组中是否添加IPTG对PEPC活性影响显著,且酶活性均较低;与pET-28a空载组相比,pET-28a-Tappc3A组的PEPC活性增强,加入IPTG诱导后,其酶活性进一步得到显著提升。原核表达分析证明,Tappc3A基因编码的蛋白能催化磷酸烯醇式丙酮酸(PEP)生成草酰乙酸,并且在IPTG诱导后活性显著增强。
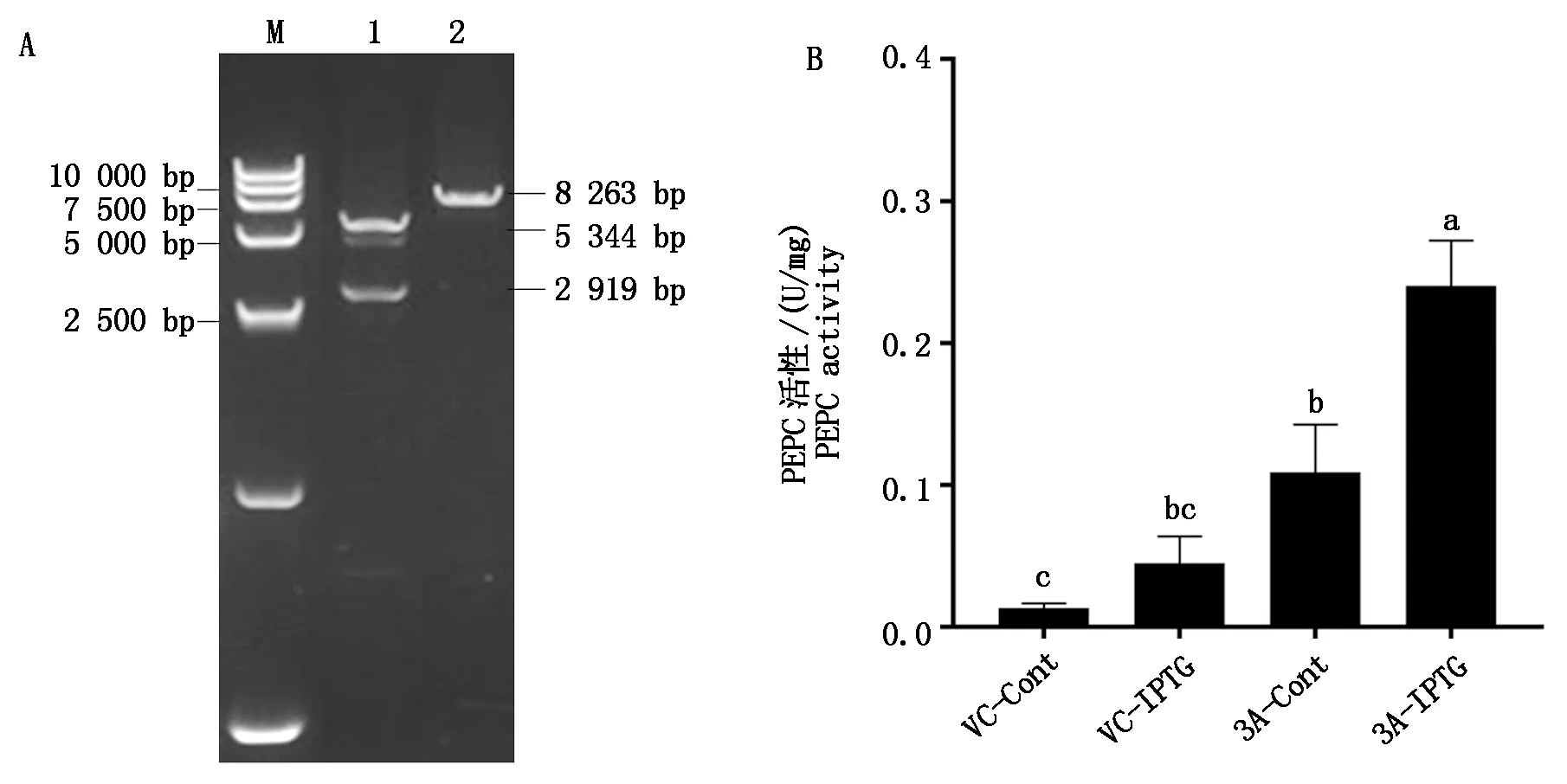
A.重组质粒 pET-28a-Tappc3A的双酶切鉴定:M.Marker 15000;1.pET-28a-Tappc3A质粒经 EcoRⅠ、Hind Ⅲ双酶切;2.pET-28a-Tappc3A线性质粒。B.PEPC活性测定:VC.对照组;3A.试验组。
2.5 与Tappc3A共表达的基因分析
为探究Tappc3A与其他调控花器官发育基因之间是否存在相互关系,从小麦RNA-Seq数据库中挖掘出与Tappc3A共表达的基因。当Pearson相关系数的阈值设定为0.7时,从小麦17个RNA-Seq数据库中共筛选到了11 862个基因,其中3 492个基因得到GO注释信息,当P<0.05时获得674个富集显著的GO term。在这些GO term 中有18个GO term 与花器官的发育与分化相关(图7)。这些GO term主要包括:花器官形成、生殖芽系统发育、胚胎后器官形态发生、花器官形态发生、生殖过程的调节、单体生殖过程、生殖过程、花器官的发育、花器官特性的维持、器官特性的维持、生殖结构发育、生殖系统发育、多细胞生物繁殖过程、分生组织营养期到生殖期的转变、器官形态发生、花轮发育、胚胎后器官发育和花器官特性规范等。这表明Tappc3A可能与这些基因一起调控了小麦花器官的发育。
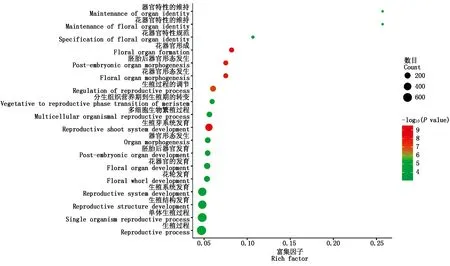
颜色表示富集程度;大小表示基因数量。
3 结论与讨论
在C3植物中磷酸烯醇式丙酮酸羧化酶(Phosphoenolpyruvate carboxylase,PEPC)的主要作用是催化磷酸烯醇式丙酮酸(PEP)生成草酰乙酸(OAA)进入三羧酸循环,从而弥补三羧酸循环中消耗的中间产物[26-27]。此外,PEPC在植物的生长发育和逆境适应过程中也发挥了重要的作用,如果实的成熟、种子的萌发和发育、抗旱、抗盐等[28-31]。到目前为止,除Igawa等[32]报道了细菌型PEPC基因可以加速花粉成熟过程中贮藏物质的积累外,尚无关于PEPC参与植物器官发育的报道。Yamamoto等[20]研究表明,小麦Tappc3基因在雌蕊中表达量较高,因此,推测其与雌蕊的发育相关。本研究以小麦2个特有的雌蕊突变体CM28TP和HTS-1为试验材料克隆了一个PEPC家族基因Tappc3A,它是Tappc3位于3A染色体上的同源基因,该基因具有典型的磷酸烯醇式丙酮酸羧化酶的活性位点和功能位点,第774位氨基酸为C3植物PEPC典型的丙氨酸。聚类分析结果也表明,Tappc3A属于C3型PEPC家族。原核表达分析结果表明,构建pET-28a-Tappc3A重组质粒在大肠杆菌中能表现出磷酸烯醇式丙酮酸羧化酶活性,且IPTG诱导后酶活性明显增强。这表明本研究获得了具有正常功能的Tappc3A基因。通过对P、PS和S的RNA-Seq数据分析表明Tappc3A在P和PS中的表达量显著高于S,因此,推测小麦雄蕊同源转化为雌蕊可能与Tappc3的过量表达相关[21]。序列比对结果分析表明,在CM28TP和HTS-1中克隆得到Tappc3A基因ORF序列及推导氨基酸序列完全相同,这表明,雄蕊同源转化为雌蕊性状不是Tappc3A基因序列的差异造成的,可能与其表达量有关。
前期研究表明,小麦PEPC基因在不同组织中的表达具有特异性,如Tappc1a基因在根和生殖器官中表达量较高。Tappc1b基因在幼苗期的叶片中高水平表达。Tappc2的表达具有普遍性,因此,可能是一个看家基因。Tappc3雌蕊等生殖器官中高水平表达。Tappc4在成熟叶片中表达量较高[20]。在蓖麻(Ricinuscommunis)中O′Leary等[29]也观察到Rcppc3基因在雌蕊的珠被中的表达量高于雄蕊,因此,推测Rcppc3与雌蕊发育相关。本研究重点探讨了Tappc3A在小麦幼穗、雌蕊(P)、雄蕊(S)以及雌蕊化的雄蕊(PS)中的表达情况。在幼穗发育的3个阶段,除阶段二(雌雄蕊原基分化期)外,HTS-1中的Tappc3A基因的表达量均高于CM28TP。尤其是在第三阶段(药隔形成期)HTS-1中的Tappc3A基因表达量约为CM28TP的2倍。在这个阶段,雌雄蕊原基已完成分化,雄蕊突起由球状变为柱状,且沿中部自顶向下出现微凹纵沟,同时雌蕊原基顶端凹陷分化出2枚柱头原基。因此,在这个阶段,雄蕊和雌蕊发育所需要的物质具有较大的差异。而Tappc3A在雄蕊中的过量表达可能造成蛋白质和脂质代谢混乱,从而导致雄蕊发育异常。已有研究表明,花药和花粉发育过程中脂质代谢的紊乱会导致花药角质层、花粉外壁和花药亚细胞器膜的发育异常,从而引起细胞核雄性不育(GMS)[33]。Tappc3A基因在HTS-1的P、PS及CM28TP的S中的表达模式进一步表明,该基因可能与雌蕊发育相关,因为Tappc3A在P和PS中的表达量显著高于S,该结果也与之前的RNA-Seq结果一致[21]。共表达分析显示,Tappc3A基因与花器官形成、花器官形态发生、花器官的发育、花器官特性的维持、器官形态发生、花轮发育和花器官特性规范等花器官的发育与分化相关基因共表达,进一步表明Tappc3A可能参与了小麦花器官的形态发生。此外,研究表明[34],基因表达模式的改变会导致小麦雄蕊心皮化。综上所述,Tappc3A可能与小麦雌蕊发育相关,其在雌蕊中的过量表达可能与HTS-1的雄蕊同源转化为雌蕊性状形成有一定的关联。本研究为进一步阐明Tappc3A基因的功能及小麦雌蕊发育的调控机制奠定了基础。
从小麦中克隆得到Tappc3A基因,该基因编码966个氨基酸,具有典型的磷酸烯醇式丙酮酸羧化酶的活性位点和功能位点,是植物C3型PEPC。构建的pET-28a-Tappc3A重组质粒在大肠杆菌中能表现出磷酸烯醇式丙酮酸羧化酶活性,且IPTG诱导后酶活性显著增强,这表明Tappc3A基因具有正常的功能。在HTS-1幼穗发育的二棱期至小花分化期和药隔时期,Tappc3A基因的表达水平都显著高于CM28TP,且HTS-1的P和PS中的表达量显著高于CM28TP中的S。共表达分析结果进一步表明,Tappc3A可能参与了小麦花器官的形态发生。因此,推测Tappc3A可能参与小麦雌蕊发育,其在雄蕊中的过量表达可能与小麦雄蕊同源转化为雌蕊性状形成有一定的关联。
