安罗替尼在晚期肺癌后线治疗的疗效与安全性分析
2023-09-01张金华杨力宝张河衍
张金华,杨力宝,黄 琳,张河衍
(三明市第二医院,福建 三明 366000)
肺癌是世界上最常见的恶性肿瘤,死亡率最高,非小细胞肺癌约占肺癌的85%,患者确诊时多为中晚期,治疗方案选择较少,驱动基因阴性者多选择化学药物治疗延长患者生存期[1]。目前临床上,大多数患者可从放疗联合化疗中受益,但也给患者带来较多的不适,并发症发生率较高,患者依从性低[2]。在后线治疗上,药物的选择更为重要。安罗替尼是一种新型的口服多靶点抗血管生成酪氨酸激酶抑制剂,在中国已被批准用于晚期非小细胞肺癌的三线和小细胞肺癌的三线治疗。ALTER-0303的试验研究发现,安罗替尼比安慰剂在三线/后线治疗非小细胞肺癌晚期患者更有效,与安慰剂组相比,安罗替尼组患者的ORR和DCR得到显著改善。基于此,回顾性分析我院晚期肺癌患者后线治疗使用安罗替尼的疗效及安全性,获得结果如下。
1 资料与方法
1.1 一般资料
纳入标准[3]:(1)经病理学确诊,影像学证实为晚期肺癌;(2)病例完整;(3)经诊断为原发肿瘤;(4)接受过规范一线、二线抗肿瘤治疗;(5)年龄>18岁;(6)重要脏器功能基本正常,血常规以及肝肾功能基本正常,无治疗禁忌证。排除标准[4]:(1)既往安罗替尼治疗;(2)基线影像信息不全;(3)同时有其他类型肿瘤者。
回顾性分析我院2020年02月—2023年01月收治以晚期肺癌(非小细胞肺癌)并以规范一线二线抗肿瘤治疗后进展的患者总计111例,采用常规治疗的51例设置为非安罗替尼组,男37例,女14例,年龄30~83岁,平均(63.86±3.25)岁,病程2.0~7.0个月,平均(4.77±0.82)个月。另以安罗替尼治疗的60例患者为安罗替尼组,男47例,女13例,年龄45~78岁,平均(62.73±3.41)岁,病程1.0~8.0个月,平均(4.86±0.77)个月。一般资料均衡可比(P>0.05)。
1.2 方法
安罗替尼组:盐酸安罗替尼胶囊(正大天晴药业集团,国药准字H20160318, 12mg/粒),早餐前12mg,空腹口服。服药2周停1周,两组均治疗4周。可耐受不良反应者继续用药;不能耐受者根据不良反应程度进行调整,第一次用药剂量减至10mg/d,仍无法耐受者继续减少用量为8mg/d,仍无法耐受不良反应者,考虑停止用药。非安罗替尼组:予多西他赛(100mg/m2,21天为一周期,连续治疗4期)治疗。
1.3 评价标准
比较两组患者治疗前、后的肿瘤标志物水平,评价治疗2周期后疗效,统计患者不良反应的发生情况。肿瘤标志物水平以糖类抗原19-9 (CA19-9)、癌胚抗原(CEA)、糖类抗原125(CA125)、神经元特异性烯醇化酶(NSE)。治疗2周期后,根据RECIST 1.1进行疗效评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。客观缓解率(objectiveresponse rate,ORR)=(CR+PR),疾病控制率(disease control rate,DCR)=(CR+PR+SD)[6-7]。
由表8可见,山羊发酵乳中含有抗氧化活性肽,且具有较强的抗氧化能力;经模拟胃液和肠液消化试验后,抗氧化活性较消化前有所下降,但下降幅度较小,消化后抗氧化活性依然存在,可见混合发酵菌株产生的活性肽经胃胰蛋白酶水解后,生成的产物仍具有一定的抗氧化活性。
1.4 统计学方法
两组患者治疗前肿瘤标志物水平无统计学差异(P>0.05)。治疗后肿瘤标志物水平较治疗前下降,安罗替尼组较非安罗替尼组更低,治疗前、后两组组内及治疗后组间比较,差异有统计学意义(P<0.05)。详见表1。
2 结果
2.1 治疗前、后的肿瘤标志物水平
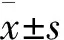
该公司炭黑5号生产线尾气前馈串级控制方案投运前,自2018年8月27日0时开始,12 h内的炭黑温度数据记录见表1所例。

表1 两组患者治疗前、后的肿瘤标志物水平比较
2.2 治疗2周期后疗效
治疗2周期后安罗替尼组客观缓解率、疾病控制率均高于非安罗替尼组(P<0.05)。详见表2。
矿区位于NE向的区域布格重力异常上(图2),一六钨矿、梅子冲银铅锌矿、赤佬顶锑矿等矿床和宝山岩体、高山岩体均分布在该北东向的重力异常带上,说明上述矿床区域成矿构造相同,推测其深部有隐伏岩体存在。赤佬顶地带布格重力值(-60×10-5 m/s2以上)较已出露的宝山和高山岩体(-64×10-5 m/s2左右)高约4×10-5 m/s2,是该区沉积岩地层增厚、隐伏岩体埋深变大所致。根据其东北测约4km地段于梅子冲银铅锌矿区所施测的5线综合物探剖面反映隐伏岩体埋深在-300m标高以下,依据宝山岩体的侧伏方向,推测赤佬顶锑矿区隐伏岩体埋深在-600m标高以下。

表2 两组患者在治疗2周期后疗效对照(n,%)
2.3 不良反应的发生情况
安罗替尼组患者不良反应的发生率低于非安罗替尼组(P<0.05)。详见表3。

表3 两组患者不良反应的发生情况比较(n,%)
3 讨论
肺癌症状不典型,姑息性化疗为晚期标准疗法,随着精准化和个体化治疗模式的发展,明确其基因变异情况,予以靶向治疗为改善预后的最佳治疗手段[8]。驱动基因检测可以发现突变靶点,选择相应靶向药物治疗,而驱动基因阴性或无敏感基因突变患者无法从靶向治疗中获益。尽管靶向治疗可延长患者生存期,但终究会耐药或病情进展[9-10]。血管生成是原有血管生成新毛细血管的繁杂性多程序性过程。新生血管一方面可以为肿瘤输送大量氧气、供应充沛养分、协助运走因代谢产生废料,另一方面还可以产生多种因子介导肿瘤的生长、浸润和转移等过程[11-12]。血管生成需要“促血管生成”、“抗血管生成”双重管控,动态平衡,一旦这种内稳态被破坏,“血管生成开关”将变得活跃,并启动血管生成程序[13]。血管内皮生长因子(VEGF)家族促血管生成作用最强,具有多种亚型,可以与其配体VEGFR具有较高亲和力,二者紧密结合启动了血管内皮细胞内增殖活化、分化迁移等特定内皮反应的多条信号通路,最终建立新的血管。而抗血管生成药物通过诱导已发生退化血管短暂性的恢复“血管正常化”,即血管形态和功能正常。短暂“正常化”的血管能增加肿瘤血管灌注和氧合,增强抗癌药物的释放和疗效,减弱癌细胞的侵袭性扩散[14]。安罗替尼是国内新款研制的小分子VEGFR-TKI,能有效介导VEGFR、PDGFR、FGFR-a/β、c-kit等多条信号通路,实现遏制肿瘤血管生成的同时,还兼备抑制肿瘤增殖的作用。临床前研究表明[15],同水平下对 VEGF、PDGF-BB和 FGF-2 诱导微血管形成的抑制率,安罗替尼要高于舒尼替尼、索拉非尼和尼达尼布,这表明无论是体内或是离体,安罗替尼都能够对该三个靶点介导的血管生成具有显著的抑制性。从机制上讲,这可能与安罗替尼能广泛阻断 3 种主要的酪氨酸激酶(VEGFR-2、PDGFR-β和 FGFR-1)的磷酸化及下游的 ERK 信号转导相关。此外,与 c-Kit 结合的同时,安罗替尼还能抑制 c-Kit 介导的多条下游信号通路,造成肿瘤细胞的多种生物学行为进程受扰,以达成实现遏制肿瘤生长的目标。本研究中,治疗前两组患者肿瘤标志物水平无统计学差异(P>0.05)。治疗后肿瘤标志物水平较治疗前下降,安罗替尼组较非安罗替尼组相比更低(P<0.05)。在治疗2周期后安罗替尼组客观缓解率、疾病控制率均高于非安罗替尼组(P<0.05)。安罗替尼组患者不良反应发生率低于非安罗替尼组(P<0.05)。考虑安罗替尼的耐受性较好,不良反应可控。在临床治疗中需密切监测药物不良反应,及时调整药物剂量也是治疗中需要注意的问题。
综上所述针对于在晚期肺癌规范一线二线抗肿瘤治疗后进展患者中,以安罗替尼治疗,可控制患者的血清肿瘤标志物水平,对于疾病的客观缓解率与疾病控制率的提升效果理想,可减少在治疗期间的不良反应发生率。
