安罗替尼对脑胶质瘤T98G细胞迁移侵袭及上皮间质转化的抑制作用
2024-06-27柳新张圣林李青山董怡谢云鹏
柳新 张圣林 李青山 董怡 谢云鹏
【摘要】 目的 探究安罗替尼对人脑胶质瘤细胞黏附、迁移、侵袭和上皮间质转化(EMT)的影响。方法体外培养人脑胶质瘤T98G细胞,分为对照组(不做干预)、实验组(2.5 μmol·L-1安罗替尼组、5 μmol·L-1安罗替尼组、10 μmol·L-1安罗替尼组)和阳性药物组(50 mg·L-1 5-氟尿嘧啶),干预24 h。用活细胞计数(CCK-8)、细胞黏附实验、划痕法、Transwell小室及蛋白免疫印迹(WB)法对细胞增殖活力、黏附、迁移、侵袭能力及EMT相关蛋白表达量进行分析。结果 与对照组比较,5 μmol·L-1、10 μmol·L-1安罗替尼组和阳性药物组增殖活力显著降低(P<0.05),实验组和阳性药物组T98G细胞黏附、迁移、侵袭能力,纤维粘连蛋白(FN)、波形蛋白(Vimentin)、N-钙黏蛋白(N-cadherin)蛋白的表达水平呈现显著下调趋势(P<0.05),而E-钙黏蛋白(E-cadherin)蛋白的表达水平呈现明显上调趋势(P<0.05),且浓度越高变化越显著;与阳性药物组相比,2.5 μmol·L-1、5 μmol·L-1安罗替尼组细胞增殖活力、黏附、迁移、侵袭能力,N-cadherin、Vimentin及FN的蛋白水平上调(P<0.05),而E-cadherin蛋白水平则下调(P<0.05);10 μmol·L-1安罗替尼组与阳性药物组相比无显著差异(P>0.05)。结论 安罗替尼可能是通过抑制EMT进程进而抑制人脑胶质瘤T98G细胞的增殖、黏附、迁移、侵袭能力。
【关键词】 安罗替尼;脑胶质瘤;黏附;迁移;侵袭;上皮间质转化
【中图分类号】 R739.41 【文献标志码】 A 【文章编号】 1672-7770(2024)03-0286-06
脑胶质瘤属于临床常见的颅内恶性肿瘤,具有高复发率和高死亡率的特点。脑胶质瘤由于其特殊位置,发病较为隐匿,早期的临床症状不明显,因此往往发现时已多为晚期。手术、放化疗是目前治疗脑胶质瘤的主要方法;但对于晚期的脑胶质瘤患者而言,手术治疗并不适用,且该病术后复发率和转移率高,并有着较高的原发耐药率,导致当前总体疗效不甚理想[12]。因此探究有效治疗脑胶质瘤的药物具有重要意义。安罗替尼可以抑制肿瘤细胞的生长和转移,是一种多靶点酪氨酸激酶抑制剂,主要通过抗血管生成作用发挥抗肿瘤作用[3]。安罗替尼抗胃癌侵袭作用也有相关报道[4]。近些年多项研究显示上皮间质转化(epithelial-mesenchymal transition,EMT)与肿瘤的迁移、侵袭及耐药关系密切[5]。Guan等[6]研究发现,敲低视黄醇脱氢酶10的表达能通过调控相关信号通路抑制胶质瘤细胞的转移,其可能与肿瘤细胞EMT过程相关,肿瘤细胞发生EMT,其黏着力、形态、基质性状会发生改变,细胞形态向间充质转变,具有更高侵袭力,逐渐入侵周围的组织、血管及淋巴管等,发生远处转移[7]。目前安罗替尼对脑胶质瘤细胞黏附、迁移、侵袭及EMT的作用尚未完全阐明,本研究旨在探讨安罗替尼对脑胶质瘤细胞T98G黏附、迁移、侵袭及EMT进程的影响,为安罗替尼对脑胶质瘤的相关治疗提供体外实验依据。
1 材料与方法
1.1 材料 人脑胶质瘤T98G细胞,购自上海中科院细胞库。5-氟尿嘧啶[赛百慷(上海)生物技术股份有限公司]、安罗替尼(selleckchem公司),胎牛血清(美国Gibco公司),DMEM-H培养基(北京索莱宝生物科技有限公司),活细胞计数(cell counting kit-8,CCK-8)试剂盒(南京诺唯赞生物科技有限公司),鼠抗人[波形蛋白(Vimentin)、E-钙黏蛋白(E-cadherin)、纤维粘连蛋白(fibronectin,FN)、N-钙黏蛋白(N-cadherin)及β-actin单克隆抗体]、辣根过氧化物酶标记的山羊抗兔IgG及山羊抗鼠IgG多克隆抗体(英国Abcam公司)。BBS-V500型超净工作台(济南卓隆生物技术有限公司);WMS-1033型倒置荧光显微镜(上海无陌光学仪器有限公司);TG-21WC离心机购自山东博科公司;Gel Doc2000型凝胶成像系统(美国Thermo公司);Multiskan FC型酶标仪(美国Thermo公司)等。
1.2 方法
1.2.1 人脑胶质瘤T98G细胞培养 将冻存细胞脑胶质瘤T98G细胞进行复苏后(≥80%密度)接种于培养板或培养皿中,置于37 ℃,5% CO2,70%~80%湿度培养箱环境中,在完全培养基(含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM-H)上进行培养。
1.2.2 分组及给药 将细胞分成对照组、实验组、阳性药物组,其中对照组细胞不做干预,实验组(2.5 μmol·L-1安罗替尼组、5 μmol·L-1安罗替尼组、10 μmol·L-1安罗替尼组)分别以2.5 μmol·L-1、5 μmol·L-1、10 μmol·L-1安罗替尼进行干预。阳性药物组以50 mg·L-1 5-氟尿嘧啶进行干预,每组设置3个复孔,后置于37 ℃,5% CO2条件下培养。
1.2.3 CCK-8法测定人脑胶质瘤T98G细胞的增殖活力 将细胞胰酶消化后用完全细胞培养液重悬,细胞传代并以5×103个/孔的密度铺于96孔板中,待各组干预24 h之后,各孔加入10%(v∶v)CCK8溶液,并在37 ℃培养箱中孵育培养2 h,之后在酶标仪上检测各孔细胞在450 nm处的吸光度(optical density,OD)值。细胞活力(%)=OD(实验组或阳性药物组)/OD对照组×100%。
1.2.4 细胞黏附实验测定T98G细胞黏附数 用无胎牛血清培养液稀释重组人纤维连接蛋白后取20 μg·mL-1铺于96孔板,风干后用磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤3次,每次20 min。取各组干预24 h细胞,用胰蛋白酶消化细胞,并制成单细胞悬液。取100 μL单细胞悬液,浓度为1×104个/mL,加入铺胶的96孔板中,设3个复孔,置于37 ℃培养1 h,取出96孔板,进行3次洗涤后用甲醇进行相应固定,时间为10 min,接着用结晶紫进行染色,时间为15 min,然后再洗涤3次,最后于50倍显微镜下观察细胞黏附数。
1.2.5 划痕法测定T98G细胞的迁移能力 将细胞接种至6孔板,细胞生长密度约为90%后进行划痕,然后将细胞放置于37 ℃,5% CO2的条件下进行24 h培养。0和24 h的划痕情况使用显微镜进行拍照记录,S0与S24分别表示0和24 h的划痕面积。细胞迁移率=(S0-S24)/S0。
1.2.6 Transwell小室法测定T98G细胞的侵袭能力 将基质胶浓度用无血清的完全培养基进行稀释(1 mg/mL)后加入Transwell小室(100 μL),孵育5 h(37 ℃,5% CO2)使其呈干胶状。各组细胞在药物干预24 h后,重悬在无血清的完全培养基中,并将1×105个细胞接种到提前包被基质胶的Transwell小室的腔室中,Transwell小室和24孔板之间的腔室中加入500 μL含10%胎牛血清的完全培养基。细胞在37 ℃中继续培养24 h,小室下表面的细胞与4%组织细胞固定液室温孵育15 min,再与1%结晶紫染色液室温孵育20 min后利用显微镜进行拍照。侵袭细胞数使用Image J图像分析软件进行计算。
1.2.7 蛋白免疫印迹(western blotting,WB)法对EMT相关蛋白表达水平进行检测 收集各组细胞,提取蛋白并定量,后上样,进行凝胶电泳,200 mA电流转膜,封闭2 h,后加入鼠抗人(FN、E-cadherin、Vimentin、N-cadherin及β-actin)的一抗进行孵育、洗涤、二抗孵育、洗涤,加显影液,最后利用凝胶成像系统,进行相应的拍照记录,并用Image J软件进行蛋白灰度分析,β-actin为内参蛋白。
1.3 统计学分析 采用SPSS 25.0软件进行统计分析,采用均数±标准差(x-±s)表示符合正态分布的计量资料,采用单因素方差和Tukey检验进行多组间与组间的两两比较,以P<0.05认为差异具有统计学意义。用GraphPad Prism 8软件进行绘图。
2 结 果
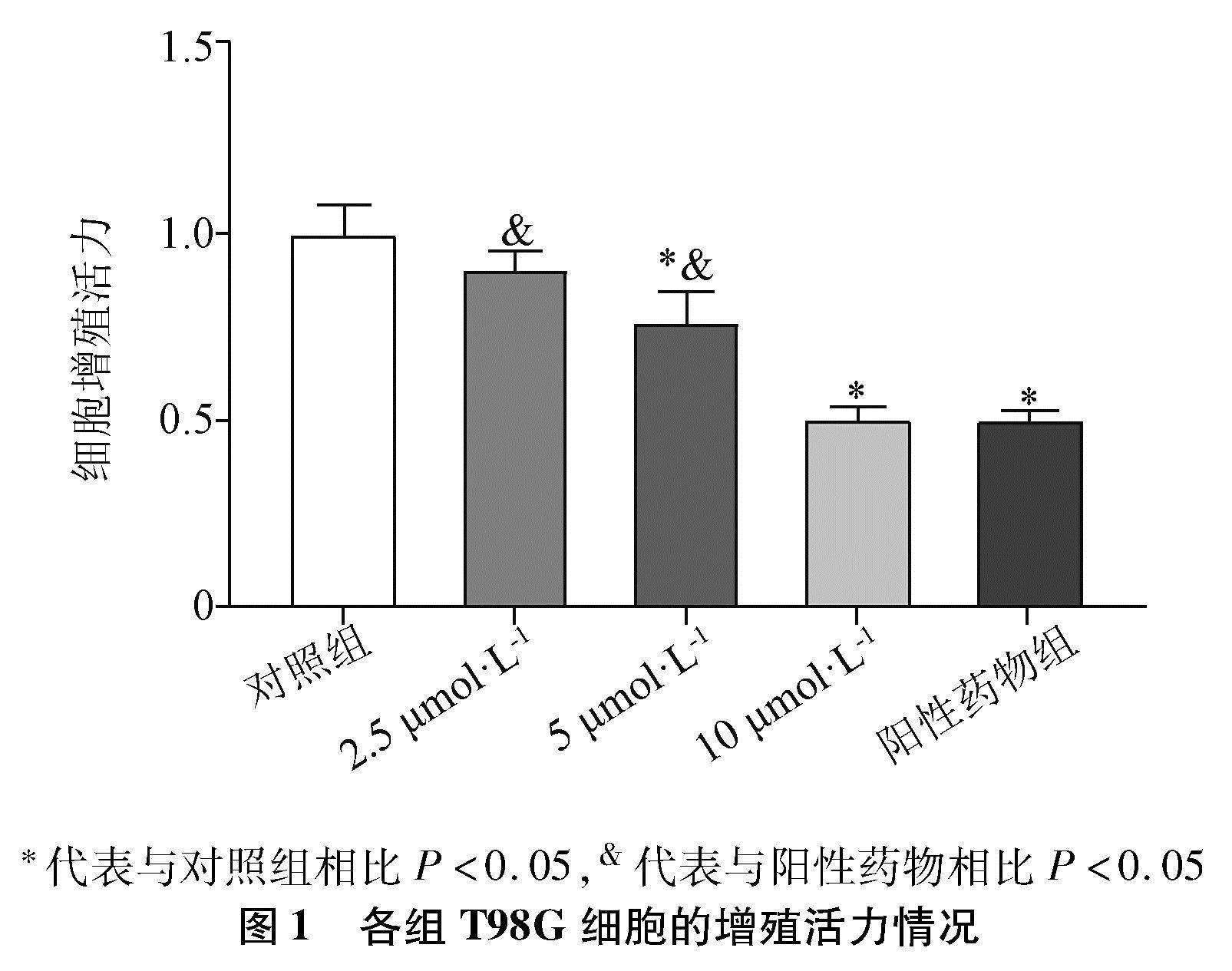
2.1 人脑胶质瘤T98G细胞的增殖活力 干预24 h后,与对照组相比,2.5 μmol·L-1安罗替尼组T98G细胞增殖活力没有显著变化(P>0.05),5 μmol·L-1、10 μmol·L-1安罗替尼组和阳性药物组细胞增殖活力显著降低(P<0.05)。2.5 μmol·L-1、5 μmol·L-1安罗替尼组与阳性药物组相比,细胞增殖活力显著升高(P<0.05);10 μmol·L-1安罗替尼组与阳性药物组相比,细胞增殖活力无显著差异(P>0.05),见图1。
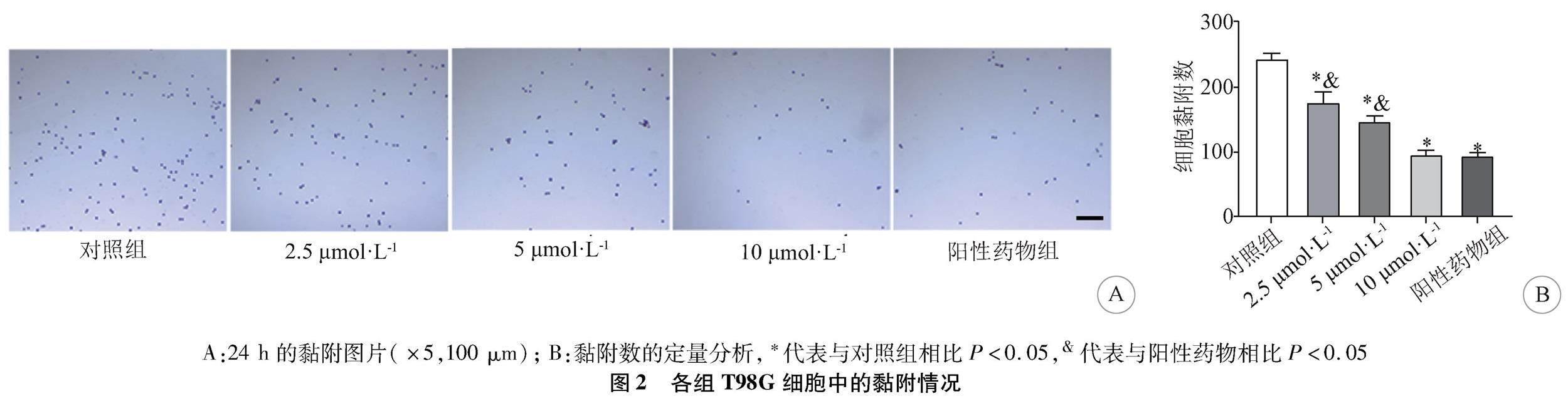
2.2 人脑胶质瘤T98G细胞的黏附能力 实验组、阳性药物组的细胞黏附数较对照组均减少;2.5 μmol·L-1、5 μmol·L-1安罗替尼组细胞黏附数较阳性药物组增多,10 μmol·L-1安罗替尼组与阳性药物组趋势一致(图2A)。实验组、阳性药物组的细胞黏附数较对照组降低(P<0.05),且实验组呈剂量依赖性(图2B)。2.5 μmol·L-1、5 μmol·L-1安罗替尼组细胞黏附数较阳性药物组升高(P<0.05);10 μmol·L-1安罗替尼组细胞黏附数较阳性药物组无统计学意义(P>0.05)。
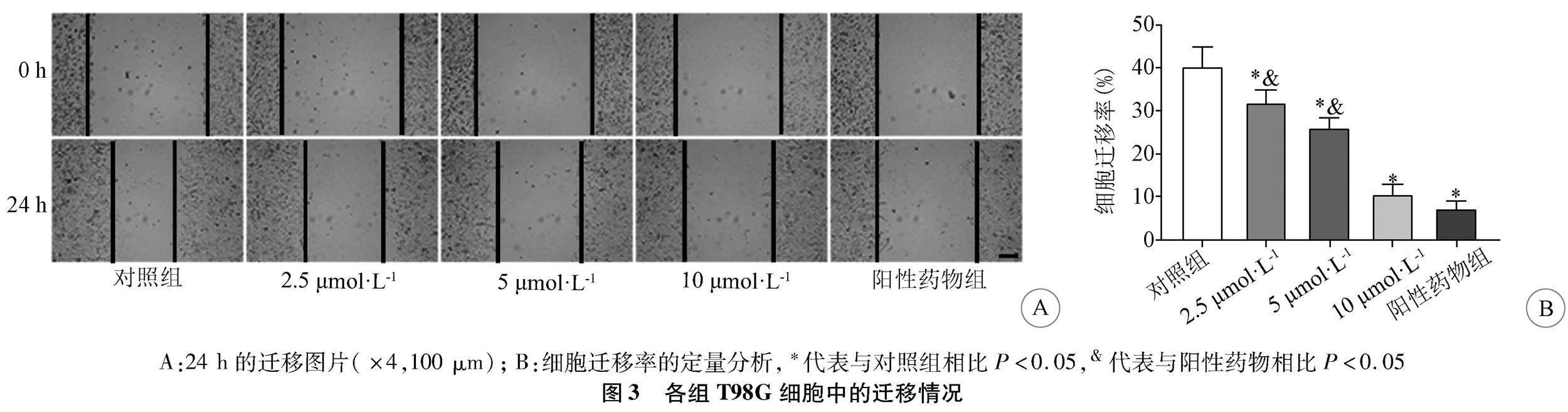
2.3 人脑胶质瘤T98G细胞的迁移能力 实验组、阳性药物组的细胞迁移数较对照组则明显减少;2.5 μmol·L-1、5 μmol·L-1安罗替尼组细胞迁移数较阳性药物组增多,10 μmol·L-1安罗替尼组与阳性药物组趋势一致(图3A)。实验组、阳性药物组的细胞迁移率较对照组降低(P<0.05),且实验组呈剂量依赖性(图3B)。2.5 μmol·L-1、5 μmol·L-1安罗替尼组细胞迁移率较阳性药物组升高(P<0.05);10 μmol·L-1安罗替尼组细胞迁移率较阳性药物组无显著差异(P>0.05)。
2.4 人脑胶质瘤T98G细胞的侵袭能力 实验组、阳性药物组的细胞侵袭数较对照组降低(P<0.05),且实验组呈剂量依赖性(图4)。2.5 μmol·L-1、5 μmol·L-1安罗替尼组细胞侵袭数较阳性药物组升高(P<0.05);10 μmol·L-1安罗替尼组细胞侵袭数较阳性药物组无统计学意义(P>0.05)。
2.5 人脑胶质瘤T98G细胞中EMT相关蛋白表达量情况 T98G细胞中E-cadherin蛋白水平较对照组发生上调(P<0.05),N-cadherin、Vimentin、FN蛋白水平发生下调(P<0.05),见图5A、B。2.5 μmol·L-1、5 μmol·L-1安罗替尼组E-cadherin蛋白表达水平较阳性药物组下调(P<0.05),而N-cadherin、Vimentin和FN蛋白水平较阳性药物组上调(P<0.05);10 μmol·L-1安罗替尼组EMT相关蛋白的表达水平较阳性药物组无统计学意义(P>0.05)。
3 讨 论
脑胶质瘤约占颅内肿瘤的一半,为中枢神经系统中常见肿瘤。目前临床治疗脑胶质瘤主要采用手术、放化疗等治疗手段,但肿瘤组织很难彻底清除,且容易复发[8]。脑胶质瘤细胞在生长过程中具有高度侵袭性,因此研发抑制脑胶质瘤细胞侵袭性生长的治疗药物具有极重要的理论意义与应用价值。安罗替尼属于临床上治疗晚期非小细胞肺癌的药物,近年来有很多相关研究发现安罗替尼除能够抑制肺癌细胞生长外,对其他肿瘤也同样可以发挥抑制作用[9]。谢转红等[10]研究显示,安罗替尼能够调控结肠癌细胞的增殖、迁移和侵袭。在宫颈癌中,安罗替尼抑制癌细胞的迁移和侵袭也有相关报道[11]。吴广银等[12]通过体内外实验发现,安罗替尼对胶质瘤有放疗增敏作用,且小窝蛋白表达下降调控丝裂原活化蛋白激酶磷酸化通路改变可能是其作用机制之一。以上研究提示,安罗替尼可以抑制多种肿瘤的转移和侵袭,可为本实验的开展提供理论支撑。本研究结果显示,与对照组相比,5 μmol·L-1、10 μmol·L-1安罗替尼组和阳性药物组增殖活力显著降低,而实验组和阳性药物组细胞黏附数、迁移和侵袭能力也明显降低,且本研究采用临床上常用的化疗药物5-氟尿嘧啶作为阳性药物[13]进行相关研究,结果显示2.5 μmol·L-1、5 μmol·L-1安罗替尼组与阳性药物组相比增殖活力、黏附、迁移和侵袭能力显著升高,10 μmol·L-1安罗替尼组与阳性药物组相比增殖活力、黏附、迁移和侵袭能力无显著差异,表明高浓度安罗替尼对胶质瘤细胞的抑制作用与阳性药作用相当;提示安罗替尼可以抑制脑胶质瘤细胞的增殖、黏附、迁移和侵袭。
上皮细胞在一系列生物学过程中获得具有迁移性与侵袭性间充质表型是EMT进程的典型特征[1415]。脑胶质瘤作为具有高度侵袭性的肿瘤细胞,其特性与其本身间质性发生改变具有密切的关系。在多种癌症中,均有文献报道EMT能够促进癌细胞的转移和侵袭,并且和癌细胞对化疗药物耐受有密切联系[1617]。Nan等[18]的研究也表明EMT能够促进胶质瘤细胞的侵袭。在胶质瘤细胞中,韩庆亮等[19]研究表明癌细胞的迁移和侵袭受到抑制与大黄酚调控EMT有关。张雪等[20]研究指出,在胃癌细胞中EMT相关蛋白的表达与胃癌细胞侵袭、迁移及黏附能力的增强有关。王勇等[21]研究显示,白藜芦醇能够抑制EMT进程抑制人脑胶质瘤T98G细胞的生长、黏附、迁移及侵袭。这些研究表明,脑胶质瘤侵袭性生长与EMT存在密切联系。Song等[22]在对胆管癌的研究表明,安罗替尼可以通过抑制EMT抑制癌细胞的迁移和侵袭。另有研究表明,安罗替尼可显著抑制人口腔鳞癌细胞的EMT进程[23]。在本研究中,实验组和阳性药物组的T98G细胞中E-cadherin蛋白水平较对照组发生上调,N-cadherin、Vimentin、FN蛋白水平发生下调,且安罗替尼浓度越高作用越明显;而相比于阳性药物组,2.5 μmol·L-1、5 μmol·L-1安罗替尼组的EMT相关蛋白的表达趋势则正好相反。以上结果与上述文献中报道一致,提示安罗替尼可能通过抑制EMT进程,从而在脑胶质瘤T98G细胞增殖、黏附、迁移和侵袭中发挥重要作用。
综上所述,安罗替尼可抑制人脑胶质瘤T98G细胞的增殖、黏附、迁移以及侵袭,可能与通过抑制EMT进程有关。但在其他脑胶质瘤细胞系中安罗替尼作用是否相同,且是否涉及相关信号通路机制尚未明确,需要进一步探究。
利益冲突:所有作者均声明不存在利益冲突。
[参 考 文 献]
[1] Igaki H.Radiotherapy for glioma[J].No Shinkei Geka,2021,49(3):575587.
[2] Huang W,Shi Y,Han B,et al.LncRNA GAS5-AS1 inhibits glioma proliferation,migration,and invasion via miR-106b-5p/TUSC2 axis[J].Hum Cell,2020,33(2):416426.
[3] 武阳,陆翰杰,水会锋.既往免疫经治的晚期非小细胞肺癌患者接受安罗替尼联合PD-1单抗的疗效及安全性[J].实用医学杂志,2023,39(5):572578.
Wu Y,Lu HJ,Shui HF.The efficacy and safety of anlotinib plus PD-1 blockades in patients with advanced non-small cell lung cancer previously treated with immunotherapy[J].J Pract Med,2023,39(5):572578.
[4] 张元元.安罗替尼对胃癌细胞增殖、侵袭、凋亡及淋巴管生成因子影响的研究[D].西安:西安医学院,2021.
ZHANG YY.Study on the effects of anlotinib on the proliferation,invasion,apoptosis,and lymphangiogenic factors of gastric cancer cells[D].XIan:Xian Medical College,2021.
[5] 雷洁琼,田迎霞,李正果,等.葡萄籽提取物原花青素通过LncRNA NBR2/miR-650调节EMT抑制肝癌细胞Hep3B增殖、迁移和侵袭的分子机制[J].中国老年学杂志,2023,43(17):43074312.
Lei JQ,Tian YX,Li ZG,et al.Proanthocyanidins extracted from grape seeds regulate the molecular mechanism of EMT inhibiting the proliferation,migration and invasion of hepatocellular carcinoma cell Hep3B through LncRNA NBR2/miR-650[J].Chin J Gerontol,2023,43(17):43074312.
[6] Guan F,Kang Z,Wang L,et al.Retinol dehydrogenase 10 promotes metastasis of glioma cells via the transforming growth factor-β/SMAD signaling pathway[J].Chin Med J,2019,132(20):24302437.
[7] Jia ZX,Zhang Z,Li Z,et al.Anlotinib inhibits the progress of colorectal cancer cells by antagonizing VEGFR/JAK2/STAT3 axis[J].Eur Rev Med Pharmacol Sci,2021,25(5):23312343.
[8] Zakaria R,Weinberg JS.Challenges associated with reoperation in patients with glioma[J].Neurosurg Clin N Am,2021,32(1):129135.
[9] Tang XL,Zheng Y,Jiao DM,et al.Anlotinib inhibits cell proliferation,migration and invasion via suppression of c-met pathway and activation of ERK1/2 pathway in H446 cells[J].Anticancer Agents Med Chem,2021,21(6):747755.
[10]谢转红,许云鹏,马珲敏,等.Tspan8基因敲除联合安罗替尼对结肠癌SW480细胞增殖、迁移、侵袭和凋亡的影响[J].肿瘤防治研究,2022,49(10):10281036.
Xie ZH,Xu YP,Ma HM,et al.Effects of Tspan8 gene knockout combined with anlotinib on proliferation,migration,invasion and apoptosis of colon cancer SW480 cells[J].Cancer Res Prev Treat,2022,49(10):10281036.
[11]陈彦民,邹明雷,李丽,等.安罗替尼通过上调miR-33b抑制PI3K/AKT信号通路来抑制HeLa增殖、迁移侵袭的作用机制[J].实用癌症杂志,2022,37(5):706711.
Chen YM,Zou ML,Li L,et al.Amrotinib inhibited HeLa proliferation and migration invasion by upregulating miR-33b and inhibiting the PI3K/AKT signaling pathway[J].Pract J Cancer,2022,37(5):706711.
[12]吴广银,赵瑞莹,李良,等.安罗替尼对胶质瘤放疗的增敏作用及其机制[J].中华实验外科杂志,2021,38(3):468471.
Wu GY,Zhao RY,Li L,et al.Observation and mechanism exploration of the radiotherapy sensitization effect of antinib on glioma[J].Chin J Exp Surg,2021,38(3):468471.
[13]Alk瘙塂 ME,Turan N,Alan Y,et al.Effects of electroporation on anticancer activity of 5-FU and newly synthesized zinc(II) complex in chemotherapy-resistance human brain tumor cells[J].Med Oncol,2021,38(11):129.
[14]高芳瑜,刘煊,田娣,等.lncRNA MRAK050699对二氧化硅粉尘诱导大鼠肺泡Ⅱ型上皮细胞上皮-间质转换的影响[J].环境与职业医学,2021,38(3):231237.
Gao FY,Liu X,Tian D,et al.Effect of lncRNA MRAK050699 on epithelial-mesenchymal transition in rat type Ⅱ alveolar epithelial cells induced by SiO2 dust[J].J Environ Occup Med,2021,38(3):231237.
[15]Chen SM,Zhao EF.Development and validation of a robust epithelial-mesenchymal transition(EMT)-related prognostic signature for hepatocellular carcinoma[J].Clin Res Hepatol Gastroenterol,2021,45(5):101587.
[16]Liu DH,Liu YZ,Qi B,et al.Trichostatin A promotes esophageal squamous cell carcinoma cell migration and EMT through BRD4/ERK1/2-dependent pathway[J].Cancer Med,2021,10(15):52355245.
[17]Fan YJ,Wang KY.MiR-205 suppresses cell migration,invasion and EMT of colon cancer by targeting mouse double minute 4[J].Mol Med Rep,2020,22(2):633642.
[18]Nan Y,Guo LY,Lu YL,et al.MiR-451 suppresses EMT and metastasis in glioma cells[J].Cell Cycle,2021,20(13):12701278.
[19]韩庆亮,张慧,郑慧军.大黄酚调控Wnt/β-catenin通路对胶质瘤U87细胞增殖、凋亡、侵袭能力及EMT的影响[J].新中医,2023,55(24):112118.
Han QL,Zhang H,Zheng HJ.Effects of chrysophanol regulating Wnt/β-catenin pathway on proliferation,apoptosis,invasion ability and EMT of glioma U87 cells[J].N Chin Med,2023,55(24):112118.
[20]张雪,赵丽丽,冯青青,等.HER-2通过影响EMT增强胃癌细胞的侵袭、迁移及黏附能力[J].现代肿瘤医学,2023,31(16):29562960.
Zhang X,Zhao LL,Feng QQ,et al.HER-2 enhances the invasion,migration and adhesion ability of gastric cancer cells by affecting EMT[J].J Mod Oncol,2023,31(16):29562960.
[21]王勇,吴运桥,邓任强,等.白藜芦醇阻断TGF-β1/Smad信号通路抑制脑胶质瘤细胞迁移侵袭及上皮间质转化[J].脑与神经疾病杂志,2023,31(10):614620.
Wang Y,Wu YQ,Deng RQ,et al.Resveratrol inhibits the migration and invasion of glioma cells and epithelial-mesenchymal transition by blocking TGF-β1/Smad signaling pathway[J].J Brain Nerv Dis,2023,31(10):614620.
[22]Song F,Hu B,Cheng JW,et al.Anlotinib suppresses tumor progression via blocking the VEGFR2/PI3K/AKT cascade in intrahepatic cholangiocarcinoma[J].Cell Death Dis,2020,11(7):573.
[23]彭有.安罗替尼抑制人口腔鳞癌细胞生物学行为的研究分析[D].呼和浩特:内蒙古医科大学,2022.
Peng Y.Study on anlotinib inhibits biological behavior of human oral squamous cell carcinoma cells[D].Hohhot:Inner Mongola Medical University,2022.
