信迪利单抗联合化疗治疗晚期胃癌的疗效及安全性分析
2023-09-01林依凡郑秋香廖东霞赖佛宝李孜荣陈志勇
林依凡,郑秋香,廖东霞,赖佛宝,李孜荣,陈志勇
(福建医科大学附属龙岩第一医院肿瘤内科,福建 龙岩 364000)
随着全球人口及致癌因素不断增多,恶性肿瘤发病率亦随之上升,成为危害人类身心健康的全球公共卫生问题,其中胃癌发病率达13.86/10万,每年近70万人因胃癌死亡,而胃癌发病率在我国仅次于肺癌,死亡率在恶性肿瘤中占第3位[1-2]。早期胃癌可以手术根治,而晚期胃癌因失去手术机会,化疗成为主要治疗方法,但疗效不佳,还会使免疫功能下降[2-4]。在肿瘤治疗领域中,免疫治疗作为一种新型手段已广泛用于肺癌、乳腺癌的治疗,其中程序性死亡受体(PD-1)作为一种重要的免疫抑制分子,表达于激活的T细胞中,PD-1抑制剂可使T细胞恢复活性,提高机体免疫功能[5-6]。信迪利单抗是一种人类免疫球蛋白G4(IgG4)单克隆抗体,能特异性结合T细胞表面,从而阻断导致肿瘤免疫耐受的 PD-1/PD-L1通路,重新激活淋巴细胞的抗肿瘤活性,从而达到治疗肿瘤的目的。但信迪利单抗在晚期胃癌治疗中的报道极少,本研究采用信迪利单抗联合XELOX方案治疗晚期胃癌,旨在分析其疗效及安全性。
1 材料与方法
1.1 一般资料
选择2021年7—2022年11月龙岩市第一医院肿瘤科收治的62例晚期胃癌患者作为研究对象,男42例,女20例,年龄47~74岁,平均(63.57±4.24)岁;病理分期:ⅢB期29例、ⅢC期20例、Ⅳ期13例;病理类型:未分化、低分化和高分化分别为17例、19例和26例;33例发现肝转移,29例无肝转移。按照随机等量原则分为对照组和观察组,每组各31例,两组临床资料比较无统计学差异(P>0.05),见表1。
表1 两组患者一般临床资料比较
纳入标准:①KPS评分>60分;② 预计生存期≥3个月;③能耐受化疗;④器官无严重功能障碍;⑤自愿参加并签署知情同意书[2-4]。
排除标准:①对所用药物过敏;②不能坚持化疗;③存在认知障碍或精神疾病;④既往采用化疗或其他方法治疗[2-4]。
1.2 方法
两组采用XELOX方案治疗,第1d静脉滴注奥沙利铂注射液[齐鲁制药(海南)有限公司,国药准字H20093167],130mg/m2;第1~14d给予卡培他滨片(上海罗氏制药有限公司,国药准字H20073024),1.0g/ m2,bid,po;观察组第1d加用信迪利单抗注射液[信达生物制药(苏州)有限公司,国药准字S20180016],200mg静脉滴注;3w为1个周期,共治疗3个周期[2-5]。
1.3 观察指标
近期疗效:完全缓解(CR):所有靶病灶消失,全部病理淋巴结(包括靶结节和非靶结节)短直径必须减少至<10 mm。部分缓解(PR):靶病灶直径之和比基线水平减少至少30%。疾病进展(PD):以整个实验研究过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%(如果基线测量值最小就以基线值为参照);除此之外,必须满足直径和的绝对值增加至少5 mm(出现一个或多个新病灶也视为疾病进展)。疾病稳定(SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD水平,介于两者之间,研究时可以直径之和的最小值作为参考;客观缓解率(ORR)=CR+PR,疾病控制率(DCR)=CR+PR+SD[2-5]。
肿瘤标志物及T淋巴细胞亚群:抽取5 mL空腹(空腹时间>8~12h)静脉血,静置20 min后离心15min(3 000 r/min,离心半径为8.5cm),检测癌胚抗原(CEA)、糖类抗原-199(CA-199)、糖类抗原-242(CA-242)、CD3+、CD4+、CD8+、CD4+/CD8+[4-6]。
1.4 统计学方法
采用SPSS 26.0统计学软件进行统计,计量资料采用t检验,计数资料采用χ2检验,等级资料采用秩和检验,检验水准α=0.05。
2 结果
2.1 两组临床疗效比较
观察组治疗3个周期后的ORR 和DCR分为58.06%和87.10%,高于对照组的32.26%和54.84%(P<0.05),见表2。
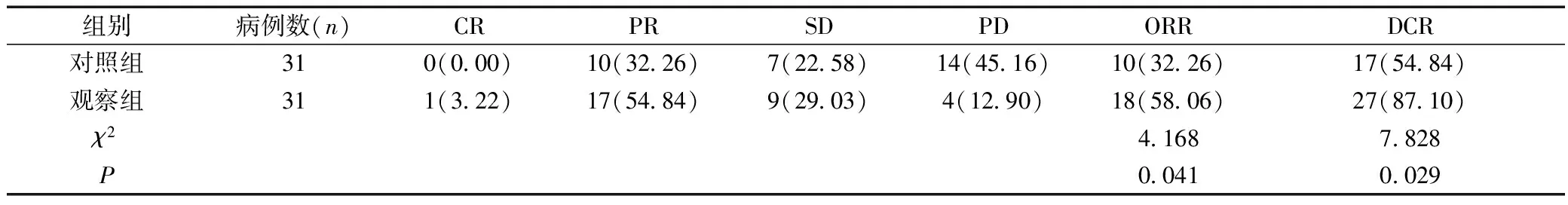
表2 两组临床疗效比较(n,%)
2.2 两组肿瘤标志物水平比较
治疗前,两组血清CEA、CA-199、CA-242水平无统计学差异(P>0.05); 两组治疗3个周期后的血清CEA、CA-199、CA-242水平低于治疗前(P<0.05),且观察组低于对照组(P<0.05),见表3。

表3 两组治疗前后血清CEA、CA-199、CA-242水平比较
2.3 两组T淋巴细胞亚群水平比较
治疗前,两组血清CD3+、CD4+、CD8+、CD4+/CD8+水平无统计学差异(P>0.05); 两组治疗3个周期后,观察组血清CD3+、CD4+、CD8+、CD4+/CD8+水平较治疗前升高/降低(P<0.05),且高/低于对照组(P<0.05),而对照组除CD4+/CD8+较治疗升高(P<0.05),治疗前后CD3+、CD4+、CD8+水平无统计学差异(P>0.05),见表4。

表4 两组治疗前后血清CD3+、CD4+、CD8+、CD4+/CD8+水平比较
2.4 两组安全性比较
两组治疗期间均出现不同程度的不良反应,但发生率比较无统计学差异(P>0.05),见表5。
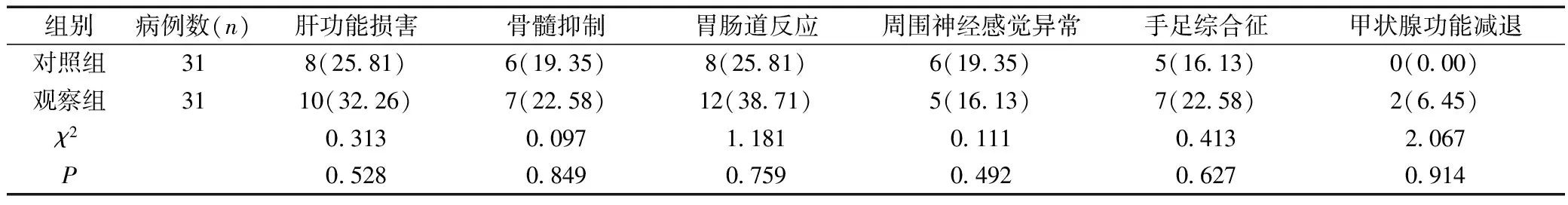
表5 两组不良反应比较(n,%)
3 讨论
Sung等[7]统计报道2020年全球有1 089 103例新发病胃癌患者,因胃癌死亡者超过76万,Kole C等[8]报道欧美国家胃癌患者的5年生存率为19%~31%,我国为28%,其中晚期胃癌的预后更差、生存率更低[9]。晚期胃癌失去手术治疗机会,只能采用化疗加快癌细胞凋亡,阻止细胞增殖、转移,延长生存时间[10],化疗方案多为含铂方案,包括XELOX、FOLFOX4、SOX、FP等,但中位总生存期均不足1年[11],许亚凤等[12]采用FOLFOX4方案治疗55例晚期胃癌患者,DCR仅为50.91%,与本研究对照组单纯采用XELOX方案的54.84%接近,均证实单纯化疗的近期疗效亦不十分理想。
PD-1作为T细胞表面主要抑制性分子之一,对其免疫应答具有非常重要的负性调控作用,抑制PD-1表达可以恢复T细胞的活性,有助于恢复自身T细胞杀伤肿瘤细胞能力,PD-1抑制剂较多,如信迪利单抗等[6,10]。众所周知,免疫治疗已经进入了一个快速发展的时期,大量的免疫抑制剂用于临床治疗,除信迪利单抗外,目前还出现了PD-1/CTLA4 双特异性抗体卡度尼利单抗[6,11],Ji等[13]采用卡度尼利单抗联合mXELOX/XELOX方案治疗胃/胃食管交界部癌,ORR和DCR为65.9%和92.0%,再次证实了晚期胃癌免疫治疗的疗效。信迪利单抗作为国产PD-1抑制剂,可有效阻断T细胞表面的PD-1通路,重新活化T细胞[2,4],本研究信迪利单抗联合XELOX方案,ORR和DCR分别为58.06%和87.10%,优于单纯XELOX方案的32.26%和54.84%,还能有效降低血清CEA、CA-199、CA-242水平,改善血清血清CD3+、CD4+、CD8+水平,而且治疗过程中并未增加不良反应,与文献报道相似[2,4,10]。
综上所述,晚期胃癌患者采用信迪利单抗联合化疗疗效较好,还有助于降低肿瘤标志物水平,提高机体免疫力,且安全性较好。
