瓜氨酸在增生型糖尿病视网膜病变患者房水中的浓度变化及其与炎症因子表达的相关性△
2023-08-31唐宁宁雷代在黄光怡刘玲娟
唐宁宁 蒋 莉 陆 鹏 雷代在 黄光怡 刘玲娟 崔 凌 赵 昕 徐 帆 唐 芬
糖尿病视网膜病变(DR)是糖尿病患者最常见的微血管并发症[1]。随着糖尿病患者人数的逐年增加,DR已成为成年人视力损害的主要原因[2-3]。慢性高血糖会破坏血-视网膜屏障,导致患者血管通透性增加以及视网膜缺血。当病变持续进展,出现新生血管异常增殖,非增生型DR将发展为增生型DR(PDR),从而导致患者出现难以逆转的严重视力损害并最终致盲[4]。
DR的病理机制尚未完全阐明,虽然已发现血糖控制不良及糖尿病病程是DR发生的危险因素,但却难以解释为什么这些危险因素相似的患者会表现出不同的DR进程。研究发现,瓜氨酸与糖尿病肾病及心肌损伤等糖尿病相关并发症关联密切[5-8]。此外,在DR患者血浆中瓜氨酸浓度也出现异常,提示瓜氨酸代谢失调可能与DR病理损伤相关。另外,研究显示,DR患者眼内液中炎症相关细胞因子表达增加[9-10],提示炎症可能是影响DR发生发展的重要因素。本研究探讨瓜氨酸在PDR患者房水中的浓度变化及其与炎症因子表达的相关性, 为深入理解PDR病理机制及其防治提供参考。
1 资料与方法
1.1 一般资料
1.1.1 分组
选取2021年11月至2022年8月于广西壮族自治区人民医院眼科住院拟行玻璃体切割术的PDR患者24例纳入研究组;选择同期因年龄相关性白内障拟行超声乳化白内障吸除术的无糖尿病史的患者24例纳入对照组。两组患者性别构成、年龄、眼压差异均无统计学意义(均为P<0.05)(表1)。本研究通过了广西壮族自治区人民医院伦理委员会审批(伦理编号:KY-GZR-2019-053号),各项操作遵循《赫尔辛基宣言》所要求的伦理学原则,患者均知情同意并签署知情同意书。
表1 两组患者临床资料比较
1.1.2 患者纳入和排除标准
患者纳入标准:(1)PDR患者均符合《中国糖尿病视网膜病变临床诊疗指南(2014版)》诊断标准[11];(2)患者均行眼底照相和荧光素眼底血管造影检查,经主任医师确诊为PDR;(3)年龄大于18岁;(4)临床资料完整;(5)签署知情同意书。排除标准:(1)合并青光眼、葡萄膜炎、眼外伤等其他眼病;(2)既往内眼手术史;(3)合并严重心、脑、肝、肾疾病;(4)合并全身免疫性疾病;(5)近期全身或局部使用免疫抑制剂、激素等药物治疗。
1.2 方法
1.2.1 房水采集
手术开睑,冲洗患者结膜囊。研究组患者行球后阻滞麻醉,对照组患者行表面麻醉,之后使用0.5 mL 注射器在角膜缘内1 mm处行前房穿刺,缓慢抽取房水约0.1 mL,细致操作,避免污染及损伤眼内组织。随后将房水样本立即转移至-80 ℃冰箱保存。
1.2.2 检测瓜氨酸浓度
使用高效液相色谱串联质谱法检测患者房水样本中的瓜氨酸浓度,设定扫描模式为多反应检测扫描模式。房水样品经沉淀、振荡离心预处理后,取上清液上机。采用ACQUITY UPLC I-Class超高效液相色谱(1.8 μm, 100.0 mm×2.1 mm,美国 Waters 公司)串联QTRAP 5500三重四级杆质谱(美国SCIEX公司)组成的液质联用系统进行检测分析。
1.2.3 检测炎症因子含量
采用多重微珠免疫法(Milliplex人细胞因子试剂盒,美国Millipore公司)检测患者房水中白细胞介素(IL)-6、IL-8、IL-10、IL-1β、IL12-P70、IL-17A含量。每个反应使用25 μL的房水样品。根据试剂盒说明进行操作,并使用Bio-Plex悬浮阵列系统(BioPlex200,美国Bio-Rad公司)进行分析。
1.3 统计学分析
应用SPSS 21.0软件进行统计学分析。计量资料用均数±标准差表示,两组比较采用独立样本t检验。计数资料用频数表示,两组间比较采用卡方检验。采用Pearson相关分析确定变量间相关性。检验水准:α=0.05。
2 结果
2.1 两组患者房水中瓜氨酸浓度比较
研究组和对照组患者房水中瓜氨酸浓度分别为(17.946±11.354)μmol·L-1和(28.612±7.135)μmol·L-1,两组间差异有统计学意义(t=3.896,P<0.001)。
2.2 两组患者房水中炎症因子含量比较
研究组患者房水中IL-6、IL-8、IL-1β含量均高于对照组,差异均有统计学意义(均为P<0.05);两组患者房水中IL-10、IL12-P70含量差异均无统计学意义(均为P>0.05)(表2)。两组患者房水中均未检测到IL-17A。
2.3 瓜氨酸浓度与房水炎症因子含量相关性分析
Pearson相关分析结果显示:研究组患者房水中瓜氨酸浓度与IL-8含量呈负相关性(r=-0.609,P=0.036),而与其他炎症因子含量无明显相关性(均为P>0.05)。
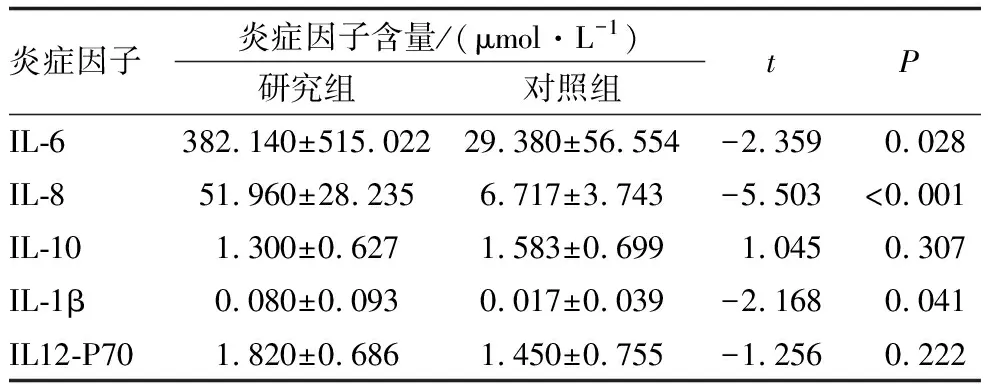
表2 两组患者房水中炎症因子含量比较
3 讨论
目前,炎症及代谢谱异常在DR发生发展中的作用备受关注。本研究结果显示,研究组患者房水中IL-6、IL-8、IL-1β含量均高于对照组,这些因子是重要的促炎细胞因子,参与多途径炎症级联反应[12-15],其表达升高提示炎症反应与PDR发生发展密切相关。与此同时,瓜氨酸浓度下降,相关分析显示瓜氨酸浓度与IL-8含量呈负相关性,提示眼内微环境中的炎症反应可能与瓜氨酸代谢失调有关。炎症反应及瓜氨酸代谢失调共同参与了PDR的病理过程。
瓜氨酸是多个代谢途径中的关键分子,在体内有多种代谢途径,因此其与DR及炎症反应的关系极为复杂。瓜氨酸是内源性精氨酸合成的前体和限制性因素。在正常条件下,瓜氨酸在精氨基琥珀酸合酶及精氨基琥珀酸裂解酶的催化下,转化为精氨酸[16],体内可利用的瓜氨酸含量直接限制了上述精氨酸合成过程[17-18]。此外,精氨酸在体内一氧化氮合酶的催化下,可转化为瓜氨酸和一氧化氮 (NO)。NO是氧化应激损伤修复及炎症反应过程中的重要因子,具有调节血管内皮细胞增殖及清除氧自由基的功能[19],其合成受到炎症反应强度影响。
研究显示,在动脉粥样硬化、糖尿病、高胆固醇血症、缺血性心脏病和高血压等多种疾病氧化应激状态下,瓜氨酸转化合成的内源性精氨酸减少,精氨酸可利用率下降, 一氧化氮合酶-3解偶联,NO合成减少并形成超氧化物,从而导致代谢及氧化应激损伤。而在炎症反应过程中,肿瘤坏死因子-α、IL-1、IL-6、IL-8等细胞因子表达上调,一氧化氮合酶-2被激活,NO过度产生并形成过氧亚硝酸盐等,从而干扰细胞代谢、诱导血管渗漏[20]。通过补充外源性瓜氨酸,可有效改善体内的精氨酸代谢及NO平衡,从而改善多种急慢性炎症病理损伤过程[21-23]。因此,我们推测,在炎症因子的影响下瓜氨酸的代谢过程可能会出现紊乱,从而影响精氨酸及NO的代谢,导致DR的发生与发展。
多项研究显示,在DR患者的不同类型组织液中瓜氨酸浓度呈现显著差异。研究报道,相较于非DR患者,DR患者血浆[24]及玻璃体液[25-26]中瓜氨酸表达上调,而在房水[27]中,瓜氨酸表达则相对下降,本研究患者房水中瓜氨酸浓度的变化与文献报道相符。这提示瓜氨酸代谢过程较为复杂,其在DR发生发展中的作用机制尚需进一步研究。
4 结论
本研究结果显示,PDR患者房水中瓜氨酸浓度下降,并与IL-8含量呈负相关性,提示瓜氨酸表达失调可能参与了DR的发生发展过程,这为深入理解DR的病理机制提供了依据。但本研究样本量小,未能对比不同DR分期患者组织液中瓜氨酸的浓度变化,未来仍需更大样本的研究以进一步阐明相关代谢机制。
