鲜茧/干茧生丝HPLC指纹图谱的构建研究
2023-08-31徐航马明波叶飞杨亚娟周文龙
徐航 马明波 叶飞 杨亚娟 周文龙







摘要: 利用高效液相色谱,获取不同來源鲜茧和干茧生丝的高效液相色谱图,然后通过特征组分信息的提取,文章分别建立鲜茧/干茧生丝各自的HPLC(高效液相色谱法)指纹图谱,并利用指纹图谱对生丝样品进行相似度评价和系统聚类分析,来验证其对生丝的区分效果。结果表明:鲜茧生丝样品之间相似度大于0.919,干茧生丝样品之间相似度大于0.945,同类生丝的一致性良好。但鲜茧、干茧生丝的指纹谱图存在明显差别,说明两类生丝的特征组分不同。根据两类生丝的特征差异进行系统聚类分析,可以完成对两类生丝的准确区分。经方法学验证,指纹图谱用于鲜茧、干茧生丝定性时具有良好的可靠性和可重复性。鲜茧/干茧生丝HPLC指纹图谱能反映出两类生丝的组分差异,可以作为鲜茧/干茧生丝的区分依据。
关键词: 鲜茧生丝;干茧生丝;高效液相色谱;指纹图谱;相似度评价法;聚类分析
中图分类号: TS102.33 文献标志码: A
文章编号: 10017003(2023)080021-07
引用页码: 081103 DOI: 10.3969/j.issn.1001-7003.2023.08.003
在生丝的生产中,蚕茧不进行烘茧,直接在真空渗透后进行缫制称为鲜茧生丝;而经过烘茧、煮茧工序缫制的生丝,则被称为干茧生丝。中国的丝绸企业一般采用干茧生丝为主要生产原料,但因为鲜茧生丝工序较少,大幅降低了缫丝过程中的能源消耗,同时还产生了额外的副产品效益,因此在近年来得到了快速推广[1]。但蚕丝由多种蛋白质构成,还含有酰胺类、多酚类、酯类等微量组分。当采用不同的缫丝工艺时,构成生丝的蛋白质会发生物理或化学变性[2],微量组分也会不同程度地挥发、降解及溶失。这些差别使鲜茧/干茧生丝的抱合、拉伸、洁净等性能出现了明显差异[3],不利于生丝市场交易的规范和生丝产品质量的控制。因此,需要对鲜茧/干茧生丝的差异进行研究,以更好区分两类生丝产品。
目前,已存在一些鲜茧/干茧生丝的鉴别方法。李冰等[4]通过测定并比较生丝束在十二烷基苯磺酸钠水溶液中的沉降速度,来对鲜茧/干茧生丝进行鉴别。乔铁军等[5]对两类生丝进行抱合力项目检测,通过干茧生丝抱合力显著优于鲜茧生丝对两者进行了区分。盖国平等[6]利用扫描电镜观察纤维表面,通过微观形貌差异来区分出鲜茧生丝和干茧生丝。此外,目前还有基于红外光谱、X射线衍射[3]、高效液相色谱[7]等检
测技术对鲜茧/干茧生丝进行鉴别的方法。但由于生丝的内部组成成分复杂,其中的附生物还会受到地域、季节、蚕种等因素的影响[8]。因此,对于市场上来源复杂的生丝产品,目前的鉴别方法难以达到稳定、精确的鉴别效果。
指纹图谱法在综合反映样品组分差异的同时还能系统地展现出样品特征,能为不同种类样品的鉴别提供可靠依据,已被广泛应用于食品的品种判别[9]、中医药材[10]的鉴定等领域中。本文在充分考虑鲜茧、干茧生丝来源的复杂性,获取具有代表性的、不同来源的鲜茧和干茧生丝的高效液相色谱图。在高效液相色谱的基础上提取共性组分色谱数据,构建了鲜茧和干茧生丝样品的共有模式指纹图谱,并通过相似度评价和聚类分析,对不同种类的生丝样品进行归类和鉴别。以期在面对来源复杂的生丝产品时,提高鲜茧/干茧生丝区分结果的准确性,为生丝市场的交易规范和织绸企业的原料选购提供依据。
1 实 验
1.1 材料与仪器
1.1.1 材 料
去离子水(实验室自备),分析纯甲醇、醋酸(杭州高晶精细化工有限公司)。实验所用蚕茧样品于2022年5月—2022年11月采购自浙江、江苏、广西等传统蚕茧主产区的农户和庄口,均为活蛹蚕茧。选择12个不同批次的蚕茧制备为鲜茧生丝样品(编号为S1~S12)和12个不同批次的蚕茧制备为干茧生丝样品(编号为R1~R12),各样品的产地、蚕种及茧期信息如表1所示。
1.1.2 仪 器
AR124CN电子分析天平(美国奥豪斯仪器上海有限公司),GZX-9140 MBE数显鼓风干燥箱(上海博讯实业有限公司医疗设备厂),HH-12468数显恒温水浴箱(常州鸿泽实验科技有限公司),R201D旋转蒸发仪(上海亚荣生化仪器厂),JP-100S型超声波清洗机(深圳洁盟超声清洗机有限公司),DHG-9055A鼓风干燥箱(上海瑞稳仪器设备厂),LC-100高效液相色谱仪(上海伍丰色谱仪器有限公司)。
1.2 方 法
1.2.1 缫丝工艺
干茧缫丝工艺:经过剥选后的蚕茧放入烘箱,采用热风循环干燥法进行烘茧。头冲温度110 ℃,烘茧时间2 h,二冲温度设定为80 ℃,烘茧时间4 h。将烘干后的蚕茧完全浸入60 ℃的水中,浸渍处理3 min。浸渍完成后进行真空渗透,真空渗透度设定为0.1 MPa,在40 ℃的温水中渗透10 min。待蚕茧渗透充分后取出,放入煮茧汤锅,设置100 ℃的水温进行煮茧2 min。加冷水调整水温至80 ℃,压煮、浮煮3 min,并进行索绪。煮茧完成后调整汤温至40 ℃。理绪后通过手摇式缫丝机进行缫丝,将缫制的生丝置于室内通风场所自然干燥24 h至完全干燥。
鲜茧缫丝工艺:将经过剥选的蚕茧完全浸入60 ℃的水中,浸渍处理3 min,然后进行真空渗透,设置真空渗透度为0.1 MPa,渗透水温40 ℃,渗透时间10 min。渗透完成后继续保持水温40 ℃不变,进行索绪、理绪,然后利用手摇式缫丝机进行缫丝,并将得到的生丝置于室内通风场所自然干燥24 h至完全干燥。
以上缫丝过程均在实验室内完成。
1.2.2 生丝提取液的制备
将干燥后的生丝均匀剪碎至1 mm,用AR124CN电子分析天平称取剪碎的生丝放入烧杯并加入去离子水(浴比为1︰25),搅拌至茧丝完全浸润。然后将装有茧丝的烧杯放入JP-100S型超声波清洗机,辅助提取90 min(40 ℃、300 W),之后进行抽滤。将滤液转移至R201D旋转蒸发仪,设置真空度为0.1 MPa,温度为50 ℃。待滤液彻底蒸干后,加入1 mL去离子水重新溶解生丝提取物。充分溶解后,用0.22 μm过滤膜对溶液再次过滤,然后转移到HPLC样品瓶中等待测试。
1.2.3 HPLC测试
采用LC-100高效液相色谱仪对样品进行检测。色谱柱为Sharpsil-U C18(4.6 nm×250 nm,5 μm),流动相A选择甲醇,流动相B选择体积分数0.3%的乙酸水溶液。洗脱方法选择梯度洗脱方法,洗脱程序为0~15 min,10%~50% A;15~18 min,50%~100% A;18~21 min,100%~10% A;流速设置为1.0 mL/min,进样量20 μL;检测波段选择280 nm波段,柱温设置在30 ℃。
1.2.4 方法学考察
精密度测试方法:取同一份生丝样品,按1.2.2操作方法提取待测溶液,按1.2.3色谱条件进行测试操作,连续进样6次。
重复性测试方法:取同种生丝样品6份,按1.2.2操作方法提取待测溶液,制备6份供试样品溶液,并以相同条件进行测试。
稳定性测试方法:取同种生丝样品,根据1.2.2操作方法提取待测溶液,并按1.2.3色谱条件分别于0、2、4、8、12、24 h进行测定。记录各色谱峰保留时间,通过参照峰的设定计算相对峰面积,最后根据两者的相对标准偏差进行考察。
1.2.5 HPLC指纹图谱的构建
将鲜茧和干茧生丝样品按1.2.2方法进行高效液相色谱测试,记录HPLC图谱并按照生丝的种类进行分类。将完成分类的鲜茧/干茧生丝指纹图谱分别导入相似度评价系统,选定参照图谱,设置0.1 min为时间宽度。对色谱峰多点校正,然后进行色谱峰的自动匹配,记录各特征峰的保留时间和峰面积对色谱信息完成标定。选择分离度好、峰强高且为同组样品共同具备的特征峰作为参照峰,将参照峰的峰面积记为1,计算其余色谱峰的相对峰面积。并通过相对峰面积和保留时间的相对标准偏差结果对各样品中组分的差异情况进行分析。最后,选择平均数法拟定生成鲜茧和干茧生丝各自的HPLC共有模式谱图,从而完成指纹图谱的构建。
相对峰面积计算公式为:
式中:ai为目标峰面积,as为参照峰面积。
相对标准偏差(RSD)计算公式为:
式中:xi为目标峰参数,x为同组参数平均值,n为色谱峰个数。
1.2.6 相似度评价
相似度评价指将复杂的图谱数据先转化为多维向量,然后进行相似度值计算来完成对数据的量化描述,能够直观且定量地描述出各图谱间的相似性。因为夹角余弦测度能够有效地反映出指纹图谱间谱峰的比例关系[11],所以本文选择各组茧丝的共有指纹图谱为参照图谱,通过夹角余弦公式完成各图谱的相似度计算,以此来对测试所得的鲜茧/干茧生丝HPLC图谱进行相似度评价。夹角余弦法计算公式为:
式中:n为共有峰总数,aik是指第i个样品HPLC图谱中第k个特征峰的峰面积,bk为参照图谱中第k个特征峰的峰面积。
1.2.7 系统聚类分析
聚类分析可依据图谱数据的特征,将相似度大的样品逐步归聚为一类,以此对不同种类的样品完成区分。由于聚类分析法能直观体现出样品间的关系,故对鲜茧/干茧生丝进行聚类分析以达到鉴别的目的。将两种不同类型的生丝样品的HPLC图谱数据导入SPSS 26.0,并完成标准化处理。选择变量作为聚类对象,以组间联结法为聚类方法,Squared Euclidean Distance为度量标准,对标准化处理后的数据进行聚类分析。最后依据聚类分析结果,考量聚类分析法对生丝样品的区分效果。
2 结果与分析
2.1 方法学考查
2.1.1 精密度
从精密度实验结果中得出,各色谱主要特征峰的保留时间RSD在0.09%~0.99%内,相对峰面积的RSD在1.02%~2.76%内。结果说明,实验所用仪器精密度良好。
2.1.2 重复性
从重复性实验结果中得出,各色谱主要特征峰的保留时间RSD在0.35%~0.64%內,相对峰面积的RSD在0.44%~1.93%内。结果说明,实验方法的可重复性良好,能适用于生丝的HPLC指纹图谱检测。
2.1.3 稳定性
从稳定性实验结果中得出,各色谱主要特征峰的保留时间RSD在0.38%~0.87%内,相对峰面积的RSD在1.09%~2.58%内。结果说明,生丝提取溶液样品在24 h内稳定。
2.2 指纹图谱的构建
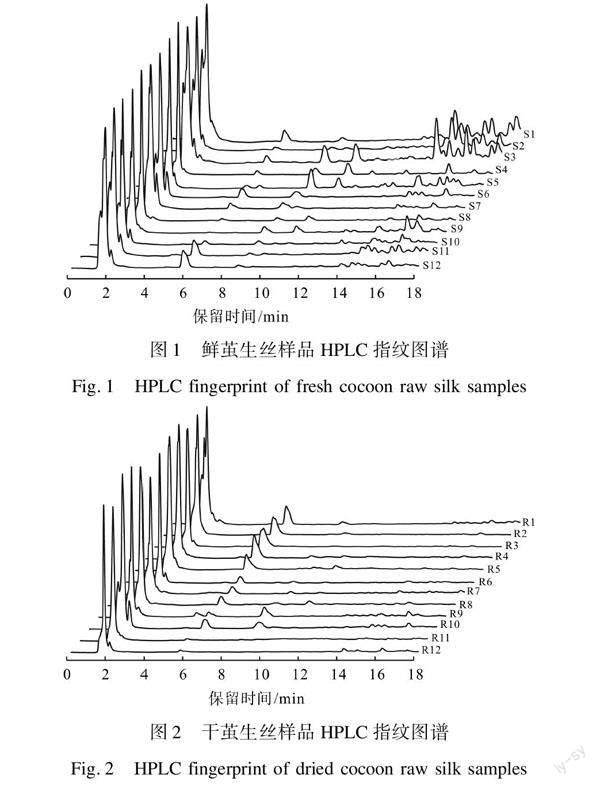
按1.2.1的缫丝工艺分别进行鲜茧/干茧生丝样品的制备,将各样品通过1.2.2方法提取待测溶液,再将提取液按1.2.3色谱条件进行测试。由于色谱峰主要集中于保留时间前18 min的部分,且分离度较好。而保留时间18~20 min的部分色谱峰较大且难以分离,故将后2 min的色谱峰舍弃,选择前18 min的色谱峰进行HPLC指纹图谱的构建,最终得到鲜茧和干茧生丝的液相色谱图,如图1、图2所示。
对鲜茧生丝样品的指纹图谱进行分析,由于保留时间1.71 min的色谱峰强度高、分离度好,因此设定其为参照峰。按照1.2.5中的方法得出各峰的相对峰面积和平均保留时间,并进一步计算出两者的相对标准偏差,结果如表2所示。以相同的方法对干茧生丝样品的指纹图谱进行分析计算,参照峰选择保留时间1.70 min的色谱峰,最终计算结果如表3所示。
从分析结果可知,鲜茧生丝样品的保留时间RSD在0.21%~1.17%,各成分具有较好的保留重现性,相对峰面积的RSD在20.42%~107.27%,说明各主要特征组分的含量存在较大的差异,不同产地、不同蚕种和不同结茧时间的茧丝的指纹图谱具有一定的差别。干茧生丝样品的保留时间RSD在0.01%~1.36%,相对峰面积的RSD在4.72%~88.15%,结果表明干茧生丝同样具有较好的保留重现性,各主要特征组分的含量也存在着一些差异,但整体差异的大小要明显小于鲜茧生丝。分析认为是由于干茧生丝在缫丝过程中经过高温烘茧、煮茧等工艺使得生丝内部的共有可挥发热敏感组分发生挥发、降解及溶失,从而使得干茧生丝在主要特征组分含量上与鲜茧生丝产生差别。
2.3 共有模式图谱的拟定及相似度评价
2.3.1 共有模式谱图的拟定
将鲜茧生丝样品(S1~S12)的指纹谱图导入相似度评价系统,设定S1号图谱为参照图谱,按1.2.5中的操作流程生成并导出鲜茧生丝指纹图谱的共有模式图谱,如图3(a)所示。将干茧生丝样品(R1~R12)按照上述相同步骤得到干茧生丝指纹图谱的共有模式图谱,如图3(b)所示。
由图3可知,鲜茧生丝样品的HPLC共有图谱在保留时间1.71 min处有分离度良好的强峰出现,在保留时间2.02、5.87、8.69 min和10.34 min处出现了中等强度色谱峰,同时保留时间14.59 min之后还存在许多信号较弱的色谱峰。干茧生丝样品的HPLC共有图谱显示在保留时间1.70 min处有分离度良好的强峰出现,但是仅在保留时间2.02、5.64 min处出现了中等强度色谱峰,保留时间6.50 min之后峰形较为平缓,只出现少量轻微的信号波动。根据文献[7]可知,保留时间6.50 min之后色谱峰代表的主要组分是附着于丝胶表面的多酚类化合物,而其在干茧缫丝过程中经过烘茧、煮茧工序时,容易发生热解和溶失。正是由于鲜茧生丝和干茧生丝中多酚类化合物成分和含量的不同,使得两类茧丝的共有模式图谱在特征色谱峰数量和峰形上产生了明显差别。因此,利用这些生丝特征组分上的差异,可对鲜茧/干茧生丝进行鉴别区分。
2.3.2 相似度评价
在得出鲜茧/干茧生丝样品的HPLC共有指纹图谱后,按1.2.6中的方法对其进行相似度评价,最终相似度结果如表4所示。相似度结果显示,鲜茧生丝样品的夹角余弦系数在0.919以上,干茧生丝样品的夹角余弦系数在0.945以上。结果表明,在同类型的生丝之间,生丝提取物色谱峰的一致性较高,两类生丝样品的共有模式图谱能够较为准确地反映出各自的图谱信息,并且干茧生丝之间的相似性要高于鲜茧生丝。因此,可以利用相似度评价结果作为判定阈值,通过和样品的相似度值进行比较,对两种类型的生丝进行初步区分。
2.3.3 系统聚类分析
选择鲜茧生丝样品(S1~S12)和干茧生丝样品(R1~R12)的HPLC图谱数据,按1.2.7中的方法完成系统聚类分析,如图4所示。结果表明,当聚类重新标度距离为2时,所有样品被聚为三类,即S1~R4、S9~R12号鲜茧生丝聚为一类,S4~S8号鲜茧生丝聚为一类,R1~R12号干茧生丝全部被聚为一类,已可对鲜茧/干茧生丝进行初步的区分。当聚类重新标度距离大于3时,全部的24个生丝样品聚为两类,即S1~S12号鲜茧生丝聚为一类,R1~R12号干茧生丝聚为一类,两类茧丝此时能被完全区分开来。综上表明,通过系统聚类分析的方法可以对不同类型的生丝做出准确区分。
3 结 论
本文通过建立鲜茧/干茧生丝各自的HPLC指纹图谱,实现了对两类生丝的有效区分。
1) 通过对鲜茧和干茧生丝HPLC指纹图谱进行方法学考察,验证了该方法用于鲜茧/干茧生丝检测时准确性、可重复性和稳定性良好,所建立的鲜茧/干茧生丝HPLC指纹图谱可靠性高。
2) 鲜茧/干茧生丝样品HPLC指纹图谱的保留时间RSD均小于1.36%,说明两类生丝的特征组分种类相似;鲜茧生丝的相对峰面积RSD为20.42%~107.27%,干茧生丝的相对峰面积RSD为4.72%~88.15%。表明不同生丝的组分会因各自产地、蚕种及茧期的变化而产生差异。
3) 拟定出鲜茧、干茧生丝各自的HPLC共有模式指纹图谱,两者之间在峰形和峰面积上具有明显差异。以共有模式图谱为参照对样品进行相似度评价,鲜茧生丝样品的相似度均大于0.919,干茧生丝样品相似度均大于0.945,同种茧丝之间的差异性较小。
4) 通过系统聚类分析法对鲜茧/干茧生丝样品进行歸类,当聚类重新标度距离超过3时,可以将两种类型的生丝样品完全区分开来。说明通过聚类分析能够准确区分出生丝的种类,达到了区分鲜茧/干茧生丝的目的。
参考文献:
[1]胡彬慧, 谢启凡, 杨明英, 等. 鲜茧缫制生丝的热学性能研究[J]. 蚕业科学, 2017, 43(4): 648-656.
HU Binhui, XIE Qifan, YANG Mingying, et al. Research on thermal properties of raw silk reeled from fresh silkworm cocoons[J]. Acta Sericologica Sinica, 2017, 43(4): 648-656.
[2]AZNAR-CERVANTES S D, PAGAN A, SANTESTEBAN B M, et al. Effect of different cocoon stifling methods on the properties of silk fibroin biomaterials[J]. Scientific Reports, 2019, 9(1): 6703.
[3]章琪超, 江文斌, 傅雅琴. 鲜茧生丝与干茧生丝的结构性能差异研究[J]. 现代纺织技术, 2015, 23(1): 1-5.
ZHANG Qichao, JIANG Wenbin, FU Yaqin. Research on difference of fresh cocoon raw silk and dried cocoon raw silk in structure and performance[J]. Advanced Textile Technology, 2015, 23(1): 1-5.
[4]李冰, 盖国平, 郭蔚, 等. 鲜茧与干茧生丝的结构与性能比较及其鉴别方法[J]. 纺织学报, 2019, 40(3): 32-38.
LI Bing, GE Guoping, GUO Wei, et al. Comparison between structure and performance of fresh cocoon raw silk and dry cocoon raw silk and identification methods thereof[J]. Journal of Textile Research, 2019, 40(3): 32-38.
[5]喬铁军, 王仑, 张秀琍, 等. 干茧丝与鲜茧丝抱合指标的差异性实验与分析[J]. 丝绸, 2009, 46(10): 32-33.
QIAO Tiejun, WANG Lun, ZHANG Xiuli, et al. The cohesive force difference experiment and analysis between drying-cocoon silk and fresh-cocoon silk[J]. Journal of Silk, 2009, 46(10): 32-33.
[6]盖国平, 李艳, 蒋小葵, 等. 鲜茧生丝与干茧生丝的耐微脱胶性对比[J]. 丝绸, 2016, 53(2): 26-31.
GE Guoping, LI Yan, JIANG Xiaokui, et al. A comparative study of anti-microdegumming property of fresh cocoon raw silk and dried cocoon raw silk[J]. Journal of Silk, 2016, 53(2): 26-31.
[7]王聪磊, 马明波, 董锁拽, 等. 焙烘处理对鲜茧生丝多酚微量组分的影响[J]. 丝绸, 2017, 54(10): 1-6.
WANG Conglei, MA Mingbo, DONG Suozhuai, et al. Effect of baking treatment on polyphenols trace components in fresh raw silk[J]. Journal of Silk, 2017, 54(10): 1-6.
[8]MALAY A D, SATO R, YAZAWA K. et al. Relationships between physical properties and sequence in silkworm silks[J]. Scientific Reports, 2016, 6(1): 27573.
[9]ESTEKI M, SHAHSAVARI Z, SIMAL-GANDARA J. Food identification by high performance liquid chromatography fingerprinting and mathematical processing[J]. Food Research International, 2019, 122(8): 303-317.
[10]XIE Y Y, XIAO X, LUO J M, et al. Integrating qualitative and quantitative characterization of traditional Chinese medicine injection by high-performance liquid chromatography with diode array detection and tandem mass spectrometry[J]. Journal of Separation Science, 2014, 37(12): 1438-1447.
[11]聂燕, 汪滢, 赵璐, 等. 中药及其复方指纹图谱的研究新进展[J]. 时珍国医国药, 2012, 23(12): 3110-3112.
NIE Yan, WANG Ying, ZHAO Lu, et al. Novel advanced research on fingerprints of traditional Chinese medicine and formulas[J]. Lishizhen Medicine and Materia Medica Research, 2012, 23(12): 3110-3112.
Study on the construction of HPLC fingerprint of fresh/dried cocoon raw silk
ZHANG Chi, WANG Xiangrong
XU Hang1, MA Mingbo1, YE Fei2, YANG Yajuan2, ZHOU Wenlong1,3
(1.College of Textile Science and Engineering (International Institute of Silk), Zhejiang Sci-Tech University, Hangzhou 310018, China;2.Huzhou Institute of Quality and Technical Supervision and Inspection (Huzhou Fiber Quality Monitoring Center),Huzhou 313099, China; 3.Wenzhou University of Technology, Wenzhou 325035, China)
Abstract: Silk has a long history as a textile raw material in China. People usually divide silk into two categories according to the different ways of reeling. The raw silk prepared by cocoon drying and cocoon cooking is called dry cocoon raw silk, and the raw silk obtained by direct reeling only through infiltration is called fresh cocoon raw silk. Due to the different reeling processes, the components of the two kinds of raw silk are different, which makes the cohesion and tensile properties of raw silk different. These differences in the performance of raw silk affect the quality of the final woven silk fabric, so it is necessary to distinguish the two kinds of raw silk. However, since the components of fresh cocoon/dry cocoon raw silk are easily affected by factors such as origin and silkworm eggs, it is difficult to ensure the accuracy of identification. Therefore, in this paper, the HPLC fingerprint of fresh cocoon and dry cocoon raw silk was constructed to realize the accurate distinction between the two kinds of raw silk.
In this study, representative raw silk samples from different sources on the market were selected to prepare raw silk extract and perform HPLC detection. The obtained spectrum was imported into the similarity evaluation system for spectrum correction and automatic matching, and the retention time and peak area values of each chromatographic peak were obtained. The average retention time and relative peak area were calculated to complete the calibration of the characteristic peaks. The common pattern fingerprints of the two types of cocoon filaments were determined by the average method, and the similarity value of each raw silk sample was calculated by the cosine value of the angle. By counting the similarity values of similar cocoon filaments, the similarity threshold of similar cocoon filaments is set as the basis for preliminary determination. After that, the fresh cocoon/dry cocoon raw silk samples were subjected to cluster analysis. The inter-group association method was used as the cluster analysis method. The average Euclidean distance was selected as the measurement standard, and the two types of raw silk were distinguished by cluster analysis.
According to the experimental results, the RSD of retention time of fresh cocoon raw silk samples is less than 1.17%, and the RSD of relative peak area is in the 20.42%-107.27% range. The RSD of retention time of dried cocoon raw silk is less than 1.36%, and the RSD of relative peak area is in the 4.72%-88.15% range. The components of each raw silk sample are similar, but the content of each component is quite different. The common fingerprint of fresh cocoon and dry cocoon raw silk shows that the fresh cocoon raw silk has a strong peak at the retention time of 1.71 min, a moderate peak at the retention time of 2.02 min, 5.87 min, 8.69 min and 10.34 min, and there are some weak peaks between the retention time of 14.50 min and 16.50 min. The dry cocoon raw silk shows a strong peak at the retention time of 1.70 min, and there are only two moderate peaks at the retention time of 2.02 min and 5.64 min. The common fingerprints of fresh and dry cocoons are significantly different. The similarity evaluation results show that the similarity threshold of fresh cocoon raw silk is 0.919, and the similarity threshold of dried cocoon raw silk is 0.945. The similarity between the same kind of raw silk is good, and the similarity between dry cocoon raw silk is better than that of fresh cocoon raw silk, which is consistent with the RSD results of relative peak area. The results of cluster analysis show that the two types of raw silk samples could be accurately distinguished when the clustering rescaling distance is 3. The results show that the HPLC fingerprint can show the component information of raw silk more comprehensively and meet the identification requirements of fresh/dry cocoon raw silk. The fresh/dried cocoon raw silk can be identified by HPLC fingerprint.
Key words: fresh cocoon raw silk; dried cocoon raw silk; high performance liquid chromatography; fingerprint; similarity evaluation method; cluster analysis
收稿日期: 20230222;
修回日期: 20230619
基金項目: 湖州市科技计划项目(2022GZ11)
作者简介: 徐航(1997),男,硕士研究生,研究方向为绿色天然纺织材料。通信作者:周文龙,教授,wzhou@zstu.edu.cn。
