基于蛋白质组学的蚕丝蛋白质组分分析
2023-08-30周杰周雄胡铭周刘剑王秉
周杰 周雄 胡铭周 刘剑 王秉


摘 要: 丝绸是古代中国的伟大发明,中华民族的先辈们通过养蚕、缫丝、纺纱、织造等工艺制造出精美的丝织物,但在长期的埋藏过程中极易发生老化降解。丝绸文物在长期埋藏的过程中极易发生老化降解。为了研究文物丝绸丝绸文物在全生命周期中发生的蛋白组分变化,利用高通量蛋白质组学方法对蚕茧、现代丝绸制品和文物丝绸样品中的蛋白质和特异多肽种类进行检测。结果显示:蚕茧脱胶过程中,3种丝胶蛋白仅一种有残留,多种功能蛋白被除去;在长时间的劣化过程中,绝大部分的蛋白质完全降解,丝素蛋白重链、轻链和糖蛋白链部分降解,其中轻链降解速率最慢;在蚕茧、现代丝绸和丝绸文物中发现15种共有多肽,其中丰度最高的两条多肽序列有望成丝绸检测的分子标志物。该研究可为古代丝绸劣化过程分析提供一种新策略,为微量检测提供理论指导。
关键词:蛋白质组学;丝绸文物;蛋白质组分;分子标志物;高通量检测
中图分类号:TS141
文献标志码:A
文章编号:1673-3851 (2023) 05-0359-06
引文格式:周杰,周雄,胡铭周,等. 基于蛋白质组学的蚕丝蛋白质组分分析[J]. 浙江理工大学学报(自然科学),2023,49(3):359-364.
Reference Format: ZHOU Jie,ZHOU Xiong, HU Mingzhou, et al. Analysis of protein components in silk based on proteomics[J]. Journal of Zhejiang Sci-Tech University,2023,49(3):359-364.
Analysis of protein components in silk based on proteomics
ZHOU Jie1, ZHOU Xiong1, HU Mingzhou1, LIU Jian2, WANG Bing1
(1.School of Materials Science & Engineering, Zhejiang Sci-Tech University, Hangzhou 310018, China; 2.China National Silk Museum, Hangzhou 310002, China)
Abstract: Silk is a great invention of ancient China. Chinese ancestors produced exquisite silk by sericulture, reeling, spinning and weaving. But silk fabrics are highly susceptible to aging and degradation during the long-term burial processAncient silk are prone to aging and degradation during long-term burial. In order to study the structural changes of proteins occurred in ancient silk throughout its life cycle, high-throughput proteomics was used to identify the species and abundance of proteins in silk cocoons, modern silk and silk relics. The results showed that only one of the three kinds of sericin remained during cocoon degumming and a variety of functional proteins were also removed. Vast majority of the proteins were completely degraded during the long degradation process, while the heavy, light and glycoprotein chains of silk protein were partially degraded, and the light chain degradation rate was the slowest. Fifteen shared polypeptides were identified in cocoons, modern silk and silk relics, and two peptides with the most abundance were expected to become biomarkers for silk detection. This study provides a new strategy to explore the ancient silk production and deterioration process.
Key words:proteomics; silk relic; protein components; biomarkers; high-throughput detection
0 引 言
中國是世界上最早从事养蚕缫丝的国家,曾被誉为“丝国”。中华民族的先辈通过成功驯养家蚕,开发出一套先进的丝绸生产技术体系,通过丝绸之路传播到世界各地,对世界产生了深远影响[1-3]。丝织品作为一种天然高分子蛋白,在经历缫丝、脱胶、纺纱和织造后,又受到光照、温度、水分和微生物等因素的影响[4-6],极易发生劣化降解,甚至泥化而失去实体形貌[7]。因此,亟须了解丝绸文物形态变化背后的蛋白质组分变化机理。
当前,国内外学者多采用扫描电子显微镜(SEM)、傅里叶红外光谱(FTIR)和拉曼光谱等手段分析研究了丝绸文物的劣化程度和老化机理[8-11]。Koperska等[11]用FTIR研究了蚕丝样品在150 ℃、不同空气条件老化后丝素的降解情况;王永礼等[12]模拟了不同波段可见光老化实验,通过色差和SEM分析了各样品劣化程度;龚德才等[13]利用偏振红外光谱和全反射红外光谱,通过对碱性水解丝绸和古代丝织品的取向度和结晶度分析,获得纤维聚集态变化规律,从而评价丝绸的老化程度。但以上方法都是从丝绸表面形貌和化学结构等方面着手,缺乏从分子水平上研究蛋白质组分变化的方法。近年来,随着质谱技术的发展,蛋白质组学作为一种新兴的技术手段进入人们的视野。
蛋白质组学技术是一种高通量的蛋白质检测技术,可以精确识别样品中的蛋白质与多肽序列[14-15]。典型的蛋白質组学检测过程主要包括3部分:蛋白质组的提取和酶解、质谱检测和蛋白数据库对比与分析。蛋白鉴定方法目前也被引入考古和文物保护领域[16-18]。Tokarski等[19]用蛋白质组学鉴定出文艺复兴时期的绘画中含有卵黄和卵清蛋白;Guo等[20]采用蛋白质组学对桑蚕丝的成分进行分析,发现蚕茧中含有大量蛋白酶抑制剂,从而解释了桑蚕茧具有抗菌性的原因;Lee等[21]开发了一种基于质谱的蛋白质组学方法,成功将家蚕、柞蚕和萨米亚产的蚕茧区分到物种水平;本文课题组曾利用蛋白质组学研究了家蚕和柞蚕的蛋白质差异,找到了区别家蚕与柞蚕的标志蛋白,可用于区分出土文物的种属[22]。
本文采用蛋白质组学技术,对蚕茧、现代丝绸和文物丝绸中的蛋白质组分进行分析,通过研究3种样品中蛋白质与特异多肽的异同,从蛋白组分和一级结构水平评估丝绸老化程度,以期了解古代丝绸全生命周期中蛋白质组分变化过程,从而为丝绸文物的抢救和微量检测提供理论指导。
1 实验部分
1.1 实验材料和仪器设备
实验样品:文物丝绸(新疆三道海子出土,汉晋时期)由中国丝绸博物馆提供;蚕茧和现代丝绸制品(春桑蚕,杭州,2021年)购自杭州富丝工贸有限公司。
实验材料:无水乙醇购自杭州高晶精细化工有限公司;氯化钙(CaCl2)、碳酸氢铵(NH4HCO3)、十二烷基硫酸钠(SDS)、二硫苏糖醇(DTT)、吲哚乙酸(IAA)、甲酸(FA)、三羟甲基氨基甲烷盐酸盐(Tris-HCl)、测序级胰蛋白酶(trypsin)和乙腈(ACN)均购自美国赛默飞公司。
实验仪器:FA2104型电子天平(上海舜宇恒平科学仪器有限公司)、DF-101S型集热式恒温加热磁力搅拌器(杭州仪器制造有限公司)、FD-IA-50型真空冷冻干燥机(北京博医康实验仪器有限公司)、TF-86-30LA型超低温冰箱(上海拓纷机械设备有限公司)、JSM 5610LV型扫描电子显微镜(德国卡尔蔡司)、Waters AccQ·Tag型超高效液相色谱仪(美国沃特世)、Easy nLC 1200色谱系统和Q-Exactive HF-X型质谱仪(美国赛默飞)。
1.2 实验方法
1.2.1 丝蛋白提取
分别称取4 mg蚕茧、现代丝绸制品和文物丝绸置于200 μL 8.7 mol/L CaCl2和17.4 mol/L C2H5OH混合水溶液中,在98 ℃加热溶解30 min;待蚕丝蛋白溶液冷却至室温后,装入截留相对分子质量为1000 kDa的透析袋中,每6 h换一次水,透析3 d,去除无机盐。将透析后的丝蛋白溶液冷冻干燥处理得到丝蛋白粉末。
1.2.2 丝蛋白酶解
在100 μg的3种丝蛋白粉末中分别加入100 μL SDT裂解液(4% SDS,100 mmol/L DTT,100 mmol/L Tris-HCl),96 ℃水浴5 min,冷却至室温。采用BCA试剂盒测定蛋白含量后,加入10 μL IAA,600 r/min振荡1 min,避光室温孵化30 min。加入1 mL的预冷丙酮,置于-20 ℃静置2 h,沉淀蛋白。16000 g离心10 min,去除上清液,加丙酮清洗蛋白沉淀,重复3次;加入100 μL 酶解液(2 μg胰蛋白酶溶于100 μL NH4HCO3溶液中),600 r/min振荡 1 min,置于37 ℃孵化16 h。12000 g离心10 min,收集滤液;酶解后的肽段使用脱盐柱脱盐,真空干燥。
1.3 测试与表征
1.3.1 形貌表征
蚕茧、现代丝绸和文物丝绸3种原始样品用1 mol/L的乙醇水溶液洗涤、真空干燥,表面镀金后,采用SEM观测表观形貌。将蚕茧、现代丝绸和文物丝绸在1 mol/L的乙醇溶液种洗涤,真空干燥后表面镀金,采用SEM观测3种样品的表面形貌。
1.3.2 液相色谱质谱联用蛋白鉴定
丝蛋白粉末样品使用纳升流速色谱系统进行色谱分离,肽段分离后用质谱仪进行数据依赖采集质谱分析。分析时长为60 min,检测模式:正离子、母离子扫描范围:300~1800 m/z,一级质谱分辨率:60000,AGC target:3×106,一级最大IT:50 ms;肽段二级质谱分析按照下列方法采集:每次全扫描后触发采集 20个最高强度母离子的二级质谱图谱,二级质谱分辨率:15000,AGC target:3×106,二级最大IT:25 ms,MS2激活类型:HCD,隔离窗口:1.3 m/z,归一化碰撞能量:28。采用纳升流速色谱系统对丝蛋白粉末样品进行色谱分离。随后,通过数据依赖采集质谱分析肽段。分析时长为60 min,检测模式为正离子、母离子,扫描范围为300~1800 m/z,一级质谱分辨率为60000,AGC目标为3×106,一级最大IT为50 ms;肽段的二级质谱分析按照下列方法采集:在每次全扫描后触发采集 20个最高强度母离子的二级质谱图谱,二级质谱分辨率为15000,AGC目标为3×106,二级最大IT为 25 ms,MS2激活类型为HCD,隔离窗口为1.3 m/z,归一化碰撞能量为28。
1.3.3 蛋白数据库检索
选取Uniprot蛋白数据库中的所有18488条桑蚕(Bombyx mori)蛋白建立对比蛋白质数据库,用于比对筛选出样品中的蛋白质组分。采用质谱检索软件MaxQuant对液相色谱质谱联用采集得到的质谱图与建立的对比蛋白质数据库比对验证,MaxQuant搜库软件分析参数设置如下:搜库方式设为单独搜库,母离子质量偏移小于20.00×10-6Da,子离子质量偏差小于0.01 Da ,半胱氨酸的氨基甲酰甲基化设置为固定修饰,甲硫氨酸的氧化为动态修饰;每个鉴别的蛋白质至少有1个特异肽段;质谱数据检索结果分别采用多肽假阳性概率(PSM FDR≤0.01)和蛋白假阳性概率(Protein FDR≤0.01)作为肽段与蛋白鉴定的筛选标准。
2 结果与讨论
2.1 样品形貌分析
图1为蚕茧、现代丝绸制品和文物丝绸的SEM图。从图1可以看出:在蠶茧样品缺陷处可以看出蚕茧样品缺陷处的蚕丝分为两层;现代丝绸整根丝纤维表面光滑,且有竖纹,在表面有微量异物,可能为丝胶残留表面的微量异物可能为丝胶残留;文物丝绸由于环境复杂,表面黏着大量杂质,在乙醇溶液洗涤过后依旧附着在丝绸表面,丝绸裸露部分粗糙度增加,但几乎没有表面缺陷,整体外观保持完整,可能是干燥的墓葬环境保证了纤维的完整性。
2.2 总蛋白质鉴定
为分析微观层面蛋白质组的变化,使用蛋白质组学技术鉴定出3种样品的蛋白质组分。为了排除干扰蛋白和误检蛋白,剔除假阳性多肽和常见蛋白污染源,筛选出所有得分大于0的检出蛋白质,获得总蛋白质鉴定结果。在蚕茧样品中总共检测出406种多肽和75种蛋白,现代丝绸中鉴定出有98种多肽和59种蛋白,而文物丝绸中只有30种多肽和18种蛋白。蚕茧中的蛋白种类远大于现代丝绸,表明多种蛋白质在缫丝、脱胶、纺纱和织造过程中被除去。文物丝绸中蛋白的种类远低于现代丝绸,检出多肽也仅有现代丝绸的30%,扫描结果中蚕丝表观形貌虽没有大的缺陷,但蛋白质组学结果表明劣化作用使得文物丝绸中蛋白质大量降解。
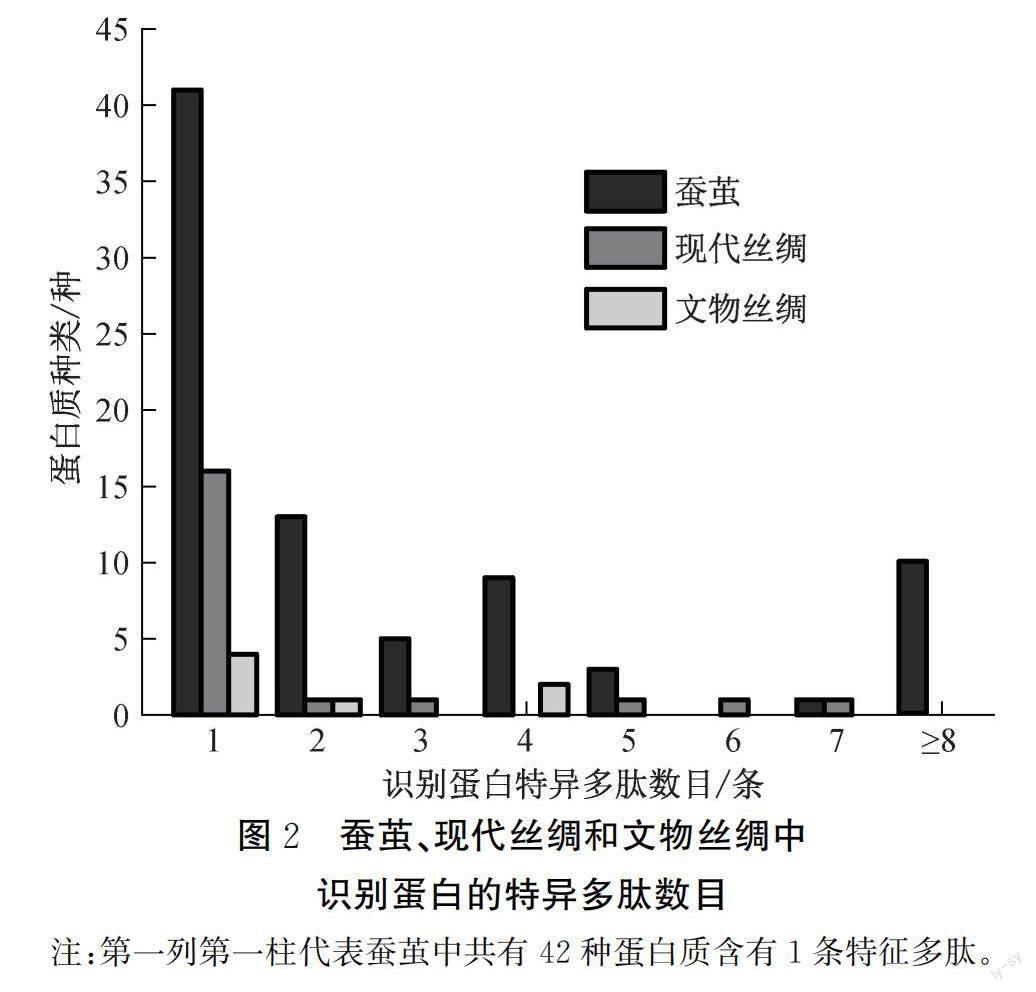
2.3 3种样品中特异多肽的鉴定
图2是蚕茧、现代丝绸和文物丝绸中识别蛋白的特异多肽数量图。在桑蚕蛋白数据库的18488种蛋白质中,每一种蛋白质都有至少一段多肽序列是完全区别于其他序列(部分蛋白过于相似无法区分,但功能上也完全一致,故合并处理),该肽段被称为特异多肽。检测出的每一蛋白中自然包含着属于它们的特征多肽。图2表明,从蚕茧到文物丝绸,蛋白种类和蛋白对应特异多肽数量大大减少,含有7条特异多肽的蛋白只在蚕茧中出现,而文物丝绸中的蛋白质最高只含有4条特异多肽。只有当某一段多肽含量极低时才无法被检测,而同一蛋白质中特异蛋白的减少只能归因为破坏降解。特异多肽的减少说明了蚕茧到丝绸文物丝绸的过程会损伤蛋白质,而劣化过程会更进一步破坏蛋白质链。
2.4 3种样品的差异蛋白分析
根据蛋白质的功能,可以将样品中的蛋白分成六大类,分别是丝胶蛋白、丝素蛋白、酶、蛋白酶抑制剂、结构域蛋白和其他蛋白;其中丝素蛋白和丝胶蛋白是蚕茧最主要的组要成分,而蛋白酶抑制剂被认为是天然蚕茧抗菌性的主要来源[20]。表1为蚕茧、现代丝绸和文物丝绸3种样品的蛋白组分。由表1可知:对比蚕 茧和现代丝绸样品可以看出,两者差异最大为丝胶蛋白,在蚕茧中存在3种丝胶蛋白Sericin 1(A8CEQ1)、Sericin 1B(P07856)、Sericin 3(Q17240),在现代丝绸中仅发现1种Sericin 1,且含量极低,说明在丝绸的生产过程中,脱胶工艺是导致蚕丝蛋白变化最大的因素。酶、蛋白酶抑制剂和其他蛋白种类减少也说明部分功能性蛋白存在丝胶表层,随着丝胶的除去而被带走,与Silva等[23]提到的丝胶具有抗菌性相互印证。对比现代丝绸与文物丝绸可以发现,文物丝绸中丝胶蛋白和蛋白酶抑制剂已完全降解,结构域蛋白、酶和其他蛋白的种类都大幅度减少,大量蛋白质完全降解。蛋白酶抑制剂的消失也表明了丝绸的抗菌能力也会随着功能蛋白的降解而消失。不同于SEM中展现出的表观形貌没有大的缺陷,丝绸文物在蛋白质组分层面降解严重。
2.5 3种样品中的共有蛋白和多肽
在鉴定出的所有蛋白中,有5种蛋白质在3个样品中都被检测到,分别为丝素蛋白重链(P05790)、丝素蛋白轻链(Q7JYG3)、糖蛋白链(P04148)和两个无特征蛋白(H9IZK4、H9IVS7)。其中丝素蛋白重链、轻链和P25链是桑蚕茧中的标志蛋白,仅存在桑蚕茧中,这也说明了文物丝绸为桑蚕茧织造而成。3种蛋白在蚕茧中以6∶6∶1的物质的量比存在[22],为丝绸的主要蛋白质,占丝绸蛋白的70%以上。表2为上述5种蛋白的详细信息。由表2可以看出,5种蛋白的特异多肽数量和蛋白相对强度都在下降,说明均发生了不同程度地降解,部分区域已经完全消失。以上结果进一步说明加工工艺不是无损的,文物丝绸降解比表观形貌表现出的要更为严重。
为了进一步分析这5种共有蛋白的相对降解速率,本文对P05790、Q7JYG3、P04148、H9IZK4和H9IVS7蛋白进行了相对丰度变化分析。当一种蛋白的降解速率快于其他蛋白,它的相对丰度占比将会升高[24]。从图3的5种蛋白相对丰度图中可以看到,两个无特征蛋白含量极低;对于剩下的3种蛋白,蚕茧和现代丝绸中其相对丰度基本保持一致,表明脱胶过程对这3种蛋白的影响近乎同步;而对比文物丝绸和现代丝绸可以发现,文物丝绸中丝素蛋白轻链相对丰度相较于轻链和P25链显著上升,这说明轻链降解速率最慢,其很有可能存在丝绸文物的全生命周期中,故有望成为判断文物丝绸降解程度的关键蛋白。
重复特异多肽韦恩图可以分析3种样品的共有特异多肽,找到文物丝绸全生命周期最有可能遗留下来的多肽。结果如图4所示。从图4中3个样品的韦恩图可以看出:3个样品的共同检出多肽有15条,其中5条归属于丝素蛋白重链,7条归属于丝素蛋白轻链,剩下3条分别归属于其他3个共有蛋白;15条多肽中存在两条值得关注的序列,在任一样品中丰度排名前三,分别是属于重链的多肽链DASGAVIEEQITTK和属于轻链的多肽链ASSVISR,由此推断,这2条多肽最有可能在复杂的墓葬环境中保存下来。同时这两条多肽归属于丝素蛋白且是重链和轻链的特异多肽,在墓葬环境中发现这两条多肽将可以直接推断出重链和轻链的存在,继而判断出该墓葬中曾埋藏过丝绸。故重链的多肽链DASGAVIEEQITTK和轻链的多肽链ASSVISR有望作为检测丝绸存在痕迹的分子标志物。
3 结 论
本文采用高通量蛋白质组学蛋白检测方法,对文物丝绸全生命周期过程中蛋白质组分变化情况进行分析,得到以下结论:
a)加工过程中对丝绸影响最大的因素为脱胶工艺;碱性脱胶作用可以去除绝大部分丝胶,但同时丝胶表层的大量功能蛋白质也被除去,各种蛋白质都受到一定损伤。
b)丝绸在埋藏过程受到各种外在环境因素影响,文物丝绸相比于现代丝绸,蛋白种类已经显著减少;大量酶蛋白和蛋白酶抑制剂完全降解,丝素蛋白重链、轻链、P25链3种主要蛋白也部分降解,其中轻链降解速度最慢。
c)3个样品中共找到15种共有多肽,其中保存最好的两条特异多肽有望成为丝绸微量检测中的分子标志物。
参考文献:
[1]董波. 现代文明背景下的一部远古史诗: 评沈爱凤的《从青金石之路到丝绸之路--西亚、中亚与亚欧草原古代艺术溯源》[J]. 艺苑, 2011 (6): 60-65.
[2]周伟. 衣冠上国今犹在礼仪之邦乘归梦: 华夏衣冠设计初探[J]. 四川戏剧, 2016 (1): 115-117.
[3]Glausiusz J. The Internet of the ancient world[J]. Nature, 2009, 462(7273): 574.
[4]Ming J F, Fan Z H, Xie Z G, et al. A modified grey verhulst model method to predict ultraviolet protection performance of aging B.mori silk fabric[J]. Fibers and Polymers, 2013, 14(7): 1179-1183.
[5]Gu J C, Li Q Q, Chen B Y, et al. Species identification of Bombyx mori and Antheraea pernyi silk via immunology and proteomics[J]. Scientific Reports, 2019, 9: 9381.
[6]楊海亮, 汪自强, 王淑娟. 丝织品文物健康评测与跟踪的实践研究[J]. 丝绸, 2015, 52(8): 7-11.
[7]李津. 基于电化学免疫技术的丝绸文物分析鉴定研究[D]. 杭州:浙江理工大学, 2020:24-63.
[8]Liu J, Guo D H, Zhou Y, et al. Identification of ancient textiles from Yingpan, Xinjiang, by multiple analytical techniques[J]. Journal of Archaeological Science, 2011, 38(7): 1763-1770.
[9]He Z P, Zhao T T, Zhou X F, et al. Sequential order of the secondary structure transitions of proteins under external perturbations: Regenerated silk fibroin under thermal treatment[J]. Analytical Chemistry, 2017, 89(10): 5534-5541.
[10]刘秋香, 吴顺清, 赵宇, 等. 古代(战国)丝织品的降解特征初探[J]. 文物保护与考古科学, 2008, 20(3): 1-5.
[11]Koperska M A, Pawcenis D, Bagniuk J, et al. Degradation markers of fibroin in silk through infrared spectroscopy[J]. Polymer Degradation and Stability, 2014, 105: 185-196.
[12]王永礼, 赵丰, 屠恒贤. 丝绸表面光老化实验研究[J]. 文物保护与考古科学, 2006, 18(1): 9-16.
[13]龚德才, 刘柳, 朱展云. 红外光谱在古代丝织品的纤维聚集态结构表征中的应用研究[J]. 蚕业科学, 2015, 41(4): 694-700.
[14]Gillet L C, Leitner A, Aebersold R. Mass spectrometry applied to bottom-up proteomics: Entering the high-throughput era for hypothesis testing[J]. Annual Review of Analytical Chemistry, 2016, 9(1): 449-472.
[15]Li X, Tan Y, Lai H, et al. All-Inorganic CsPbBr3perovskite solar cells with 10.45% efficiency by evaporation-assisted deposition and setting intermediate energy levels[J]. ACS Applied Materials & Interfaces, 2019, 11(33): 29746-29752.
[16]Courouble V V, Dey S K, Yadav R, et al. Revealing the structural plasticity of SARS-CoV-2 nsp7 and nsp8 using structural proteomics[J]. Journal of the American Society for Mass Spectrometry, 2021, 32(7): 1618-1630.
[17]Moore R A, Faris R, Priola S A. Proteomics applications in prion biology and structure[J]. Expert Review of Proteomics, 2015, 12(2): 171-184.
[18]Li L, Zhu L, Xie Y T. Proteomics analysis of the soil textile imprints from tomb M6043 of the Dahekou Cemetery site in Yicheng County, Shanxi Province, China[J]. Archaeological and Anthropological Sciences, 2021, 13(1): 7.
[19]Tokarski C, Martin E, Rolando C, et al. Identification of proteins in renaissance paintings by proteomics[J]. Analytical Chemistry, 2006, 78(5): 1494-1502.
[20]Guo X M, Dong Z M, Zhang Y, et al. Proteins in the cocoon of silkworm inhibit the growth of Beauveria bassiana[J]. PLoS One, 2016, 11(3): e0151764.
[21]Lee B, Pires E, Pollard A M, et al. Species identification of silks by protein mass spectrometry reveals evidence of wild silk use in antiquity[J]. Scientific Reports, 2022, 12: 4579.
[22]Chen R R, Zhu C, Hu M Z, et al. Comparative analysis of proteins from Bombyx mori and Antheraea pernyi cocoons for the purpose of silk identification[J]. Journal of Proteomics, 2019, 209: 103510.
[23]Silva A S, Costa E C, Reis S, et al. Silk sericin: A promising sustainable biomaterial for biomedical and pharmaceutical applications[J]. Polymers, 2022, 14(22): 4931.
[24]Chen R R, Hu M Z, Zheng H L, et al. Proteomics and immunology provide insight into the degradation mechanism of historic and artificially aged silk[J]. Analytical Chemistry, 2020, 92 (3): 2435-2442.
(責任编辑:廖乾生)
