基于温敏型材料的固定化酶的制备及其在蛋白质组快速分析中的应用
2017-04-25张倩郑斐秦伟捷钱小红
张倩+郑斐+秦伟捷 钱小红

摘要 蛋白质组学通过规模化鉴定、分析从细胞、组织或有机体中提取的蛋白质,从而获得蛋白表达、修饰、组成和定量的变化信息。在目前最为有效的“鸟枪法”蛋白质组学策略中,固定化酶试剂基质常用固相载体材料,该固定化酶试剂在酶解蛋白质时为异相体系,存在固液界面传质阻力和空间位阻,限制了酶解效率和样品处理通量。针对这一技术瓶颈,本研究利用温敏聚合物对外界温度变化的响应能力,制备了一种新型的基于可溶性温敏聚合物的固定化胰蛋白酶试剂。该固定化酶特有的温度敏感特性,使其具有“高温均相酶解,低温异相分离”的特色,且兼具酶切时间显著缩短、酶可重复利用的优势。BSA1min固定化酶解产物肽段的氨基酸序列覆盖率可达94%,高于传统溶液酶解12h所得覆盖率为(74%)。进一步将该固定化酶试剂应用于HeLa细胞全蛋白质组的酶解,其酶解效果与相同条件下溶液酶解12h相当。该固定化酶试剂对复杂蛋白质的快速、高效酶解充分证明其在蛋白质组学研究中的应用潜力。
关键词固定化酶;温度敏感型聚合物;质谱鉴定;蛋白质组学;快速酶解
1引言
蛋白质组学通过对从细胞、组织或有机体中提取的蛋白质进行规模化分析鉴定,系统性的获得蛋白表达、修饰、组成和定量的变化信息[1,2\],已成为生物学和医学研究中的热点领域。目前,蛋白质组学中应用最为广泛的研究策略是基于质谱的“鸟枪法”策略,该策略利用蛋白酶将蛋白样品酶解为肽段混合物,然后通过液相色谱质谱联用(LCMS)分析鉴定肽段样品,最后将所得质谱数据在数据库中搜库检索,从而获得相应蛋白质的详细信息[3,4\]。在这一策略中,蛋白质的定性、定量信息都是通过对其酶解肽段产物进行分析鉴定得到的,因此,蛋白质的酶解成为该研究策略中至关重要的一步。在“鸟枪法”策略中,目前广泛使用的溶液酶解方法所需时间过长(12~24h),严重限制了样品的处理速度和通量。而且溶液酶解中的蛋白酶只能单次使用,无法回收,导致使用成本较高。固定化蛋白酶试剂可避免蛋白酶自身酶解效应,并且显著提高了酶与底物的投料比,缩短了反应时间,提高了酶解效率;另外,固定化蛋白酶可回收重复使用,大大降低了蛋白酶的使用成本[5~7\]。目前已报道了多种不同的蛋白酶固定化方法及固定化载体材料,如介孔材料[8,9\]、毛细管石英柱[10,11\]、芯片材料[12,13\]、二氧化硅材料[14,15\]或磁性纳米颗粒[16,17\]。但是,目前所使用的固定化载体多为固相材料,固定化蛋白酶与溶液中的蛋白质底物在异相体系中进行酶解反应,固液界面的传质阻力和固相材料的空间位阻限制了固定化酶与底物的碰撞和酶解效率的进一步提高。
针对上述技术瓶颈,本研究提出并发展了基于温敏聚合物载体的固定化蛋白酶,利用温敏聚合物的温度敏感特性,通过控制温敏聚合物固定化蛋白酶所处环境温度使其在溶解和不溶解间相互转换,从而在溶液中呈现不同状态,以达到“均相酶解,异相分离”的目的。温度敏感型聚合物水溶液通常具有相转变温度,其中一类为最高临界溶解温度(UCST)型,当环境温度高于其相转变温度时,聚合物在水溶液中呈完全溶解状态;当环境温度达到或低于该聚合物的相转变温度时,聚合物开始聚集,析出沉淀[18,19\]。本研究以N丙烯酰甘氨酰胺(NAGA)为温度响应基团,合成了具有UCST温度响应能力的N丙烯酰甘氨酰胺共聚十一烯醛(poly(NAGAcoUnAl))温敏聚合物,将该温敏聚合物作为载体材料,制备得到新型可溶性温敏固定化胰蛋白酶。通过控制反应体系温度使固定化酶对蛋白质样本实现了“高温均相酶解,低温异相分离”,消除了固定化蛋白酶酶解时的固液界面传质阻力和空间位阻,大大缩短了酶解时间,提高了酶解效率。常用的固定化酶方法大多用固相载体制备,酶解均在异相体系反应;相较于此,本研究制备的固定化酶试剂,在37℃超声溶解,与蛋白进行均相反应,置于冰水浴中,固定化酶试剂团聚沉淀,与酶解肽段分离,达到异相分离,酶解效率提高,酶解效果比固相载体高。此固定化蛋白酶试剂在标准蛋白和复杂样本中均取得良好效果,证明其在蛋白质组学研究中的应用潜力。
2实验部分
2.1仪器与试剂
基质辅助激光解析飞行时间质谱(NewultrafleXtremeMALDITOF/TOFMS),EQUINOX55型傅里叶红外光谱仪(FTIR)均购自德国Bruker公司;四极杆静电场轨道阱组合高分辨串联质谱仪(QExactivePlusOrbitrapMS),液相色谱(EasynLC1000),均购自美国ThermoFisherScientific公司。
牛血清白蛋白(BSA,98%)、胰蛋白酶(90%)、甘氨酰胺鹽酸盐(98%)、丙烯酰氯(98%)、10十一烯醛(UnAl,95%)、氰基硼氢化钠(99%)、偶氮二异丁腈(AIBN,99%),均购自美国SigmaAldrich公司;实验用水为MilliQ去离子水。
2.2实验方法
2.2.1N丙烯酰甘氨酰胺(NAGA)的合成温敏单体NAGA的具体步骤参考文献\[18\]。
2.2.2UCST温敏型共聚物poly(NAGAcoUnAl)的合成
控制合成共聚物的单体的起始摩尔比为NAGAKG-3∶KG-5UnAl=4KG-3∶KG-51,利用自由基聚合反应,合成UCST温敏型共聚物poly(NAGAcoUnAl)。步骤同文献\[18\]。
2.2.3胰蛋白酶在poly(NAGAcoUnAl)上的固定将10mgpoly(NAGAcoUnAl)共聚物溶解于500μL磷酸盐缓冲液(PBS,pH7.4)中,再依次加入4mg胰蛋白酶与5mg氰基硼氢化钠,将混合体系在24℃下振荡反应3h。将体系置于冰水浴中静置2min,待体系出现明显浑浊后,在4℃以10000r/min离心10min,收集上清液,将不溶物溶解于1mL50mmol/LNH4HCO3溶液中,再次置于冰水浴中降温并高速离心进行分离,此过程重复3次,以洗去未固定的胰蛋白酶,得最终产物poly(NAGAcoUnAl)trypsin固定化酶。收集清洗过程中所有上清液,用于测定载体材料对胰蛋白酶的固载量。
2.2.4Poly(NAGAcoUnAl)trypsin固定化酶酶解标准蛋白将40μg牛血清白蛋白(BSA)溶解于50mmol/LNH4HCO3溶液中至1μg/μL,加入二硫苏糖醇(DTT)至终浓度为10mmol/L,95℃下加热10min,待冷却后加入碘乙酰胺(IAA)至终浓度为50mmol/L,暗处放置1h。
将变性后的BSA溶液加入到poly(NAGAcoUnAl)trypsin中充分混合,置于37℃水浴中超声酶解1min。然后迅速将混合物置于冰水浴中静置2min后,在4℃以10000r/min离心10min,收集上清液,不溶物再用50μL水清洗,将上清液与第一次的溶液混合,脱盐后用于质谱鉴定。不溶物用50mmol/LNH4HCO3溶液反复清洗后,于4℃保存。
2.2.5对标准蛋白BSA酶解产物和人宫颈癌细胞(HeLa)全蛋白的酶解的质谱鉴定使用MALDITOF/TOFMS对BSA酶解产物进行鉴定,并使用Moscot在线搜库对所得数据进行肽指纹谱图分析。
对HeLa细胞全蛋白的固定化酶解操作与上述对BSA的步骤相同。所得酶解产物使用LCQExactivePlusMS鉴定后由软件ProteinDiscoverer1.3搜库分析。
3结果与讨论
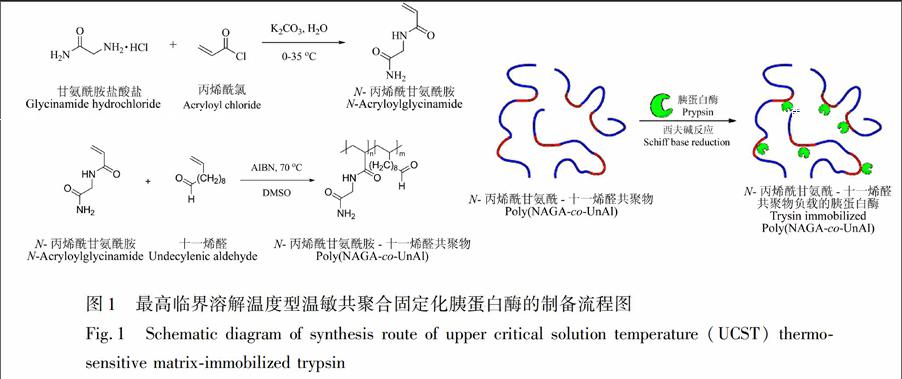
本研究中的温敏聚合物poly(NAGAcoUnAl)是通过N丙烯酰甘氨酰胺和十一烯醛的自由基聚合反应得到的。其中,N丙烯酰甘氨酰胺提供具有温度敏感特性的官能团,十一烯醛提供醛基官能团,通过醛基与胰蛋白酶N端或氨基酸侧链的氨基反应将胰蛋白酶固定到温敏聚合物上。UCST温敏共聚物固定化胰蛋白酶的制备流程如图1所示。
本研究制备的UCST温敏聚合物固定化胰蛋白酶对蛋白质的酶解过程如图2所示。利用此温敏聚合物的温度响应特性,即在体系温度高于UCST时处于溶解状态,其与蛋白质样本形成均相体系,消除了固液界面的传质阻力,并降低了空间位阻,有效提高了固定化酶的酶解效率;在体系温度低于其UCST时,团聚析出形成沉淀,便于与酶解产物的有效分离和酶的简便回收,从而实现了“高温均相酶解低温异相分离”的固定化酶解新策略。
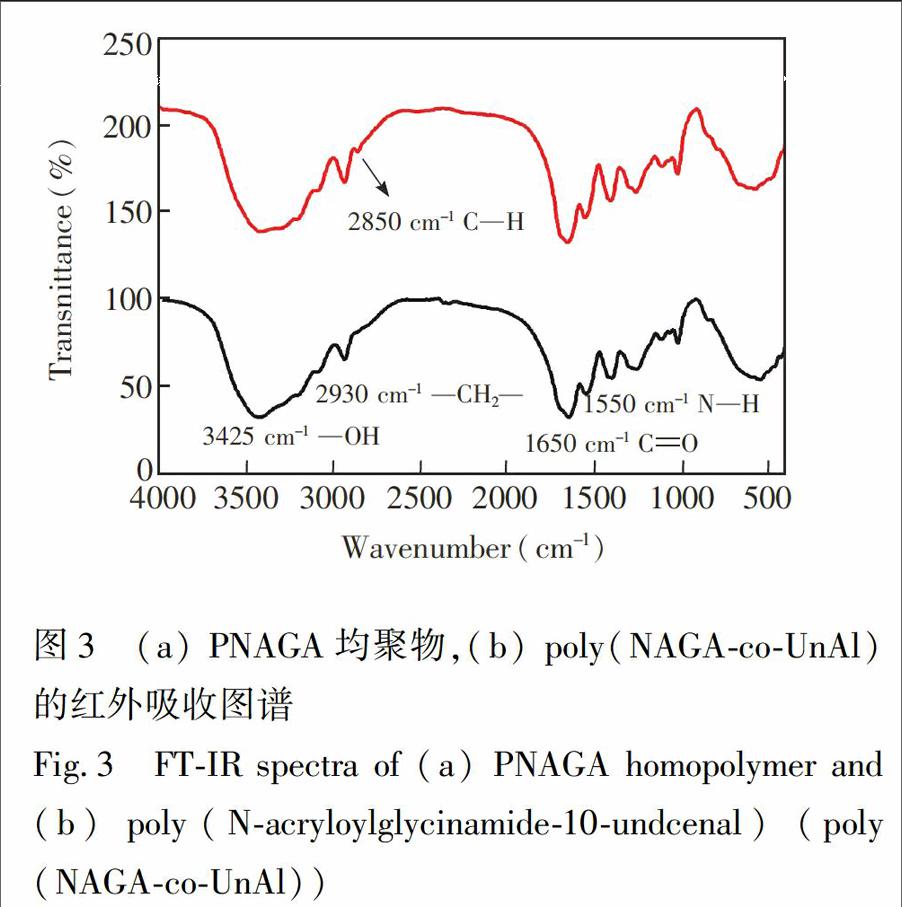
两个红外谱图中均存在的1550和1650cm 1两处强烈的吸收峰属于NAGA侧基上的JG(NZJYHJG)伸缩振动和JG(CZJLX,YOJG)伸缩振动;2930cm 1处的吸收峰属于聚合物骨架上的JG(CH2ZJZ;YJG)伸缩振动;(b)中出现的2850cm 1处的吸收峰属于醛基的JG(CZJYHJG)键特征吸收峰,表明在与UnAl共聚合之后,醛基被成功引入。上述结果证明所得聚合物由NAGA和UnAl两种单体共聚所得,温敏聚合物同时具备温敏响应基团和可用于胰蛋白酶固定的醛基官能团。
3.1.2UCST温敏共聚物的温敏性能考察poly(NAGAcoUnAl)在水溶液中的温敏性能如图4所示,poly(NAGAcoUnAl)温敏聚合物表现出了良好的UCST型温度响应能力。
在温度处于共聚物的UCST以上时,共聚物可完全溶解于水中,形成澄清透明的溶液(图4a);而当温度冷却至其UCST以下时,共聚物分子发生缔合,从溶液中析出,
体系出现明显的浑浊(图4b);经高速离心后与溶液分离(图4c),从而达到“高温均相溶解,低温异相分离”的目的。JPPS01764.eps,Y,PZ#TS((1HT5”SS
图4温敏聚合物poly(NAGAcoUnAl)在水中不同温度下呈现的不同状态(a)为加热后形成的澄清透明溶液,(b)为溶液冰水浴后形成的乳状悬浊液,(c)为乳状悬浊液经高速离心后形成的团聚沉淀
3.1.3poly(NAGAcoUnAl)的胰蛋白酶固载能力测试为考察poly(NAGAcoUnAl)对胰蛋白酶的固载能力,采用超微量分光光度计测定胰蛋白酶
溶液在固定前、后溶液中A280处吸光值的变化,计算出胰蛋白酶固定前、后的浓度差,再进一步计算得出一定质量温敏聚合物的胰蛋白酶固载量,测定poly(NAGAcoUnAl)对蛋白酶的固载能力为247.7μg/mg。
继续考察温敏聚合物固定化胰蛋白酶的酶活性,使用固定化酶酶解N苯甲酰L精氨酸乙酯(BAEE),通过测量不同时间酶解BAEE溶液的吸光度,得到温敏聚合物固定化酶的酶活力为228.3U/mg,即单位质量的温敏聚合物上负载的酶能够酶解228.3UBAEE。
计算公式:其中,P为每1mg供试品中含胰蛋白酶的量;A1为直線上终止的吸光度;A2为直线上开始的吸光度;T为A1~A2的读数时间(min);W为测定液中含供试品的量(mg);0.001为在上述条件下,1mL底物的吸收度1min改变0.001,即相当于1个BAEE单位(U);V为底物体积(mL)。胰蛋白酶的单位定义为:以BAEE为底物,在一定反应条件下,每分钟使ΔA253nm增加0.001的酶量为1UBAEE。
3.2UCST温敏共聚物固定化胰蛋白酶的应用
3.2.1固定化胰蛋白酶的酶解效率本实验分别使用UCST温敏聚合物固定化胰蛋白酶及溶液酶对牛血清白蛋白(BSA)进行平行酶解实验,来考察固定化酶的酶解效率。固定化酶酶解的操作过程如图2所示。酶解产物使用MALDITOF/TOFMS进行鉴定,一级质谱图如图5所示。1min固定化酶解BSA,鉴定到84条肽段,氨基酸序列覆盖率可达94%。而溶液酶解,虽然经过长达12h孵育,却只能鉴定到68条肽段,达到74%的氨基酸序列覆盖率,明显低于固定化酶解的结果(表1)。相比于溶液酶解所需的孵育时间12h,
固定化酶酶解仅需1min即可完成酶解,具有极大的效率和通量优势。这是由于UCST温敏共聚物固定化酶在37℃条件下可完全溶解于溶液中,
形成均相体系,消除了固液界面的传质阻力并降低了空间位阻,有效促进了酶与底物蛋白的碰撞。同时,固定化酶具有超高的酶固载量,使得体系内的酶底物蛋白比例远远高于溶液酶解中酶与蛋白比,在等量蛋白底物存在的情况下,固定化酶的量远远高于溶液酶的量,在固定化酶解过程中,酶与底物蛋白的碰撞几率成倍提高,从而大大加快了酶解反应的进行。
3.2.2固定化胰蛋白酶酶解的稳定性和重现性称量10mg温敏聚合物poly(NAGAcoUnAl),将其固定上胰蛋白酶。将此固定化酶在一个月内重复15次酶解40μgBSA。每次所得BSA酶解产物经MALDITOF质谱鉴定,15次酶解所得氨基酸序列覆盖率在82%~94%之间(均高于溶液酶解74%的序列覆盖率),波动范围小于10%,平均覆盖率达89%,相对标准偏差(RSD)为3.9%,如图6所示。结果表明,此固定化酶能够多次重复使用,且表现出良好的稳定性和重现性。
3.2.3HeLa细胞全蛋白酶解产物质谱鉴定本实验对HeLa细胞全蛋白的固定化酶解操作与上述对BSA的步骤相同,固定化酶解产物以及溶液酶解产物均经LCQExactivePlusMS质谱鉴定一次,搜库后结果如表2所示。经1min固定化酶解后鉴定到15012条肽段,归属于2659个蛋白。其中368条肽段含两个漏切位点,含1个漏切位点的肽段有3191条。经12h溶液酶解后鉴定到16215条肽段,归属CM(20于2754个蛋白。其中566条肽段含两个漏切CM)
位点,含1个漏切位点的肽段有3624条。综上ZH(可知,固定化酶具备快速、高效酶解的能力,而且酶解产物鉴定蛋白和肽段数量与溶液酶解相当,但酶解时间缩短720倍,同时带有漏切位点的肽段数量也有所降低。
通过合成poly(NAGAcoUnAl)温敏聚合物,成功制备出UCST温敏聚合物固定化胰蛋白酶。该温敏聚合物特有的温度响应特性,使制备的温敏聚合物固定化胰蛋白酶具有“高温均相酶解,低温异相分离”的特色和优势,可以很好地满足当前蛋白质组学研究中,快速、高效、高通量的鉴定需求;同时,作为一种新型通用型载体材料,其在固定化酶领域具有广阔的应用前景。ZH)
References
1(#WilhelmM,SchleglJ,HahneH,MoghaddasGholamiA,LieberenzM,SavitskiMM,ZieglerE,ButzmannL,GessulatS,MarxH,MathiesonT,LemeerS,SchnatbaumK,ReimerU,WenschuhH,MollenhauerM,SlottaHuspeninaJ,BoeseJH,BantscheffM,GerstmairA,FaerberF,KusterB.Nature,2014,509(7502):582-587
2AebersoldR,MannM.Nature,2003,422(6928):198-207
3ZhangYY,FonslowBR,ShanB,BaekMC,YatesJR.Chem.Rev.,2013,113(4):2343-2394
4NagarajN,KulakNA,CoxJ,NeuhauserN,MayrK,HoerningO,VormO,MannM.Mol.Cell.Proteomics,2012,11(3):M111.013722
5HanefeldU,GardossiL,MagnerE.Chem.Soc.Rev.,2009,38(2):453-68
6MaJF,ZhangLH,LiangZ,ShanYC,ZhangYK.TRACTrendAnal.Chem.,2011,30(5):691-702
7FanC,ShiZM,PanYT,SongZF,ZhangWJ,ZhaoXY,TianF,PengB,QinWJ,CaiY,QianXH.Anal.Chem.,2014,86(3):1452-1458
8CalleriE,TemporiniC,GasparriniF,SimoneP,VillaniC,CiogliA,MassoliniG.J.Chromatogr.A,2011,1218(49):8937-8945LM
9SONGZiFeng,ZHANGQingLin,ZHANGYangJun,QINWeiJie,QIANXiaoHong.ChineseJ.Chromatogr.,2012,30(6):549-554
宋子鳳,张庆林,张养军,秦伟捷,钱小红.HTK色谱,2012,30(6):549-554
10LIUJing,WANGFangJun,ZHANGZhenBin,ZOUHanFa.ChineseJ.Anal.Chem.,2013,41(1):10-14
刘静,王方军,张振宾,邹汉法.HTK分析化学,2013,41(1):10-14
11ZHANGZhenBin,OUJunJie,LINHui,LIUZhongShan,DONGJing,ZOUHanFa.Chem.J.ChineseUniversities,2013,34(9):2011-2019
张振宾,欧俊杰,林辉,刘忠山,董靖,邹汉法.HTK高等学校化学学报,2013,34(9):2011-2019
12LiangY,TaoDY,MaJF,SunLL,LiangZ,ZhangLH,ZhangYK.J.Chromatogr.A,2011,1218(20):2898-2905JP
13TianRJ,HoaXD,LambertJP,PezackiJP,VeresT,FigeysD.Anal.Chem.,2011,83(11):4095-4102
14QinWJ,SongZF,FanC,ZhangWJ,CaiY,ZhangYJ,QianXH.Anal.Chem.,2012,84(7):3138-3144
15YaoJZ,SunNR,DengCH,ZhangXM.Talanta,2016,150:296-301
16QIUJuan,ZHANGYing,LUHaoJie,YANGPengYuan.ActaChim.Sinica,2011,69(18):2123-2129
仇娟,張莹,陆豪杰,杨芃原.HTK化学学报,2011,69(18):2123-2129
17CastilhoMdeS,LaubeT,YamanakaH,AlegretS,PividoriMI.Anal.Chem.,2011,83(14):5570-5577
18LiuFY,SeuringJ,AgarwalS.Polym.Chem.,2013,4(10):3123-3131
19SeuringJ,BayerFM,HuberK,AgarwalS.Macromolecules,2012,45(1):374-384)KH*5/6D
AbstractBymassivelyanalyzingproteinsextractedfromcells,tissuesandorganismsusingmassspectrometry,proteomicsiscapableofprovidinginformationaboutchangeinproteinsexpression,modification,compositionandquantification.However,mostimmobilizedenzymesusedinmassspectrometrybased"shotgun"proteomicstrategyarepreparedusingsolidmaterialsastheimmobilizationmatrixanddigestthesubstrateproteinsinheterogeneoussystem.Theinherentmasstransferresistanceinthesolidliquidinterfaceandsterichindranceofthesolidmatrixlimitsthedigestionefficiencyandsampleprocessingthroughput.Here,wepreparedanovelimmobilizedenzymeusingsolublethermosensitivepolymerasthematrixmaterialbyexploitingthethermoresponsiveabilityofthepolymertoenvironmentaltemperaturechanges.Thethermosensitiveimmobilizedtrypsinhadthefeatureof“homogeneousdigestionathightemperatureandheterogeneousseparationatlowtemperature”andtheadvantageofsignificantlyshorteneddigestiontimeandrecoverandreuseoftheenzyme.Anaminoacidsequencecoveringupto94%in1mindigestionwasobtained,whichwashigherthanthatof74%obtainedbyinsolutiondigestionfor12h.Finally,theimmobilizedtrypsinwassuccessfullyappliedtofastandhighlyefficientdigestionofcomplexproteomeextractedfromHeLacell.Theefficiencyofimmobilizeddigestionin1minwassimilartothatofsolutiondigestionin12h,whichsufficientlydemonstratedtheapplicationpotentialofthisthermosensitiveimmobilizedtrypsininproteomicsresearch.
KeywordsImmobilizedenzyme;Thermosensitivepolymer;Massspectrometry;Proteomics;Fastdigestion
HQWT6JY(Received10March2016;accepted11July2016)
ThisworkwassupportedbytheNationalKeyProgramforBasicResearchofChina(Nos.2013CB911204,2016YFA0501403),theNationalKeyScientificInstrumentDevelopmentProgramofChina(No.2011YQ09000504),theNationalHighTechResearchandDevelopmentProgramofChina(No.2014AA020906),andtheNationalNaturalScienceFoundationofChina(Nos.21275005,21235001,21405175and21675172).
