基于高效液相色谱指纹图谱和量值传递的化痰解郁合剂质量研究*
2023-08-29吴俊洪梁少瑜吴升伟吴正治曾永长
吴俊洪,梁少瑜,吴升伟,于 林,吴正治,曾永长△
(1. 深圳大学第一附属医院转化医学研究院,广东 深圳 518035; 2. 广东省深圳市老年医学研究所,广东 深圳 518035; 3. 广州医科大学附属脑科医院,广东 广州 510370)
化痰解郁合剂由《备急千金要方》中的温胆汤[1]加减而来,由法半夏、枳实、陈皮、白芍、竹茹、甘草、远志、香附、茯苓、郁金等药材组方,具有理气化痰、开窍解郁之功,临床多用于痰湿内阻之癫病的治疗[2]。该方以煎剂形式应用多年,疗效确切,但由于服用量大,味苦、麻舌感强,影响患者的用药依从性。本课题组在前期研究中优化了复方的提取和制备工艺,开发出化痰解郁合剂,并制订出相应的质量标准[3]。本研究中建立了中试复方煎液的指纹图谱,利用相似度软件评价方中物质成分群在小试、中试及中试不同工序间的差异;探讨合剂生产过程中多种成分的转移率和固形物含量的变化,为产品质量控制和工艺放大评价提供理论支持。现报道如下。
1 仪器与试药
1.1 仪器
LC - 2030C 3D 型高效液相色谱仪及工作站、AP125WD 型电子天平(日本Shimadzu 公司,精度为0.01 mg);BSA224S型电子天平(德国Sartorius公司,精度为0.1 mg);GENIUS 16K型高速离心机(长沙市鑫奥仪器仪表有限公司);SY-5000型旋转蒸发仪(上海亚荣生化仪器厂);TC-15型套式恒温器(海宁市新华医疗器械厂)。
1.2 试药
芍药苷对照品(批号为110736 - 201943,含量95.1%),橙皮苷对照品(批号为110721-201818,含量96.2%),辛弗林对照品(批号为110727-201809,含量99.5%),甘草苷对照品(批号为111610-201607,含量93.1%),甘草酸铵对照品(批号为110731-201720,含量97.7%),3,6' - 二芥子酰基蔗糖对照品(批号为111848 - 201805,含量96.6%),均购自中国食品药品检定研究院;远志酸对照品(批号为151127,含量≥98%),西伯利亚远志糖A6对照品(批号为151015,含量≥95%),远志皂苷B 对照品(批号为150629,含量≥98%),均来源于成都普菲德生物技术有限公司;乙腈为色谱纯,其余试剂均为分析纯,水为纯化水。小试试验使用药材均收集于3 个产地(见表1),经广州医科大学附属脑科医院中医科于林教授鉴定均为正品。化痰合剂中试生产3 批,在广州市某符合GMP 要求的药品生产企业内开展,所用药材饮片均购自广州至信中药饮片有限公司。

表1 药材产地信息Tab.1 Information of producing areas of medicinal materials
2 方法与结果
2.1 样品制备
复方煎液:利用Excel 软件的RANDBETWEEN 函数生成随机数[4],将表1中不同产地的药材随机组合成10 批方剂(编号分别为S1 - S10)。取各批方剂药材166 g,加水15 倍,煎煮2 次,各1.5 h,200 目筛滤过,合并滤液,混匀,即得。
单味药材煎液:取表1 中不同产地的单味药材,同复方煎液制备方法煎煮2次,合并煎液,混匀,即得。
合剂:取复方煎液,减压浓缩至适当体积,得浓缩液;15 000 r/ min 离心10 min,取上清液;加入辅料,搅拌使溶解,补足水分,混匀,即得。
2.2 指纹图谱研究
2.2.1 色谱条件
色谱柱:依利特Supersil ODS2柱(250 mm×4.6 mm,5µm);流动相:乙腈(A)-0.1%磷酸溶液(B),梯度洗脱(0~8 min 时5%A→9%A,8~70 min 时9%A→30%A,70~90 min 时30%A→45%A,90~95 min 时45%A→80%A,95~100 min 时80%A,100~105 min 时80%A→5%A,105~110 min时5%A);流速:1.0 mL/min;检测波长:230 nm;柱温:30 ℃;进样量:10µL。
2.2.2 溶液制备
取橙皮苷、芍药苷、辛弗林、3,6' - 二芥子酰基蔗糖、远志酸、远志皂苷B、西伯利亚远志糖A6、甘草苷、甘草酸铵对照品各适量,精密称定,分别加甲醇制成单一对照品溶液;各取适量,加甲醇制成每1 mL 分别含21.93,32.87,15.92,9.00,73.02,33.63,4.89,18.77,50.09 µg 的混合对照品溶液。取2.1 项下复方煎液(或单味药材煎液)10 mL,加水稀释至25 mL,经0.22 µm微孔滤膜滤过,取续滤液,即得供试品溶液。取2.1项下分别缺枳实和陈皮,白芍的复方煎液,按供试品溶液方法制备,即得阴性对照溶液。
2.2.3 方法学考察[5]
精密度试验:取2.2.2项下复方煎液(S1)供试品溶液适量,按2.2.1 项下色谱条件连续进样测定6 次,以橙皮苷峰为参照峰,计算各特征峰的相对保留时间及相对峰面积。结果前者的RSD≤0.19%(n=6),后者的RSD≤2.06%(n=6),表明方法精密度良好。
稳定性试验:取2.2.2项下复方煎液(S1)供试品溶液适量,分别于室温下放置0,3,6,9,12,24,36 h 时按2.2.1 项下色谱条件进样测定,以橙皮苷峰为参照峰,计算各特征峰的相对保留时间及相对峰面积。结果前者的RSD≤0.27%(n=7),后者的RSD≤2.92%(n=7),表明供试品溶液在室温放置36 h内基本稳定。
重复性试验:取2.1 项下复方煎液(S1)适量,共6 份,按2.2.2 项下方法制备供试品溶液,再按2.2.1 项下色谱条件进样测定。以橙皮苷峰为参照峰,计算各特征峰的相对保留时间及相对峰面积。结果前者的RSD≤0.48%(n= 6),后者的RSD≤2.22%(n= 6),表明方法重复性良好。
2.2.4 指纹图谱建立及特征峰标定
指纹图谱建立:取2.2.2 项下复方煎液(S1 - S10)供试品溶液适量,按2.2.1 项下色谱条件进样测定,得10 批复方煎液的指纹图谱,导入中药色谱指纹图谱相似度评价系统(2012版),以S1为参照图谱,采用平均数法[6],时间窗为0.1 min,设置多点校正和峰匹配,生成叠加指纹图谱和对照指纹图谱,详见图1、图2。以对照指纹图谱为参照,各批复方煎液的相似度均大于0.920(见表2),表明不同批次煎液中主要物质群的差异较小。以重复性好、分离度佳为筛选原则,共标定20 个共有峰。在10批复方煎液的指纹图谱中,共有峰峰面积与色谱峰总面积的比值为(59.52±2.60)%。

图1 10批复方煎液高效液相色谱叠加指纹图谱Fig.1 HPLC superimposed fingerprints of 10 batches of compound decoction

图2 复方煎液高效液相色谱对照指纹图谱Fig.2 HPLC reference fingerprints of compound decoction

表2 10批复方煎液指纹图谱相似度评价结果Tab.2 Results of similarity evaluation for fingerprints of 10 batches of compound decoction
特征峰标定:取2.2.2项下的单味药材煎液供试品溶液及混合对照品溶液,按2.2.1项下色谱条件进样测定,记录色谱图。以色谱峰的保留时间和色谱图为依据,与复方煎液的指纹图谱进行比对(见图3),指认2号色谱峰为竹茹的特征峰;3,11,13~16,18,20 号色谱峰为远志的特征峰;6 号色谱峰为白芍的特征峰;19 号色谱峰为陈皮的特征峰;1,4,7,9,10,12 号色谱峰为枳实和陈皮共有;8,17 号色谱峰为法半夏、远志、甘草共有;5 号色谱峰为枳实、陈皮、白芍共有。同时从共有峰中指认出9 个成分,分别为1 号峰(辛弗林)、3 号峰(西伯利亚远志糖A6)、6 号峰(芍药苷)、8 号峰(甘草苷)、11 号峰(3,6'-二芥子酰基蔗糖)、12 号峰(橙皮苷)、17 号峰(甘草酸)、18号峰(远志皂苷B)、20号峰(远志酸)。
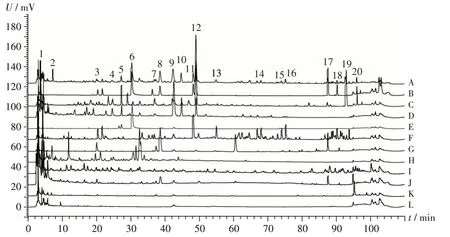
图3 复方煎液、混合对照品溶液和单味药材煎液的高效液相色谱图Fig.3 HPLC chromatograms of compound decoction,mixed reference solution and single medicinal material decoction
2.2.5 中试制备过程中指纹图谱的变化
取复方煎液、浓缩液、离心液和化痰解郁合剂各3批,分别精密量取1 mL,按2.2.2 项下方法制备供试品溶液,按2.2.1 项下色谱条件进样测定,记录色谱图(见图4)。将上述4种样品的指纹图谱与建立的对照指纹图谱进行相似度分析,其中前三者的平均相似度分别为0.936,0.886,0.865,且色谱峰数目基本一致;化痰解郁合剂的图谱中出现2 个新色谱峰,相似度降低,其中21号峰为抑菌剂,22号峰为矫味剂。20个共有峰稳定存在于中间产品及成品中,可用于评价化痰解郁合剂在不同生产环节的质量变化。

图4 高效液相色谱指纹图谱Fig.4 HPLC fingerprints
2.3 聚类分析
将10批小试和3批复方煎液(中试)的20个共有峰的峰面积进行归一化处理,导入SPSS 25.0 分析软件,采用组间连接法,以平方欧式距离(d)为测量,将样品进行分类[7],结果见图5。煎液间存在不同程度的差异,当d=1 时,中试3 批聚为一类,表明生产工艺和药材质量的稳定性;当d=10 时,中试3 批与除A1 和A5 外的8批小试煎液聚拢,提示药材产地对煎液质量的影响最大,生产批量及设备放大等因素次之。

图5 小试(A1-A10)和中试(B1-B3)样品的聚类树状图Fig.5 Cluster tree of small-scale samples(A1-A10)and pilotscale samples(B1-B3)
2.4 中试生产的量值传递考察
取中试的单味药材煎液、复方煎液、浓缩液、离心液和化痰解郁合剂各3批和小试的化痰解郁合剂10批,其中药材按2020 年版《中国药典(一部)》的方法测定,其余样品按前期工作中建立的含量测定方法制备成供试品溶液[3],进样分析,分别测定辛弗林、芍药苷和橙皮苷的含量,色谱图见图3、图6。计算中试不同样品的含量和转移率[8],结果见表3和表4。将中试和小试的化痰解郁合剂中3 种指标成分的转移率进行对比,结果见图7。
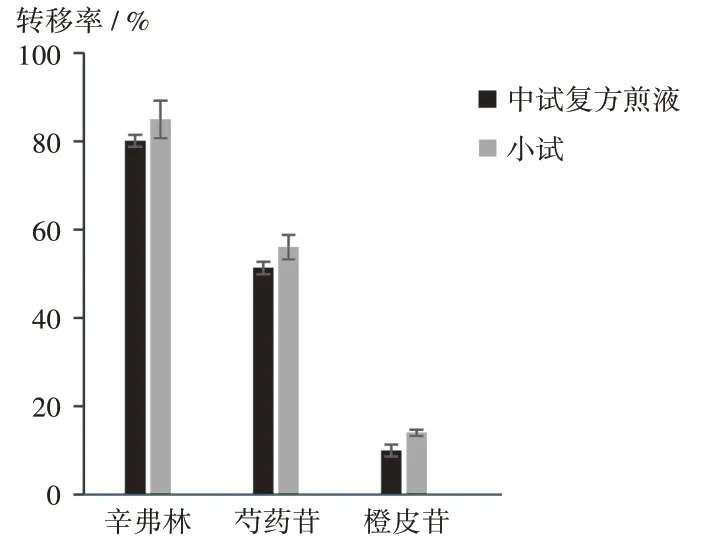
图7 3种指标成分的转移率Fig.7 Transfer rates of three indicator components

表3 样品中辛弗林、芍药苷和橙皮苷含量(%)Tab.3 Results of content determination of synephrine,paeoniflorin and hesperidin in samples(%)

表4 样品中辛弗林、芍药苷和橙皮苷的转移率(%)Tab.4 Transfer rates of synephrine,paeoniflorin and hesperidin in samples(%)
2.5 出膏率、固形物含量和总质量考察[9]
分别精密量取中试的复方煎液、浓缩液、离心液和化痰解郁合剂各25 mL,置已干燥至恒重的蒸发皿中,水浴蒸干,于105 ℃干燥至恒重,置干燥器中冷却30 min,精密称定,计算固形物含量、总质量及出膏率,其中固形物含量(g/ L)=M(g)/ 25 mL × 1 000,固形物总质量(kg)= 固形物含量×V(L)÷1 000,出膏率(%)= 煎液固形物总质量(kg)/药材投料量(kg)×100%,其中M为25 mL 样品中固物形的质量,V为样品总体积,结果见图7和图8。煎液体积较大,固形物含量低(7.46 g/L);浓缩后,体积显著减少,固形物含量提高(148.03 g/ L),但总质量有所损耗;高速离心后,固形物的一部分以沉淀的形式被除去,导致其在离心液的含量(137.53 g/L)和总质量均明显下降;在配液步骤加入辅料,固形物含量和总质量均增加,合剂的平均固形物含量和总质量为141.60 g/L 和16.89 kg。3 批中试样品的平均出膏率为(21.77±0.56)%,与小试样品的结果一致。

图8 固形物含量(A)和总质量(B)的变化Fig.8 Changes of solid substance content(A)and total mass(B)
3 讨论
3.1 指纹图谱检测波长选择及成分指认
本研究中采用二极管阵列检测器全波长扫描模式检测化痰解郁合剂在不同波长下的峰数目、响应值和分离度,结果在230 nm 波长处图谱基线平稳,色谱峰响应值较均衡,因此选择其作为检测波长。在指纹图谱方法学考察时,对比各峰的出峰时间和光谱图,明确了重复性和稳定性较佳的色谱峰有20个,存在于复方煎液-浓缩液- 离心液- 合剂中,可用于监测生产过程中样品的质量变化。
3.2 中试与小试的对比
在小试试验中通过提取和配制工艺考察,确定了化痰解郁合剂初步的生产工艺和质量标准,中试在此基础上提高生产规模,根据中间产品和成品的质量情况,并与小试进行比较,对评价工艺放大的稳定性具有重要意义。本次小试和中试生产主要有以下3 方面的区别,一是药材投料量,小试为每批166 g,中试为每批83 kg;二是试验设备,小试为电热套、旋转蒸发仪、高速离心机等,中试为多功能提取罐、双效浓缩器、管式离心机、全自动配液罐等;三是其他方面,包括计量工具、操作人员、生产场地等。指纹图谱、转移率及出膏率的分析结果显示,中试煎液与对照指纹图谱的相似度高,3 种指标成分的转移率稳定,出膏率与小试试验结果相同,提示放大提取工艺稳定;在不考虑辅料峰的情况下,从煎液、浓缩液、离心液到合剂,指纹图谱中色谱峰的数目、峰形及保留时间基本一致,中试和小试的成品中各成分的转移率相近,反映制剂工艺稳定。
3.3 指标成分的选择
化痰解郁合剂由经典名方温胆汤加减化裁而来,方中以法半夏为君药,枳实、竹茹为臣药,陈皮、白芍、茯苓、郁金、香附、远志为佐药;甘草为使药。有文献报道,枳实和陈皮中的辛弗林、橙皮苷为温胆汤治疗神经系统疾病的重要物质基础[10]。辛弗林通过调节大鼠大脑皮层内的去甲肾上腺素水平、5 - 羟色胺水平、血清皮质酮含量和糖皮质激素受体(GR)表达水平,改善海马细胞的病理变化,发挥抗抑郁作用[11];橙皮苷可减少抑郁症模型大鼠的神经细胞凋亡,调控海马组织的GR、N- 甲基-D- 天冬氨酸受体(NR2B)表达[12]。而芍药苷为白芍的主要成分之一,可改善精神分裂模型小鼠的认知记忆功能,减轻焦虑行为,促进星形胶质细胞增殖,抑制神经细胞凋亡[13]。因此本研究中选择上述3 种成分作为检测指标,考察复方在生产中的量值传递。
3.4 量值传递结果分析
中试生产的流程为药材煎煮、浓缩、离心、配液、灌装和外包装,得合剂。根据在此过程中得到的辛弗林、芍药苷和橙皮苷从药材到合剂的总转移率,结合各供试品溶液中的转移率和三者的理化性质可知,辛弗林易溶于水,热稳定性良好,各工序的转移率均较高;芍药苷在提取和浓缩中损失较多,可能与其长时间高温加热会发生降解有关[14],在后续的影响因素试验(高温试验)中亦出现了此现象;橙皮苷水溶性差,仅约20%从药材转移至煎液,经浓缩和离心后,损失约50%。以上3 种成分在提取、浓缩、离心等工序呈现出不同的转移特点,可为生产工艺评价和优化提供参考。
辛弗林、芍药苷和橙皮苷在中试样品中的转移率略低于小试样品,一方面是受设备的结构和使用方法所限,例如管式离心机腔体的“死体积”、灌装机装量调节等;另一方面,还与产品自身成分有关,由于本品含有较多的皂苷类成分,在生产中多个环节易混入空气而产生泡沫,配液罐、浓缩罐、离心机进料罐、储液罐中可见大量白色泡沫,而且短时间内不易消散,传输或利用困难,导致部分损失。
3.5 影响制剂质量的关键环节
从指纹图谱、转移率、固形物等多方面综合考虑,对制剂物质基础影响较大的工序有提取和离心。在前期工作中,本课题组利用信息熵赋权法结合正交试验优化了化痰解郁合剂的提取工艺。本研究中建立了复方煎液的指纹图谱,考察中试复方煎液与对照指纹图谱的相似度,结果显示两者的相似度高,聚类分析认为中试3批样品的质量均一,工艺放大对复方煎液的质量影响较小,为产品的药效奠定了基础。
离心可提高化痰解郁合剂的澄明度,并减少杂质。在制备工艺试验中对比了不同转速对有效成分的影响,结果表明在8 000~16 000 r/min范围内无明显差异。因此从提升制剂的澄明度角度出发,中试采用15 000 r/min进行离心操作。浓缩液经离心后,离心液中固形物含量和总质量明显减少,3 批湿沉淀的质量为2.8~3.2 kg,约占浓缩液的2.5%。离心液的指纹图谱和对照指纹图谱的相似度也较高,提示药效物质基础得以保留。
3.6 小结
本研究中建立的指纹图谱可反映复方的整体化学成分特征,中试复方煎液的质量与小试试验结果一致,提取工艺可靠,为化痰解郁合剂的大规模生产夯实基础;结合煎液、浓缩液、离心液和合剂中辛弗林、芍药苷及橙皮苷的转移率和固形物含量变化等数据,可为质量和工艺控制提供参考。
