熔融碳酸盐燃料电池阴极溶解与防护
2023-08-29任延杰周立波
李 聪,王 桃,任延杰,周立波,陈 荐,陈 维
(1长沙理工大学能源与动力工程学院,湖南 长沙 410114;2清远市粤博科技有限公司,广东 清远 511540)
MCFC技术已经成为商业化固定发电的首选技术,尽管其存在材料在腐蚀性环境中的稳定性问题和相比其他燃料电池更低的功率密度等问题,但全球多家公司正在现场测试千瓦至兆瓦级MCFC发电系统,并向电力需求相对较小的行业提供MCFC系统。此外,海上运输等领域也在探索MCFC的应用。由于MCFC在研发和商业化方面的快速发展,它在所有燃料电池技术中的发电机组安装数量方面处于领先地位[1,2]。
熔融碳酸盐燃料电池是一种高温燃料电池,其电解质是悬浮多孔、化学惰性的β-氧化铝陶瓷基质中的熔融碳酸盐混合物[3-4]。最先进的熔融碳酸盐燃料电池由多孔镍阳极(燃料电极)、多孔掺锂氧化镍(NiO)阴极(氧化剂电极)和填充锂及碳酸钾[62%~70% (摩尔分数) Li2CO3]作为电解质的铝酸锂基质组成[5-6]。该电池工作于高温(约650 ℃)和高压力(1~10 标准大气压)下,其燃料气是H2和CO 的增湿混合物,氧化剂是O2和CO2的混合物,可能含有水蒸气[7-8]。MCFC的工作效率可达60%,可以达到100 MW的运行功率,此外,利用废热,燃料效率可以高达85%[9-10]。
熔融碳酸盐燃料电池的工作温度较高,同时腐蚀性熔融环境会引起电池材料腐蚀溶解,大幅度降低电池材料的使用寿命[11]。目前,电池材料的腐蚀问题已经成为阻碍MCFC发展的重要原因之一。为解决这个问题,本文从替代材料、掺杂或涂层改性和添加剂三个角度综述了缓解腐蚀的策略——阴极溶解的改善方法。
1 熔融碳酸盐燃料电池
MCFC由多个单电池组成,其中阴阳电极由电解质膜隔开。每个单电池通过双极板互连,确保燃料和氧化剂的分配以及整个系统的电气连接。图1(a)是MCFC 平面配置的示意图[12]。与其他燃料电池类似,MCFC的工作原理是利用空气极的O2(空气)和CO2与电相结合,生成(碳酸离子),电解质将移到燃料极侧,与作为燃料供给的H+相结合,放出e-,同时生成H2O和CO2[图1(b)]。
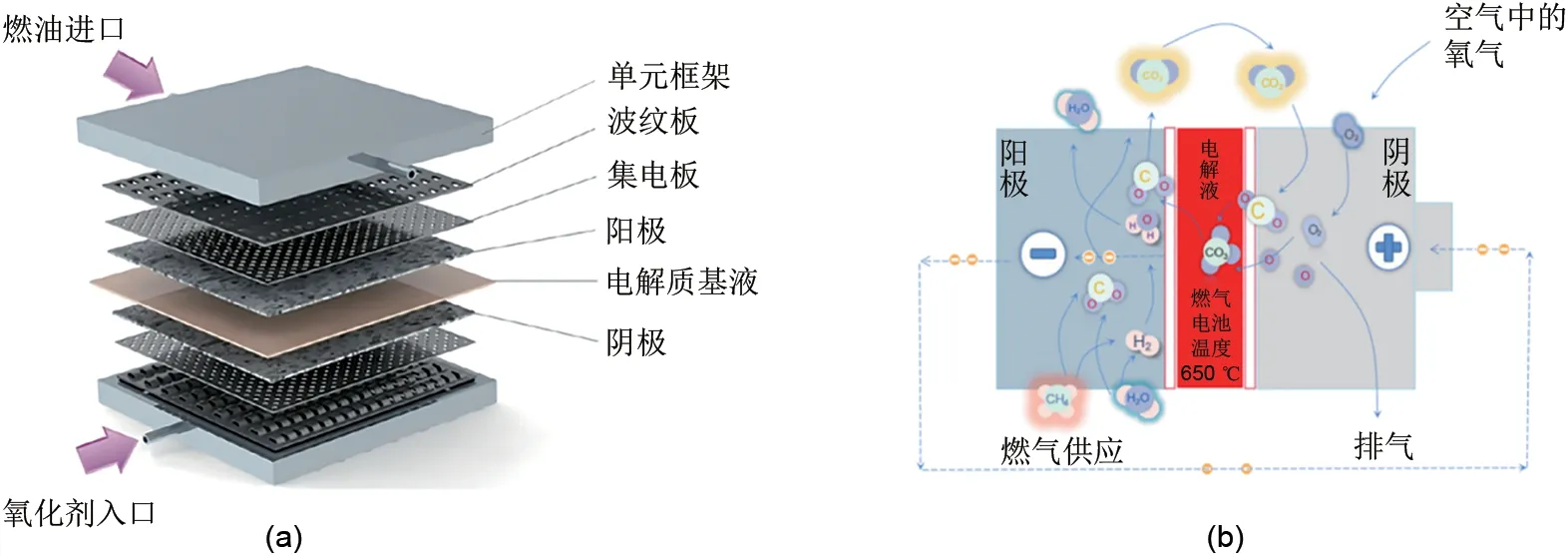
图1 熔融碳酸盐燃料电池平面配置示意图 (a)[12] 及熔融碳酸盐燃料电池的工作原理 (b)Fig.1 (a) MCFC plane configuration diagram[12] (b) Working principle of MCFC
2 阴极溶解
针对熔融碳酸盐燃料电池阴极材料的要求如下:除了具备足够的导电性外,在MCFC的工作温度下和在碳酸盐电解质中有较低的溶解度,并且拥有足够的孔隙率以允许反应物质的扩散,同时需要保证在氧化气氛中的稳定性。目前,最先进的阴极通常由预烧结多孔镍片的原位氧化和随后的锂化形成。然而,阴极在碳酸盐电解质中的溶解是限制MCFC寿命的问题之一[13-14]。
NiO在熔融碳酸盐中的溶解反应如下:
金属Ni析出过程:
NiO在碳酸盐熔体中的溶解度和溶解速率取决于碳酸盐熔体的酸性或碱性。根据碳酸盐熔体组成和组成碳酸盐的摩尔比,可在MCFC中观察到酸性和碱性溶解行为。对于Li2CO3/K2CO3混合物,当混合物中K2CO3的百分比较低(低于50%,摩尔分数)时,仅发生碱性溶解。除了酸碱特性外,溶解速率还取决于温度和CO2分压。通常情况下,阴极室中较高的CO2分压和较高的温度会导致较高的NiO溶解速率。除了阴极溶解中的Ni/Ni2+还原(方程式1)外,Belhomme[15]根据Li2CO3/Na2CO3溶液中对NiO溶解进行的循环伏安法研究得出结论:在650 ℃的工作温度下,除了阴极溶解中的Ni/Ni2+还原外,碳酸盐熔体和NiO之间在较低的电池电位下也可能形成固态相。
NiO阴极的溶解导致阴极极化增加,这是由于结构变化和Ni 沉积所致。在浓度梯度差下,Ni2+可以从阴极向阳极扩散。溶解的Ni2+在基体部分沉淀,然后遇到溶解的H2,在离阴极一定距离处被还原为Ni。Ni 的持续扩散加速了Ni 在阴极的进一步溶解,导致金属镍桥颗粒持续在电池上沉积,最终电池发生短路,导致电池电压迅速下降。电池短路的时间取决于电解质板的厚度、CO2的分压和电池的操作温度。
Morita 等人[16]对小型MCFC 进行的长期试验(60000 h)的结果表明,MCFC的降解可以分为两个阶段,如图2所示。第一阶段是由于内部电阻的增加和碳酸盐电解质损失导致的电极极化而逐渐降解,第二阶段由于阴极的结构变化和气体泄漏导致快速降解[17]。因此,NiO阴极的溶解会导致结构变化和Ni沉积,这两个因素都会显著影响MCFC的性能。

图2 (a) MCFC寿命期间电压退化的进展阶段[17];(b) MCFC根据工作时间(恒定电流下)退化的示意图Fig.2 (a) The progressive stage of voltage degradation during the MCFC life.the progressive stage of voltage degradation during the MCFC life[17] (b) Schematic representation of MCFC degradation according to operating time (constant current)
2.1 阴极材料替代
在寻找新的阴极材料时,需要考虑候选材料在MCFC工作条件下的稳定性、电导率和电催化活性。虽然Li2MnO3和La1-xSrxCoO3具有低溶解度,但它们的交换电流密度比NiO低且氧还原反应缓慢。经过测试的两种氧化物LiFeO2和LiCoO2具有不同的性能表现。LiFeO2不会在电解质基质中沉淀,因此溶解速率等于零,但表现出相当低的电化学性能。LiCoO2的性能与NiO 相当,但在MCFC 阴极条件下,其溶解速率比NiO低一个数量级。多孔LiCoO2阴极显示出足够的导电性。在图3(a)中,根据不同电流密度下的阴极极化,将替代阴极材料与NiO进行了比较,发现三种替代阴极材料对氧还原的催化性能都相当,但NiO基阴极具有良好的导电性,可以降低整体极化电阻[18]。此外,合成路线和起始材料对最终电极的特性也有很大的影响。Giorgi等人[19]报道了通过碳酸盐的热分解,然后用微粉化成孔剂对粉末进行流延制备LiCoO2阴极。并在空气和氩气气氛中以相对较低的温度(空气为700℃,氩气为500 ℃)进行烧结,以获得精细的微观结构。Bergman等人[20]的研究表明,传统烧结方法制备的LiCoO2阴极存在着集电器和阴极之间的高接触电阻问题。在电流密度为1 A/cm2时,LiCoO2阴极极化过电位超过250 mV,而NiO 阴极在相同条件下的过电位约为100 mV。这是因为在集电体和阴极之间形成了一层腐蚀层,而这种影响在LiCoO2中更为明显。腐蚀层在LiCoO2中是多孔的,由铁和钴的混合相组成,而在NiO 中,腐蚀层是富含Ni 的单相。此外,LiCoO2的机械强度较低,这也是其无法用于大面积阴极的主要原因,而这是商用固定发电机的关键要求之一。除此之外,相比于Ni,用于合成LiCoO2的Co 前体的成本高也是商业开发中的一个问题。因此,需要寻找其他材料或改进制备方法来解决这些问题。
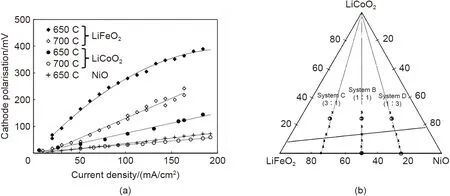
图3 (a) 替代阴极材料与NiO阴极的过电压损耗比较[18];(b) 所制备材料的成分和相细节,三元子系统B~D的相应LiFeO2∶NiO摩尔比分别为1∶1、3∶1和1∶3[21]Fig.3 (a) Comparison of overvoltage losses of alternative cathode materials with NiO cathode [18](b) Composition and phase details of the prepared materials.The corresponding LiFeO2∶NiO molar ratios of ternary subsystem B-D are 1∶1, 3∶1 and 1∶3, respectively[21]
为了解决阴极缺乏电化学性能和实用性的问题,需要让阴极材料既具有低溶解度,又具备良好的导电性和对氧还原的电化学活性[21]。Bloom等人[22]提出了多组分体系的概念。假设高浓度的LiFeO2能够降低在Li/K碳酸盐中的溶解度,LiCoO2和NiO预计能降低一定程度的电阻率。他们还研究了LiFeO2-LiCoO2-NiO 三元体系的稳定性,以提高电导率,同时降低溶解速率。在研究过程中,他们发现高浓度的LiFeO2能够降低在Li/K碳酸盐中的溶解度,而LiCoO2和NiO 则能够降低一定程度的电阻率。通过研究几种不同组成氧化物摩尔比的组成,得出了LiFeO2-LiCoO2-NiO 三元体系相图中存在两个均匀区域:一个富含LiFeO2-NiO 固溶体,另一个富含CoO2。实际的电池测试表明,采用LiFeO2-LiCoO2-NiO 三元体系阴极的MCFC 在650 ℃时,在160 mA/cm2的条件下提供了0.79 V 的电压,并且没有观察到质量传输损失。这些结果表明,多组分体系可以提高阴极材料的电化学性能和实用性,为研发更高效的燃料电池提供了新思路。Ringuedé 等人[21]报道了针对MCFC 阴极的LiFeO2-LiCoO2-NiO 材料的溶解度和电化学研究,他们使用溶胶-凝胶方法合成了LiFeO2-LiCoO2-NiO 三元体系中的新材料成分,并通过图3(b)展示了制备材料的成分和相细节。他们发现,电导率与材料中的钴酸锂含量有关系。电导率的最大值会随着体系中LiFeO2∶NiO 比例的降低而略微向CoO2含量较高的材料方向移动。此外,他们还研究了将LiCoO2添加到NiO-LiFeO2体系的二元化合物中。虽然LiFeO2可以减少Ni 的溶解,但同时也会影响钴的溶解度。在这种情况下,添加LiCoO2可以使化合物获得更好的电化学性能。值得注意的是,当25%的LiCoO2加入二元初始溶液中时,相应的电阻大大降低了(降为原来的1/10左右),这说明使用含有这三种元素的阴极材料,可以加速电荷转移过程。这些结果为研发更高效的MCFC阴极材料提供了关键的理论和实验基础。
Wijayasinghe 等人[23]使用溶胶-凝胶工艺制备了25∶75 LiFeO2系统中20%(摩尔分数)LiCoO2制备的MCFC阴极,并在Li-Al2O3基体上使用Li2CO3/K2CO3电解质和标准的Ni-Cr合金阳极进行流延。稳态极化表明,在650 ℃下,以80∶20 的H2/CO2作为燃料气体时,阴极极化低至62 mV。这表明多组分阴极系统有望替代NiO 阴极材料。Wijayasinghe等人[24-25]还发现,相较于甘氨酸硝酸盐路线,溶胶-凝胶工艺是更好的制备起始粉末的方法。他们还发现高于1000 ℃的烧结温度可能会导致多孔阴极中的Li蒸发,从而影响阴极性能。
在替代NiO 材料作为阴极材料的研究中,LiFeO2由于较差的电导率和催化活性被排除在外,而LiCoO2材料的高制造成本、低机械强度和脆性限制了其长远发展。虽然使用溶胶-凝胶工艺制作的LiFeO2-LiCoO2-NiO 三元材料被认为是锂化NiO的更可行替代品,但是这些材料很脆且价格昂贵,而且制造程序也相当复杂,难以规模化生产。因此,完全使用替代材料来代替NiO并不是一个完全可行的方案。然而,通过在替代材料上使用涂层来增加其化学性能,可以在某种程度上降低其阴极溶解度。这种方法为开发更可靠的MCFC阴极材料带来了新的可能性。
2.2 掺杂或涂层改性
当前,掺杂或涂层改性是缓解阴极腐蚀溶解的有效途径之一。通过在NiO中掺杂或覆盖一层电化学活性氧化物,可以降低NiO在熔融碳酸盐中的溶解度,从而制备稳定的NiO 阴极。这些稳定的NiO 阴极是通过多种涂层技术制备的,如溶胶-凝胶[26-28]、溶液浸渍[29-30]、电镀[30]、化学沉积[31-32]、微胶囊化[33]和机械涂层[34]、恒电流沉积[35]、恒电位沉积[36-39]、原子层沉积技术[40]。其中,LiCoO2是作为涂层的材料之一,与LiFeO2相比具有更好的导电性。通过在NiO 表面涂覆含钴前驱体,如CoO、Co3O4、CoOH或Co[26-39],在MCFC的工作条件下,这些前驱体迅速转化为LiCoO2,以此在NiO 表面覆盖一层LiCoO2,某些情况下还可形成LiCo1-yNiyO2相[26,31-32,36]或掺Li的CoO-NiO固溶体[33-35]。Brenscheidt等人[39]已经证明,在多孔NiO载体上涂覆一层9.5 μm厚的LiCoO2涂层能将电池的运行时间大幅度提高,对于实际应用而言,溶胶-凝胶浸涂等工艺可能相对简单且具有经济效益。Paoletti等人[41]用溶胶-凝胶工艺在NiO 阴极上涂覆LiCoO2。前驱体涂覆掺杂Fe-MgO的NiO阴极后,在MCFC中原位形成钴酸盐薄膜,涂层阴极的稳定性和抗极化能力与NiO阴极相当。这些结果表明:溶胶-凝胶工艺的确有较高的实用价值。然而,在商业环境中应用时,涂层的物理特性,如厚度和对微观结构的影响,以及涂层基体的制造等问题仍需进一步研究。此外,涂层工艺还需考虑阴极的极化电阻随孔隙率降低而显著增加的问题。
Ganesan等人[42]研究了La0.8Sr0.2CoO3涂层NiO作为熔融碳酸盐燃料电池阴极的性能。在涂覆了La0.8Sr0.2CoO3涂层的NiO阴极测试了100 h后,他们发现NiO阴极的溶解度从30 mg/L降至20 mg/L;然而,由于涂层,阴极的极化电压几乎增加了一倍(从59 mV增加到109 mV),并且在高于150 mA/cm2的高电流密度下,出现了明显的质量传输损失,这表明涂层导致了阴极的孔隙率降低。为了弥补由涂层导致的孔隙率降低,可以使用高活性电催化剂涂层(例如CeO2)。Soler等人[43]报道了使用Ce(NO3)3浸渍阴极的MCFC的性能。与NiO阴极(约112 mW/cm2)相比,具有改良阴极的电池在超过2200 h的测试期间提供了更好的性能(150 mW/cm2)。尽管阴极的孔隙率减小了5%,但实际上性能得到了提高,这可能是因为Ce 的电催化活性和储氧能力。Song 等人[44]报道了通过真空抽吸NiO 板上的固体GSC 浆料制备的钆锶钴酸盐(GSC∶Gd0.6Sr0.4CoO3)涂层阴极的电化学性能。该涂层降低了阴极的电荷转移阻力,加快了阴极的氧还原反应,从而提高了阴极的电化学性能。这表明GSC 涂层可以显著提高阴极的电化学性能。
采用原子层沉积技术(ALD)均匀且致密地覆盖涂层,以利用更加稳定的氧化物保护层,是一种非常有前景的来增强阴极的方法[40]。Meléndez等人[45]采用ALD 技术处理超薄TiO2层,形成了保形性好、纯度高且均匀的涂层。这些涂层浸入Li4Ti5O12中的熔融Li2CO3/K2CO3中230 h 后会发生反应生成LixTiyNiO1.98和LixTiyNiO1.65,并且会影响原位电化学行为,并扩散进入到衬底和保护层之间。TiO2涂层通过Ni 的扩散而逐渐富集起来,形成一种稳定的化合物,从而保护多孔的Ni,并大大降低了Ni 的溶解度。采用ALD技术制备涂层能够提高阴极的性能,同时也保证了阴极的长期稳定性和可靠性。此外,Meléndez 等人[46-47]还在多孔镍基底上沉积了Co3O4(50 nm)、CeO2(20 nm)的超薄层,并发现CeO2涂层材料与最先进的阴极相当,并将溶解性降低了约50%。Co3O4样品显示出最低的电阻,但在230 h 的浸泡中从未达到氧还原电位。就Ni 的溶解度的影响而言,TiO2涂层略优于其他涂层。但是要得出哪种涂层最好,需要进行更长时间的操作、复杂界面的稳定性以及动力学参数分析。此外,Meléndez 等人[48]还利用ALD 技术在多孔镍MCFC阴极上制备了精细的共形致密Nb2O5层。在多孔镍电极前112 h达到良好的工作电位,这表明了Nb2O5能增强NiO的催化性能。Kim等人[49]基于ALD制备了均匀、薄ZrO2涂层来提高MCFC 的性能和长期稳定性。通过图4 中X 射线光电子能谱(XPS)、TЕM图像和TЕM-ЕDS元素映射的分析结果,证实了ZrO2涂层能够均匀地涂覆在阴极表面上,而不会改变电极的多孔结构。由于Zr的低电负性,均匀的ZrO2涂层能向NiO 提供电子,从而改善电池性能。此外,ZrO2涂层还干扰了阴极的烧结,从而使得ZrO2涂层阴极的长期稳定性增强。同时,NiO的富电子环境通过氧还原反应提供电子,进一步增强了电池性能。
图4 (a) TiO2-1A EDS图;(b) TiO2-2A EDS图;(c) TiO2-2A和TiO2-1A的XPS图;(d) OCP图[49]Fig.4 (a) TiO2-1A EDS figure; (b) TiO2-2A EDS figure; (c) XPS figure of TiO2-2A and TiO2-1A; (d) OCP figure[49]

图5 (a) 未涂覆的阴极和ZrO2涂覆的阴极的XPS光谱 (b) ZrO2涂覆阴极的TEM图像和 (c) EDS映射图像Fig.5 (a) XPS spectra of uncoated cathode and ZrO2-coated cathode, (b) TEM image and (c) EDS mapping images of ZrO2-coated cathodes
微观结构和化学成分的改变会影响MCFC阴极的电化学行为[50-52]。为此,Lysik 等人[53]研究了新型的MCFC阴极,该阴极采用高度耐用的镀银镍材料制成双层膜结构,其中一层是邻近阴极集电体的多孔银层,另一层是毗邻电解质基质的多孔镍层(常规阴极)。经过性能和耐久性测试,研究发现,多孔银层能够增强阴极和集电器之间的电子传输,并且气体供应中存在银,氧还原反应得到增强,从而使得电池的功率密度增加了50%。同时,通过电化学测试鉴定,NiO 层与电解质分离,在1000 h 后,银层没有发生显著降解,说明了银层具有很强的耐腐蚀能力。Wejrzanowski 等人[54]则通过在MCFC阴极中使用金属泡沫载体,并开发出了一种基于胶带铸造的最先进制造工艺,以生产具有泡沫镍支架的微孔电极。研究发现,由于泡沫支撑的应用,新阴极的极限拉伸应力和失效应变显著增强。同时,微孔电极的金属结构也能轻微增强燃料电池的功率密度。另外,Song 等人[55]则通过在常规电极上涂覆一层纳米尺寸的LiNiO2颗粒来制造双层电极,以提高MCFC阴极的性能。研究表明,纳米LiNiO2层的表面积比传统电极的表面积大,从而提供了许多反应位点,使得反应期间的电荷转移电阻被降低了,从而提高了电池性能。不过,当纳米LiNiO2层的厚度增加时,传质阻力也增加,并且电池性能的增加效应减小。
目前可通过掺杂或涂层对NiO进行改性,涂层技术中,溶胶-凝胶技术和原子层沉积技术是比较有前景的方法。溶胶-凝胶技术能在较短时间内形成薄膜,但膜相对较厚,部分原料为有机物可能产生污染物,对健康有害。原子层沉积技术能形成较薄、更精确的薄膜,但需要更长时间。建议通过更多实验,研究ALD 金属氧化物涂层在MCFC 阴极环境中的耐腐蚀效果,以选出成本最低、耐腐蚀效果最好的金属氧化物涂层。
添加碱土金属氧化物和碳酸盐到碱性金属熔融碳酸盐中,是一种有效的降低NiO溶解度的方法[56-57]。Doyon等人[56]向Li2CO3-K2CO3电解液中添加少量碱土金属氧化物,发现添加1%(质量分数)的SrO 可以降低NiO的溶解度,达到1/15。Tanimoto等人[57]采用交流双探针技术测定了含碱土(Ca、Sr、Ba)碳酸盐的熔融Li2CO3-K2CO3和Li2CO3-Na2CO3的电导率,发现熔融Li2CO3-Na2CO3碱土体系中某些成分的电导率高于常规Li2CO3-K2CO3(62%∶38%,摩尔分数)电解质。Mitsushima等人[58]向Li/K碳酸盐熔体中添加MgO,发现Ni0.92Mg0.08O 在Li/K/MgO 熔体中Ni的溶解度远小于在Li/K熔体中的溶解度[图6(a)]。Scaccia[59]则研究了MgO 和(SrCO3+BaCO3)添加剂对在不同二元和三元熔融碱金属碳酸盐混合物中溶解度的影响,发现向熔融碳酸盐中添加3%(摩尔分数)的MgO,可以改变电解液的酸碱特性,从而进一步减少NiO 的溶解。他还发现NiO 在Li/Na/K/MgO 中的溶解度与在最碱性的Li/Na(52∶48)电解质中获得的值相似,而在Li/Na 中添加3%(摩尔分数)的(SrCO3+BaCO3)使NiO 在没有添加剂的情况下的溶解度值降低了接近一半。因此,添加碱土金属氧化物和碳酸盐到碱性金属熔融碳酸盐中,可以有效地降低NiO的溶解度,从而提高MCFC电池的稳定性和寿命。

图6 (a) 在650 ℃时,NiO和Ni0.92Mg0.08在Li/K (62/38)碳酸盐熔体和Li/K (62/38)+5% (摩尔分数) MgO熔体中的溶解度;(b) NiO的溶解度与La2 (CO3)3浓度的函数关系[60] (1 atm=101.326 kPa)Fig.6 (a) At 650 ℃, Solubility of NiO and Ni0.92Mg0.08O in Li/K (62/38) carbonate melt and Li/K (62/38)+5 mol%MgO melt; (b) The functional relationship between the solubility of NiO and the concentration of La2 (CO3) 3[60](1 atm=101.326 kPa)
向碱性碳酸盐熔体中添加稀土金属氧化物和碳酸盐也是减小NiO 溶解度的一种有效方法[60]。Matsuzawa 等人[60]发现,向碳酸盐熔体中添加La2O3可以将NiO 的溶解度降低10%。从图6(b)中可以看出,NiO的溶解度在添加量为1%(摩尔分数)时急剧下降;而在添加3%(摩尔分数)La2O3时,溶解度偏离直线,并且接近最小值。Meléndez等人[61]分析了添加5%(摩尔分数)Cs2CO3和Rb2CO3添加剂(Li/Na 仅用于Cs)的Li/K 熔融碳酸盐共晶对镍阴极的电化学行为的影响。他们发现,添加Rb和Cs可以分别降低到总电阻的1/3 和1/9。Matsuzawa 等人[62]的研究表明,La氧化物添加到熔融碳酸盐中可以降低NiO 的溶解度。在650 ℃下,当PO2/PCO2=0.4时,熔融碳酸盐中La2O3的稳定相为La2O2CO3。其存在可以显著降低NiO的溶解度。相比于碱性金属添加剂,La添加剂对NiO溶解度降低的影响更大。NiO在熔融碳酸盐中溶解度高低的排序为La>>Ca=Sr>Li>Na>K。Ota等人[63-64]研究了稀土氧化物(Y2O3、CeO2、Ho2O3、Gd2O2CO3、Yb2O3)加这些稀土氧化物对NiO溶解度的影响。结果显示,稀土氧化物的加入降低了NiO 的溶解度,其中Nd 的溶解度最高。然而,这些稀土氧化物的影响相对于La2O2CO3来说较小,因为它们的溶解度比La2O2CO3低。添加剂可以降低NiO在熔融碳酸盐中的溶解度,但是过量添加可能会影响电池性能。Tanimoto等人[64]研究发现在Li/Na共晶碳酸盐中添加9%(摩尔分数)的CaCO3或BaCO3可以保留电池的性能。因为碱土金属离子的分离会降低电池电压。在加压条件下进行的MCFC测试表明,在电解液中加入9%(摩尔分数)的CaCO3或BaCO3可以延长电池寿命,但是添加4%(摩尔分数)的SrCO3却会使电池电压降低,因此并不能延长电池寿命。
添加到NiO催化剂中的碱性氧化物与添加到电解液中的碱土金属和稀土金属氧化物相同。Choi等人[65]提出通过添加MgO 来稳定NiO 阴极,以减少Ni 沉积。Motohira等人[61]研究表明,向NiO中添加MgO会降低Ni2+的溶解度,而同时向NiO中加入MgO和Fe2O3会显著降低Ni2+的溶解度。此外,Matsuzawa等人[60]比较了NiO 和Ni0.92Mg0.08O 在Li/K 共晶碳酸盐中Ni的溶解度。如图6(a)所示,Ni0.92Mg0.08O比NiO在Li/K 共晶碳酸盐中Ni 的溶解度小。加入8% Mg的NiO 可降低13%的Ni 溶解度。与添加到电解液中的情况一样,在NiO 中加入稀土氧化物是减少NiO溶解的最有效方法。Еscudero等人[66]研究了使用0.07%~0.19%(摩尔分数)的La2O3浸渍共晶Li/K碳酸盐对非原位锂化NiO 阴极进行改性,并在650 ℃下进行电化学阻抗谱(ЕIS)分析,结果表明,浸渍La的阴极比无La样品具有更高的氧还原催化活性和更低的NiO溶解度。其中添加0.07%(摩尔分数)La2O3的样品表现出的性能最佳。Huang等人[67]对非原位NiO阴极进行了类似的研究,通过浸渍0.1%~0.34%(摩尔分数)的稀土氧化物(CeO2:70.35%,La2O3:13.83%,Pr2O3:3.59%,Nd2O3:12.23%)改性阴极,并在650 ℃下进行共晶熔融Li/K碳酸盐中的ЕIS 分析。结果表明,稀土氧化物浸渍的NiO 阴极比纯NiO阴极具有更高的氧还原催化活性和更低的NiO 溶解度。含有0.34%(摩尔分数)稀土氧化物的阴极材料性能最佳。Daza 等人[68]制备了CeO2(0.13%~2.2%,摩尔分数)浸渍改性的NiO,并通过表面和本体分析评估了其性能。浸渍Ce 的阴极显示出与参考NiO阴极相同的孔径分布和形态。尽管在加入Ce 的情况下Ni 的氧化速度更快,但在CeO2含量较低时,腐蚀过程的速度明显变缓。然而,Ce 和Li 的协同效应导致了阴极的锂化,使得阴极表面发生了变化,这对于无Ce 样品来说更为显著,因此需要进一步研究锂化的控制。
Liu 等人[69]对通过Dy 浸渍改性的阴极材料进行了研究。他们通过动态极化测量以及X射线衍射[图7(a)]和XPS[图7(b)]研究了Ni和含1%~10%(摩尔分数)Dy的Ni-Dy合金在熔融(Li,K)2CO3中的钝化行为,结果表明,将Dy 添加到Ni 中可以降低阳极电流,而Dy 的优先溶解增强了锂化作用及熔体的碱度,从而提高了阴极的耐腐蚀性。特别是,在添加1%(质量分数)Dy 时产生的效果最好。然而,目前尚不清楚为什么添加剂的用量变化很小,溶解速率和性能却会发生显著变化。因此,在实际应用中,由于Dy价格的下降,少量添加Dy来提高阴极的耐腐蚀性是一种不错的选择。另外,Hunag 等人[70]进行了NiO 添加0.3%、0.6%和1%(质量分数)Y2O3的ЕIS和溶解度研究。他们观察到,添加Y2O3可以促进电荷转移反应,并降低Ni的溶解速率。尽管在碳酸盐熔体中增强锂化作用和添加剂的优先溶解作用有助于改善阴极的稳定性,但是这些报告中获得的ЕIS 是在确定负载条件下的稳定性。因此,还需要进一步研究富含添加剂层的空间尺寸及其在高阴极电流密度下的稳定性。

图7 (a) 在650 ℃下,在(0.62Li,0.38K)2CO3中暴露70 h后,纯Ni-Dy合金和Ni-Dy合金上形成的鳞片的XRD图;(b) 纯Ni、Ni-1Dy和Ni-3Dy在650 ℃熔融(0.62Li,0.38K)2CO3中暴露100 h的XPS光谱氩溅射图[70]Figure 7 (a) XRD patterns of pure Ni-Dy alloy and scales formed on Ni-Dy alloy after exposure to(0.62Li, 0.38K) 2CO3 at 650 ℃ for 70 hours; (b) XPS spectral argon sputtering diagram of pure Ni,Ni-1Dy and Ni-3Dy exposed for 100 h in melting (0.62Li, 0.38K) 2CO3at 650 ℃[70]
为了降低阴极的溶解度,可以向电解液中添加碱土金属和稀土金属氧化物来增加电解液的碱度。然而,向碳酸盐熔体中添加大量氧化物会降低电池性能。相比之下,掺杂碱性氧化物的NiO催化剂虽然也会导致电化学活性下降,但可以更有效地抑制阴极溶解。然而,需要进行实验测试以了解添加后电解液的稳定性和毒性变化情况。
图8展示了NiO溶解还原的不同方法的示意图,表1列出了NiO溶解度降低以及与不同方法相关的问题。目前正在积极采取的主要方法包括以下三种:

表1 研究人员为提高阴极性能采取的措施Table 1 Measures taken by researchers to improve cathode performance

图8 NiO溶解还原的不同方法的示意Figure 8 Schematic diagram of different methods of NiO dissolution and reduction
(1)使用替代材料代替NiO。
(2)通过掺杂或涂层对NiO进行改性。
(3)通过增加电解液的碱度或在NiO中加入碱性氧化物来减少NiO的溶解。
3 总结与展望
MCFC技术目前正在快速发展,且实现商业化的前景广阔。一些公司已经展示了MCFC系统从千瓦到兆瓦的运行情况,实验装置的寿命运行已证明长达30000 h,电效率高达50%。然而,MCFC技术仍需要进行大量的开发工作,以提高功率密度,并解决材料问题。其中,MCFC 阴极溶解作为MCFC商业化的关键因素,提高阴极的稳定性是至关重要的。
为了解决阴极溶解问题,研究人员提出了替代NiO 的可行性。然而,这些替代材料通常价格昂贵、易碎,并且制造程序复杂,难以进行规模化。相比之下,通过掺杂或涂层对NiO进行改性是一种更可行的方法。它不仅可以增强阴极的化学稳定性,还可以降低阴极溶解度。原子层沉积是一种更好的选择,可促进涂层与基材的黏附并增强其机械稳定性。另外,通过添加碱性氧化物来增加电解液碱度也是一种方式,但要注意,添加过多会降低电池性能。目前,向电解液或阴极中添加少量La2O3是减小NiO溶解度的最佳方法。使用这种添加剂可以通过增加输出功率来提高MCFC的堆叠性能。但在这些添加剂投入商业使用之前,必须在单个电池中进行测试,以确定其性能。
未来,为了满足商业化需求,需要改进电解液的稳定性、抗腐蚀性和热稳定性,并降低成本和毒性。添加稀土元素和稀土氧化物等材料的前景广阔,但相关实验还不充分。此外,MCFC技术与纳米技术相结合,可提高涂层技术,如原子沉积技术等,使MCFC 器件更加高效、稳定和经济。因此,未来的研究应该注重探索更多的改性方法,并在生产过程中降低成本和提高可扩展性。特别是需要进一步开发新型添加剂和涂层技术,以更好地提高电解液的稳定性、抗腐蚀性和热稳定性,同时降低成本和毒性。
