卵巢绒毛膜癌继发肺转移1例*
2023-08-28付兆鑫付晶晶李树高郑奕楠
付兆鑫 付晶晶 李树高 郑奕楠
山东省临沂市中心医院 276400
卵巢绒毛膜癌在临床罕见,占恶性生殖细胞肿瘤的不到1%。这种肿瘤可以起源于卵巢的妊娠组织(妊娠绒毛膜癌,GCO)或纯生殖细胞(非妊娠绒毛膜癌,NGCO)。卵巢GCO的估计发病率为妊娠的1/3亿,多发生于育龄期女性,而NGCO对应的卵巢生殖细胞肿瘤不到0.6%,与妊娠无关,也叫原发性绒毛膜癌,可发生于任何年龄,包括男性。这两种肿瘤的临床特征和组织学是相同的,其临床表现为腹痛、阴道不规则流血、附件包块,实验室检查血HCG均升高。病理表现相同[1],由滋养细胞组成,无绒毛组织存在。这两种肿瘤类型具有不同治疗方法、化疗方案和与每种疾病相关的预后的不同实体,因此,区分肿瘤类型是有效治疗的必要条件。GCO多采用EMA-CO或氟尿嘧啶为主的方案化疗,NGCO多采用BEP方案化疗,GCO的预后整体好于NGCO患者。妊娠、闭经或妊娠滋养细胞疾病的临床病史可能有助于确定诊断。Saito等人[2]于1963年首次描述了NGCO的诊断标准。这些包括宫腔无疾病、疾病的病理证实、排除异位妊娠和宫内妊娠。但临床的诊断并不准确,除非是无法怀孕或从未发生过性交的患者。鉴别这些肿瘤类型的一个策略是通过DNA多态性分析确定父系DNA的存在,但DNA分析价格昂贵,尚未普及,在之前的病例报道中少见。卵巢绒毛膜癌存在早期血源性转移特点,如肺部转移[3]。NGCO转移性疾病患者的预后被认为比GCO更差,常导致预后不良。本文通过分析我院收治的1例卵巢绒毛膜癌继发肺转移的临床诊疗资料,并结合相关文献,以期提高对卵巢绒癌的诊疗水平。
1 病例资料
患者女,39岁,因“停经3个月,阴道不规则流血伴下腹痛1个月,腹痛加重1d”于2014年8月28日入本院治疗。既往月经规律,无痛经,14岁来潮,4~5/30~30,末次月经2014年5月31日。G4P2L2A2。2014年8月28日子宫附件彩超提示:左侧附件处可见一个大小约13.4cm×6.7cm的肿块图像,形状不规则,内部回声分布不均质,边界清,边缘回声不整齐,内见多个小透声腔,盆腹腔内可见片状液性暗区。超声考虑卵巢肿瘤、盆腹腔积液(见图1)。实验室检测:血HCG>10 000mIU/ml。考虑患者卵巢肿瘤或异位妊娠破裂出血,遂急症手术。
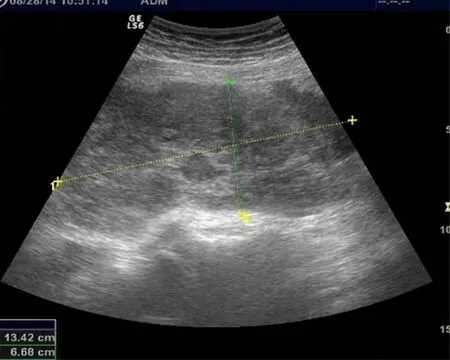
图1 彩超结果
术中见:腹腔内积血及血块约700ml,子宫如孕8周大,形状不规则,子宫肌壁间触及5个大小不等的肌瘤,左侧卵巢肿瘤约15cm×15cm×10cm,形状极不规则,表面紫蓝色,质脆,触之表面易破裂出血,肿瘤内为陈旧性血块及烂肉样组织,双侧输卵管及右侧卵巢外观正常。切除左侧附件并行诊断性刮宫术,宫腔内组织未见绒毛,一并送快速病理,结果显示:左卵巢恶性肿瘤,绒癌的可能性大。因患子宫肌瘤多发,遂行全子宫切除术。2014年9月1日复查胸部CT:(1)考虑左肺少许炎症,建议治疗后复查。(2)左侧胸腔少量积液、双侧胸膜肥厚。病理检查:灰红碎组织一堆,V:11cm×10cm×6cm,切面灰红质稍韧,大部似为血块。其内查见输卵管样物一段,长约4cm,d:0.8cm。子宫内膜:灰白色膜样组织一堆,V:2cm×2cm×1cm;全切子宫,V:10cm×8cm×5cm,宫腔深5cm,颈管长4cm,内膜菲薄,宫颈光滑,肌壁见查见肌核一枚,d:1.5cm。镜下:(1)左卵巢绒毛膜细胞癌,累及左输卵管及子宫浆膜层。免疫组化:HCG(+)、CK7(+)、α-抑制素(+)、CK(+)、AFP(-)。(2)子宫:平滑肌瘤,慢性宫颈炎,分泌期样子宫内膜。见图2。
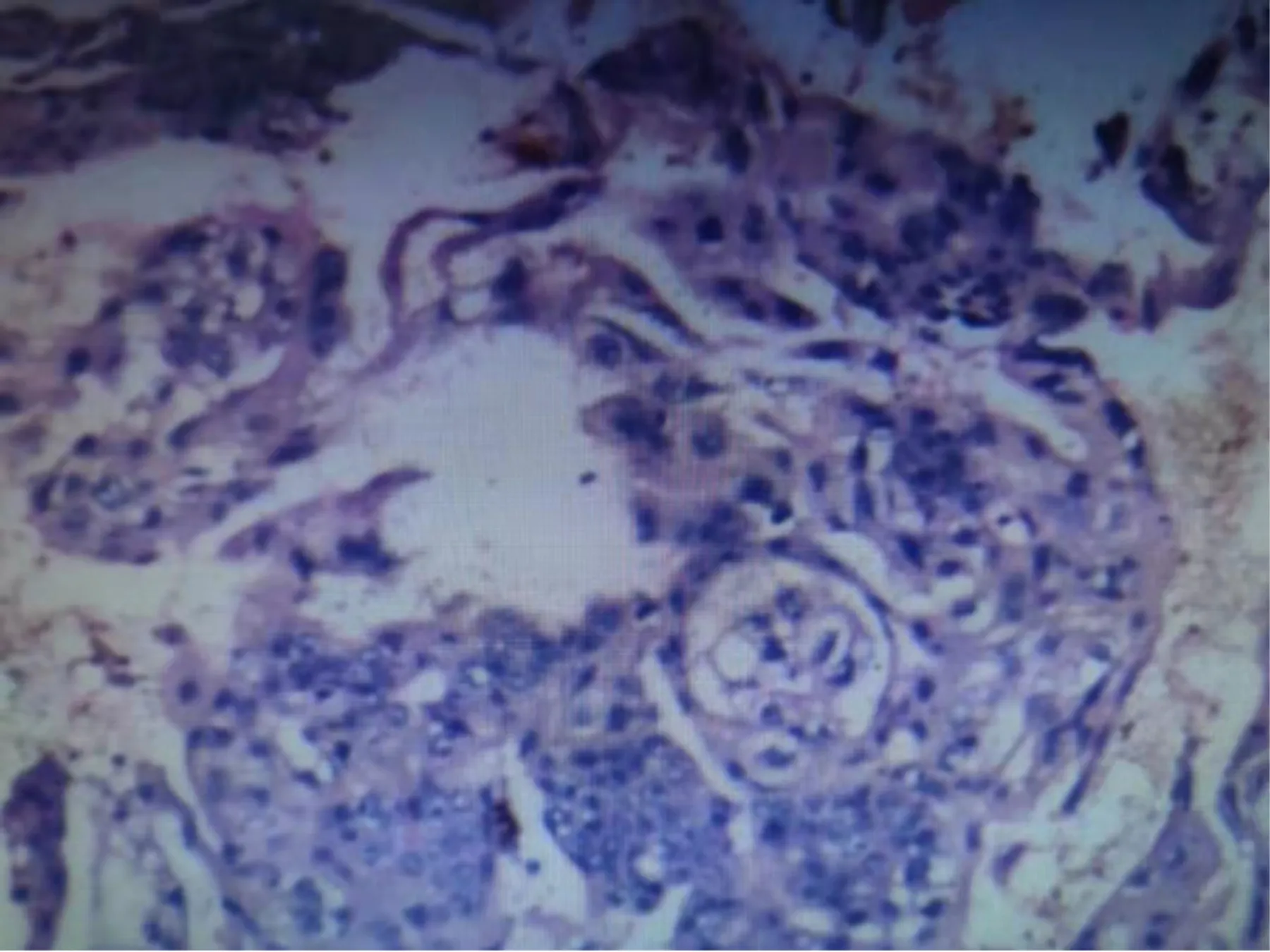
图2 卵巢绒癌病理HE 染色
术后给予5个疗程化疗(放线菌素D、依托泊苷、氟尿嘧啶、长春新碱),化疗2次后血HCG至正常。后未规律复查。2021年12月21日复查胸部CT示右肺下叶背段(Img134)、左肺下叶背段(Img173)、左肺下叶外基底段(Img192)见3个实性结节,较大者位于右肺下叶背段(Img134),大小约2.3cm×1.8cm考虑右肺恶性肿瘤可能(见图3)。实验室检查血HCG正常。于2021年12月29日在全麻下行胸腔镜下右侧胸腔粘连松解+右肺下叶局部切除+胸腔闭式引流术,冷冻:(右肺下叶)浸润性癌,形态符合绒癌转移,请结合临床注意寻找原发灶。常规:(右肺下叶)浸润性癌,结合形态及免疫组化符合绒癌转移。免疫组化:HCG-β(3+)、P16(3+)、P63(部分+)、CK7(3+)、HPL(-)、Ki-67(约80%)、TTF-1(-)。见图4~6。

图3 2021年12月21日胸部CT结果
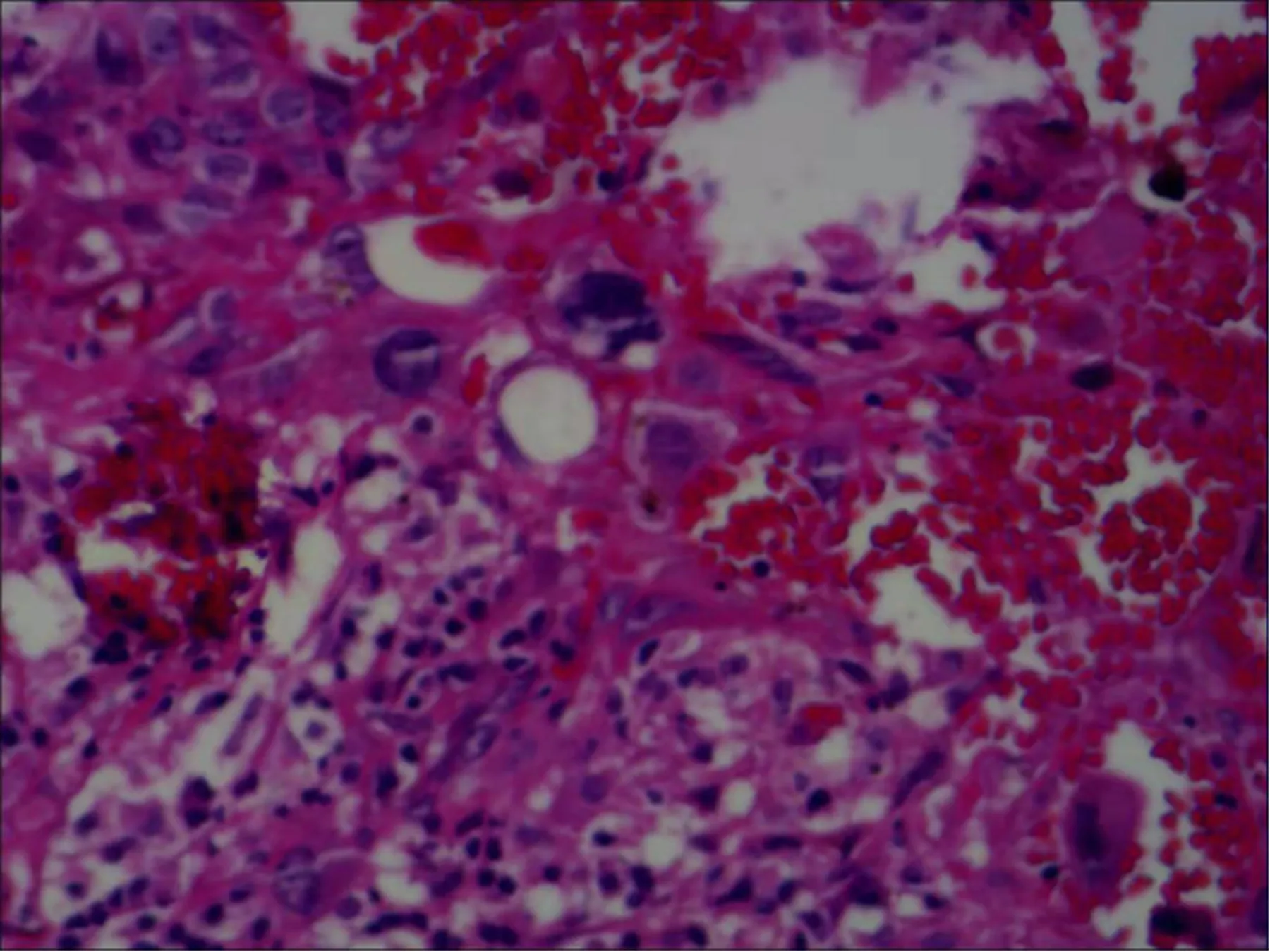
图4 肺部绒毛膜癌病理HE染色
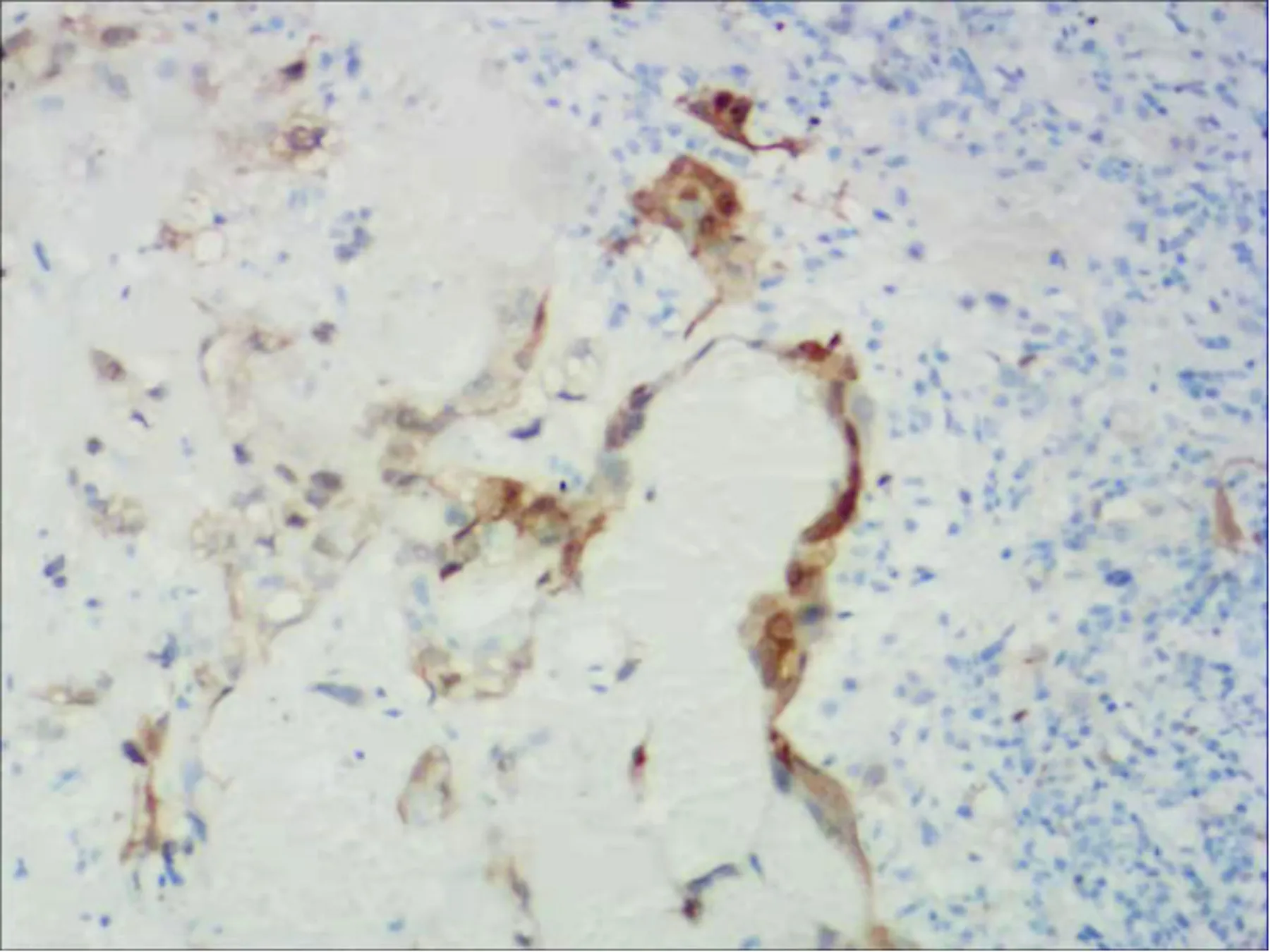
图5 肺部绒毛膜癌P16免疫组化
后行2次化疗(氟尿嘧啶、放线菌素D、长春新碱)。
2022年3月22日行腹腔镜单侧输卵管—卵巢切除术、腹腔镜盆腔淋巴结清扫术、腹腔镜腹腔淋巴结清扫术、腹腔镜盆腔粘连松解术、腹腔镜下腹腔粘连松解术、腹腔镜下阑尾切除术,术后病理结果:左侧卵巢绒癌术后化疗后送检廓清标本:(1)送检右附件、左侧漏斗韧带、阑尾、大网膜均未见癌;送检左、右盆腔淋巴结及腹主动脉旁淋巴结均未见癌转移(0/5、0/5、0/2)。(2)(右侧)卵巢可见白体及含铁血黄素沉积,输卵管未见著变。(3)(左侧漏斗韧带)送检韧带纤维及平滑肌组织。(4)阑尾慢性炎。现继续化疗中(按原方案),胸部CT检查结节无明显变化。
图6 肺部绒毛膜癌HCG免疫组化
2 讨论
绒毛膜癌是一种恶性妊娠滋养细胞疾病,通常(50%)发生在葡萄胎后。25%的病例发生在自然流产后,22.5%的病例发生在正常妊娠后。极少数情况下,它可能发生在异位妊娠之后,并可能起源于卵巢[4]。
卵巢绒毛膜癌属于滋养细胞肿瘤,按照起源与妊娠有无关联,分为妊娠性和非妊娠性[5]。妊娠期卵巢绒毛膜癌可能发生在卵巢妊娠中,或代表宫内或输卵管内原发性疾病的转移[6]。非妊娠期卵巢绒毛膜癌(NGOC)在临床罕见,通常为混合型[7]。性未成熟、无法怀孕或未进行性交的患者诊断为NGCO。有研究发现,性生活活跃或曾经怀孕的青春期后妇女,很有可能是妊娠起源,从上一次妊娠到出现绒毛膜癌之间的间隔为15年或更长[7]。
组织学上,若肿瘤结合其他生殖细胞成分,如肿瘤中的胚胎癌或无性细胞瘤,意味着非妊娠病因。当存在单一绒毛膜癌时,两者没有显示出显著的超微结构差异[8],均表现为典型的细胞滋养层。HCG水平也不能区分两种类型的肿瘤。子宫内无原发性病变和增生性子宫内膜也不意味着原发性绒毛膜癌。
Fisher等人于1992年首次通过分析DNA多态性诊断绒毛膜癌,如果肿瘤成分仅来源于患者,则诊断为非妊娠期绒毛膜癌,确定肿瘤中是否存在父系DNA[1],则诊断为妊娠期绒毛膜癌。然而,由于该方法价格昂贵,尚未在临床实践中广泛应用。
与妊娠期绒毛膜癌相比,非妊娠期卵巢绒毛膜癌的预后较差[9]。NCGO更常侵犯邻近器官,更常见的是通过血行转移到远处器官,如脑和肺[10],其中肺部(80%)、骨盆(20%)、阴道(30%)、肝脏(10%)和其他罕见部位,包括胃肠道、脾脏和肾脏肿瘤的特征是存在两种细胞系:细胞滋养层,细胞呈片状排列,形成绒毛状结构;合胞滋养层,分泌β-人绒毛膜促性腺激素和人胎盘催乳素,位于肿瘤的前沿[4]。该患者肺部转移后β-HCG的血液水平正常,可能是因为化疗后和手术后的影响[11]。治疗包括手术和术后化疗。
在文献中提到的所有病例中,临床医生均进行了外科手术,包括单侧卵巢切除术/输卵管卵巢切除术、腹式子宫切除术+双侧输卵管卵巢切除术,以及双侧输卵管卵巢切除术/单侧输卵管卵巢切除术+对侧卵巢切除术。卵巢绒癌患者术后多接受化疗,NGCO大多数患者接受铂类药物治疗,少数患者接受甲氨蝶呤类药物治疗,GCO多使用EMA-CO治疗,但目前化疗方案无明显定论。
该患者有4次妊娠生育史,无法鉴别其为妊娠性或非妊娠性卵巢绒癌,DNA分析判定有待于完善。目前卵巢生殖细胞肿瘤合并肺转移较少见,多为个案报道,研究发现卵巢绒癌合并肺转移者,因其血行转移特点,并不意味着肿瘤达晚期,经过联合治疗,其预后远较其他生殖细胞肿瘤预后好[3],该患者首次治疗7年后出现肺转移,已行全面廓清手术,鉴于该患者首次手术后联合化疗效果可,暂定术后再行2次化疗(方案同前),后续治疗效果继续跟踪。
