外周血T淋巴细胞亚群及T细胞表面共抑制分子表达水平对PD-1/PD-L1抑制剂联合化疗治疗NSCLC疗效的预测效能分析
2023-08-28季留连夏月琴焦爱民董正宇
杨 荣,徐 莹,季留连,夏月琴,张 林,焦爱民,董正宇
盐城市第二人民医院肿瘤内科,江苏盐城 224000
近年来,免疫治疗于肺癌领域取得突破性进展,发现免疫检查点抑制剂可为肺癌治疗提供新途径。程序性死亡因子1(PD-1)/程序性死亡因子配体1(PD-L1)为重要免疫检查点,可经由逃避杀伤清除、抑制免疫反应、免疫逃逸等途径提升肿瘤微环境对正常免疫抵抗作用[1]。目前,PD-1/PD-L1抑制剂在多种种恶性肿瘤患者治疗中取得了确切效果,近期其被进入肺癌治疗中,也显示出了良好应用前景,关于其疗效预测标志物已成为临床关注的热点课题[2]。国内外研究证实,外周血T淋巴细胞亚群及T细胞表面共抑制分子维持机体免疫功能中具有重要作用,且与肿瘤发生、进展有关[3-5]。但对于外周血T淋巴细胞亚群及T细胞表面共抑制分子表达水平与PD-1/PD-L1抑制剂联合化疗治疗非小细胞肺癌(NSCLC)疗效之间的关系研究报道较少。本研究尝试分析外周血T淋巴细胞亚群及T细胞表面共抑制分子表达水平对PD-1/PD-L1抑制剂联合化疗治疗NSCLC疗效的预测效能,以期为临床诊治提供参考支持。现报道如下。
1 资料与方法
1.1一般资料 选取2019年5月至2021年4月在本院行PD-1/PD-L1抑制剂联合化疗治疗的NSCLC患者48例作为研究对象。研究对象依据治疗4个周期后的效果分为缓解组(22例)、未缓解(26例)。纳入标准:(1)经病理组织学检查确诊为NSCLC,其中腺癌28例,鳞癌20例,腺癌患者经基因检测无敏感驱动基因突变;(2)临床分期Ⅲb~Ⅳ期;(3)美国东部肿瘤协作组体力状况评分0~2分;(4)既往未采取系统治疗、未应用影响机体免疫功能药物;(5)存在客观可测量肿瘤病灶;(6)预计生存时间>3个月;(7)患者知晓本研究,签订PD-1/PD-L1抑制剂治疗同意书及超适应证使用说明书;排除标准:(1)合并自身免疫系统疾病、急性感染性疾病;(2)肝、肾等脏器出现器质性疾病;(3)合并血液系统疾病、精神系统疾病;(4)合并肺间质疾病;(5)存在全身免疫抑制反应;(6)对本研究应用药物过敏。本研究经医院伦理委员会同意。
1.2方法
1.2.1实验室指标检测 治疗前后分别采集患者清晨空腹静脉血样6 mL,取3 mL以流式细胞仪(美国BD公司,FACSCantoⅡ)测定外周血T淋巴细胞亚群(CD3+、CD4+、CD8+)及PD-1水平;将另3 mL以3 000 r/min离心10 min,取血清,以化学免疫分析法测定血清糖类抗原125(CA125)、癌胚抗原(CEA)水平,酶联免疫吸附试验法测定血清细胞角蛋白19片段(CYFRA21-1)水平,试剂盒均购于均购自上海太阳生物技术有限公司,操作严格按试剂盒说明书执行。
1.2.2治疗方法 所有患者均给予含铂两药方案化疗,腺癌患者采用培美曲塞+顺铂/卡铂或白蛋白紫杉醇+顺铂;鳞癌患者采用吉西他滨+顺铂或白蛋白紫杉醇+顺铂。同时在此基础上予以PD-1/PD-L1抑制剂治疗,治疗药物涵盖进口药物帕博利珠单抗、纳武利尤单抗、阿特珠单抗及国产药物卡瑞利珠单抗、信迪利单抗、特瑞普利单抗。治疗3周为1个周期,持续治疗4个周期。
1.3判断治疗疗效标准 参照世界卫生组织(WHO)实体瘤疗效评价标准(WHO双径测量法)进行疗效评定:(1)原有病灶消失,未出现新病灶,持续时间≥4周为完全缓解;(2)病灶缩小>50%,未出现新病灶,持续时间≥4周为部分缓解;(3)病灶缩小≤50%或增大≤25%,未出现新病灶,持续时间≥4周为稳定;(4)病灶增大>25%或产生新病灶为进展[6]。将完全缓解与部分缓解归入缓解组,稳定、进展归入未缓解组。
1.4观察指标 (1)两组一般资料[年龄、性别、体重指数(BMI)、饮酒史、吸烟史、合并症(高脂血症、高血压、糖尿病、冠心病)、病理类型、临床分期]比较;(2)两组治疗前、治疗4个周期后外周血T淋巴细胞亚群及T细胞表面共抑制分子(CD3+、CD4+、CD8+、PD-1)、肿瘤标志物(CA125、CEA、CYFRA21-1)水平比较;(3)NSCLC患者外周血T淋巴细胞亚群及T细胞表面共抑制分子与肿瘤标志物相关性分析;(4)NSCLC患者疗效影响因素分析;(5)分析外周血T淋巴细胞亚群及T细胞表面共抑制分子对治疗NSCLC疗效预测价值。

2 结 果
2.1两组一般资料比较 两组年龄、性别、BMI、饮酒史、吸烟史、合并症、病理类型、临床分期比较,差异无统计学意义(P>0.05)。见表1。
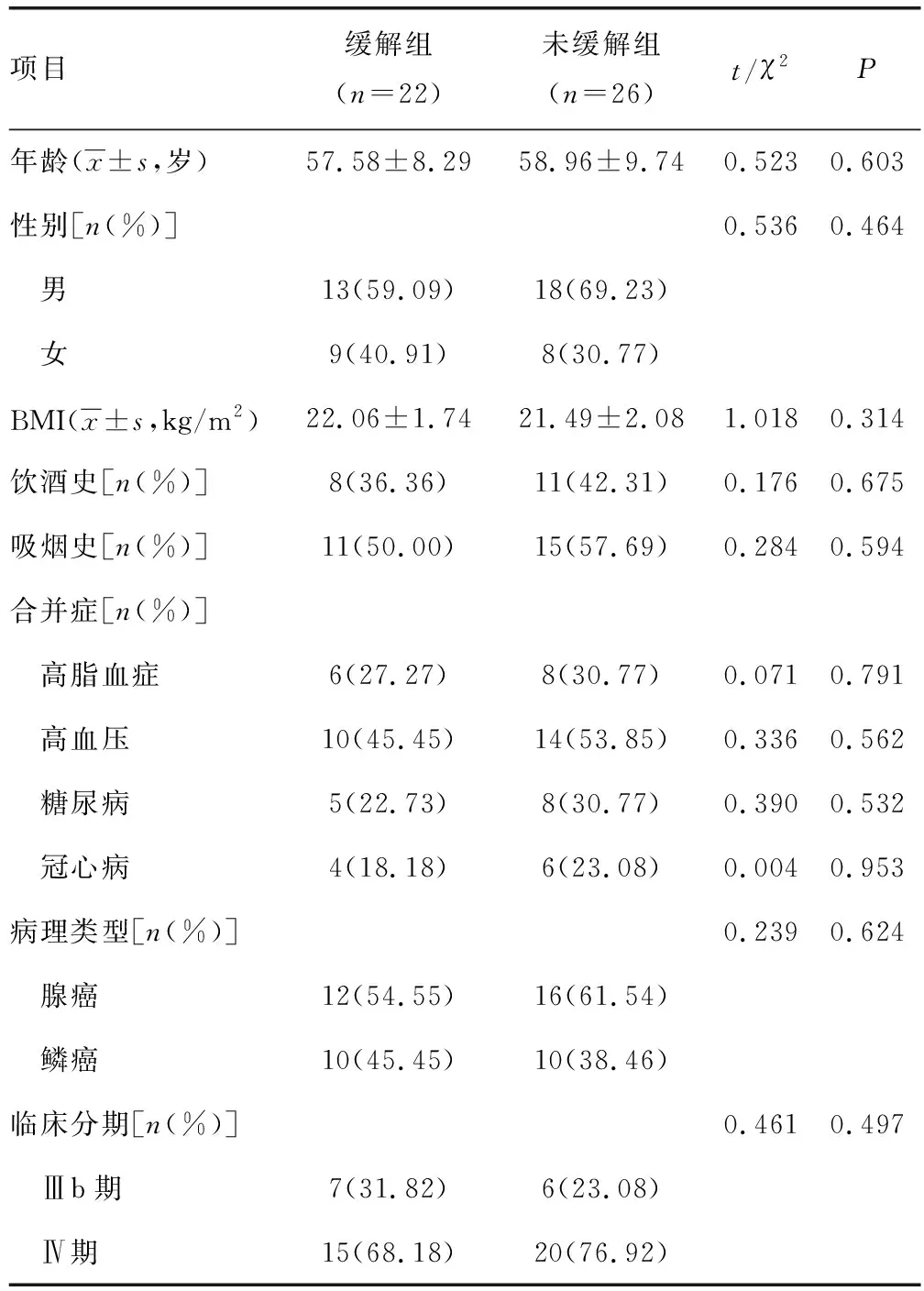
表1 两组一般资料比较
2.2两组外周血T淋巴细胞亚群及T细胞表面共抑制分子、肿瘤标志物水平比较 两组治疗前外周血CD3+、CD4+、CD8+、PD-1与血清CA125、CEA、CYFRA21-1水平相比,差异无统计学意义(P>0.05);两组治疗4个周期后外周血CD3+、CD4+水平均较本组治疗前提高,且缓解组高于未缓解组,外周血CD8+、PD-1、血清CA125、CEA、CYFRA21-1水平均较本组治疗前降低,且缓解组低于未缓解组,差异有统计学意义(P<0.05)。见表2。

表2 两组外周血T淋巴细胞亚群及T细胞表面共抑制分子、肿瘤标志物水平比较
2.3NSCLC患者外周血T淋巴细胞亚群及T细胞表面共抑制分子与肿瘤标志物相关性分析 NSCLC患者治疗4个周期后外周血CD3+、CD4+与血清CA125、CEA、CYFRA21-1水平呈负相关,外周血CD8+、PD-1与血清CA125、CEA、CYFRA21-1水平呈正相关(P<0.05)。见表3。
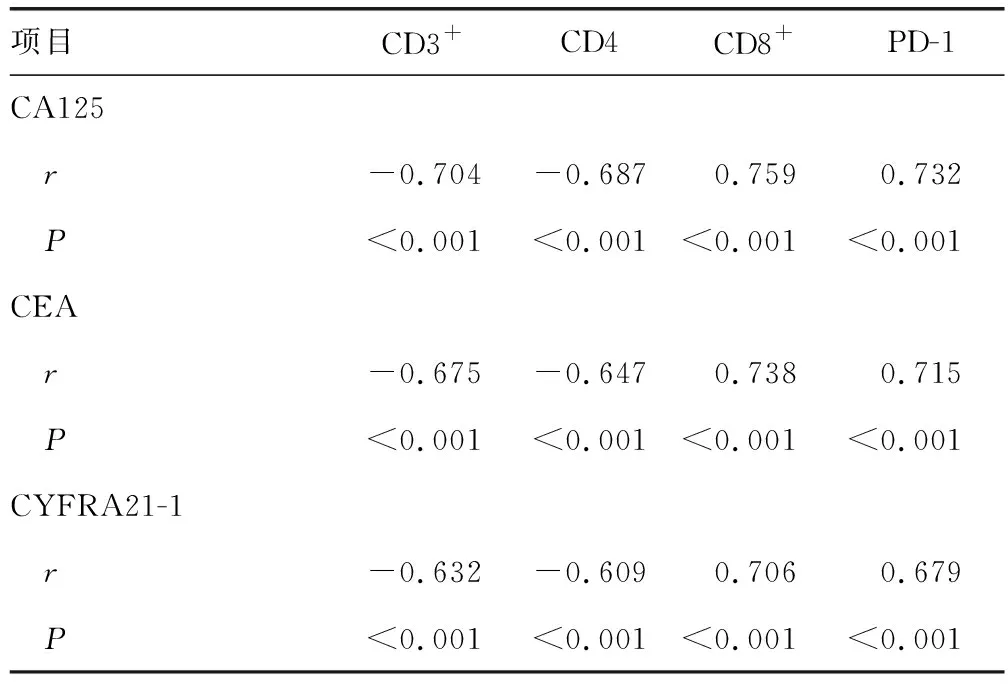
表3 NSCLC患者外周血T淋巴细胞亚群及T细胞表面共抑制分子与肿瘤标志物关系
2.4NSCLC患者疗效影响因素分析 NSCLC患者外周血CD3+、CD4+、CD8+、PD-1、血清CA125、CEA、CYFRA21-1水平以平均值为界,各指标小于或等于平均值赋值1,大于平均值赋值2,纳入Logistic回归分析,NSCLC患者治疗4个周期后外周血CD3+、CD4+、CD8+、PD-1与血清CA125、CEA、CYFRA21-1均与NSCLC患者疗效密切相关(P<0.05)。见表4。
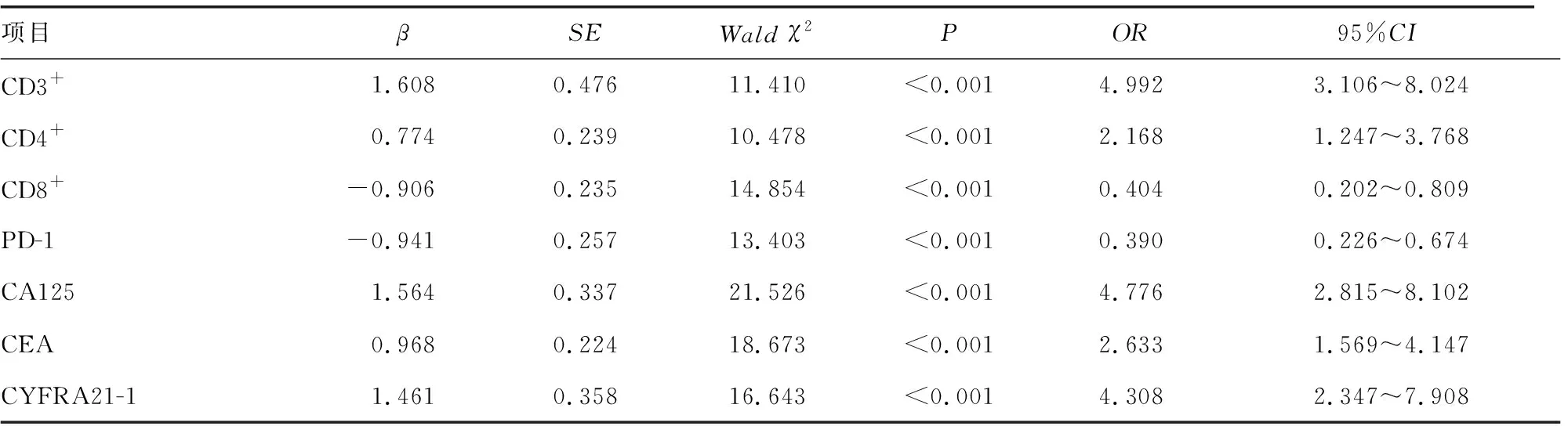
表4 NSCLC患者疗效影响因素分析
2.5外周血T淋巴细胞亚群及T细胞表面共抑制分子对NSCLC患者疗效的预测价值 NSCLC患者中以缓解组作为阴性样本,未缓解组作为阳性样本,ROC曲线分析结果发现,治疗4个周期后外周血CD3+、CD4+、CD8+、PD-1单独预测未缓解的AUC分别为0.780、0.670、0.837、0.862,对各单独指标采取二元拟合回归,建立Logistic预测评估模型,获取联合检测预测未缓解的AUC为0.938,预测灵敏度为80.00%,特异度为90.91%。见表5、图1。
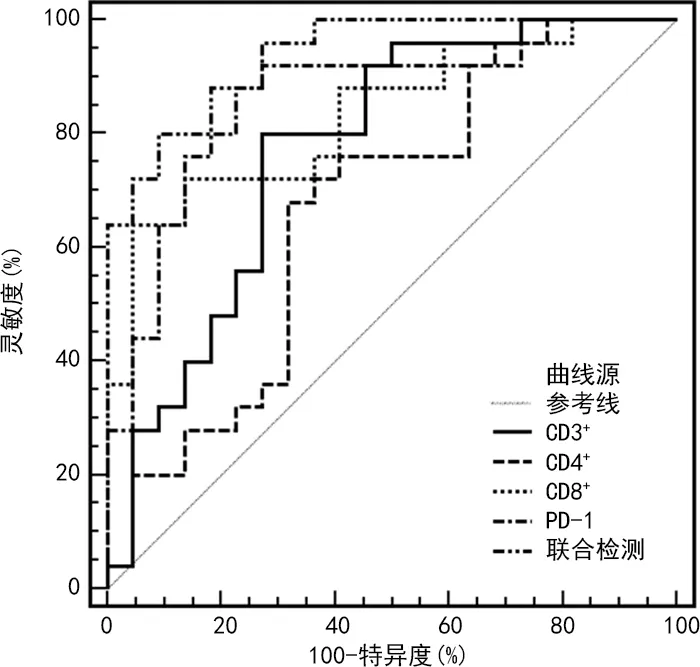
图1 ROC曲线分析

表5 外周血T淋巴细胞亚群及T细胞表面共抑制分子对NSCLC疗效的预测价值
3 讨 论
目前,肺癌治疗已进入免疫治疗时代,PD-1/PD-L1抑制剂为恶性肿瘤治疗提供了新方向,可与机体中PD-1受体结合,阻止其与PD-L1、PD-L2相结合,解除PD-1通路所介导的免疫抑制效应,提升自身T细胞对肿瘤细胞监视作用,阻止肿瘤生长、侵袭,并促进其衰亡,抑制癌症进展[7-8]。但并非所有患者均可通过免疫治疗获益,准确筛查出可由免疫治疗获益的患者,才能达成更为精准个体化免疫治疗。故寻找有关免疫治疗疗效预测标志物已成为临床关注重点课题。
PD-1/PD-L1抑制剂为免疫治疗方法,若其生效,则机体有关免疫细胞及相关分子水平理论上应有所变化。有关研究指出,T细胞介导细胞免疫为机体抗肿瘤重要方式,通过测定外周血T淋巴细胞亚群水平可准确、迅速地检测机体免疫状况[9-10]。CD3+、CD4+、CD8+均为T淋巴细胞亚群指标,其中CD3+可反映细胞免疫整体水平;CD4+T细胞为辅助性T细胞,可协助机体的抗肿瘤免疫反应;CD8+T细胞为抑制性T细胞,可抑制B细胞产生抗体,减弱T细胞免疫功能[11-12]。赵美淇等[13]研究指出,肿瘤细胞微环境内存在许多可阻止CD3+、CD4+细胞成熟及分化的免疫抑制因子,且CD8+细胞比例增高,CD4+/CD8+值下降,导致机体进入至免疫抑制状态,免疫功能产生紊乱,肿瘤细胞难以被正常清除,致使肿瘤细胞增殖,患者病情恶化。吴红波等[14]研究报道,肺癌化疗前T淋巴细胞亚群水平与肿瘤分期、分化程度密切相关,低分化、Ⅲ~Ⅳ期患者CD4+/CD8+水平显著低于高中分化、Ⅰ~Ⅱ期患者。本研究结果显示,NSCLC患者治疗4个周期后外周血CD3+、CD4+与血清CA125、CEA、CYFRA21-1水平呈负相关,外周血CD8+、PD-1与血清CA125、CEA、CYFRA21-1水平呈正相关(P<0.05)。CA125、CEA、CYFRA21-1为临床常用肿瘤标志物,在健康人群中表达水平降低,一旦出现癌变其水平可显著增高,与肿瘤恶性程度密切相关[15-17]。上述研究提示NSCLC患者T淋巴细胞亚群水平可能与肿瘤恶性程度密切相关。分析原因与肿瘤恶性程度越高,产生免疫抑制因子越多有关。本研究结果还显示,NSCLC患者治疗4个周期后外周血CD3+、CD4+、CD8+、PD-1与血清CA125、CEA、CYFRA21-1均与NSCLC患者疗效密切相关(P<0.05),提示NSCLC患者T淋巴细胞亚群水平与PD-1/PD-L1抑制剂联合化疗治疗效果有关。这可能归因于PD-1/PD-L1抑制剂联合化疗可降低肿瘤负荷,减少由于肿瘤分泌的免疫抑制因子,减轻免疫抑制。本研究结果显示,联合检测预测未缓解的AUC为0.938,预测灵敏度为80.00%,特异度为90.91%。T淋巴细胞亚群可为PD-1/PD-L1抑制剂联合化疗治疗NSCLC疗效的预测提供可靠依据,有利于临床精准个体化免疫治疗。
PD-1处于活化的T细胞表面,可与肿瘤细胞表面PD-L1相结合,促使PD-1/PD-L1信号通路激活,介导肿瘤特异性T细胞衰亡,肿瘤局部生成免疫抑制微环境[18]。有研究报道,在肿瘤微环境中T细胞表面共抑制分子PD-1等水平可致使杀伤肿瘤细胞功能降低,T细胞免疫监视作用减弱,引起肿瘤免疫逃逸[19]。高锋等[20]研究指出,PD-1表达与NSCLC患者病情进展及预后生存期具有密切关系。PD-1/PD-L1抑制剂联合化疗可抑制PD-1表达,减少T细胞衰亡,改善机体免疫功能,抑制肿瘤细胞生长并促使其凋亡。
综上所述,采用PD-1/PD-L1抑制剂联合化疗治疗NSCLC后外周血T淋巴细胞亚群及T细胞表面共抑制分子表达水平可出现显著变化,且其表达与肿瘤恶性程度有关,两者联合检测可作为预测疗效的有力参考。
