血管生成素样蛋白2、3、8与急性缺血性脑卒中患者颈动脉粥样硬化及预后的关系
2023-08-28袁静文唐思治
袁静文,彭 晓,刘 琳,唐思治,贺 燕
株洲市中心医院神经内科,湖南株洲 412000
急性缺血性脑卒中(AIS)在脑血管意外疾病中发病率较高,占脑卒中总数的60%~70%,是世界范围内发病率和致残率较高的疾病之一,因此,对AIS的防治面临着巨大挑战[1]。研究显示,颈动脉粥样硬化(CAS)是AIS的病理基础,约1/3 AIS的发生与CAS斑块破裂有关[2]。另有研究证实,血脂代谢紊乱是导致AIS的独立危险因素[3]。CAS及血脂紊乱均与AIS发生有关,因此采用血清标志物评估血管的粥样硬化风险有助于AIS的临床防治。血管生成素样蛋白(ANGPTL)是一类具有血管生成素(Ang)相似结构的分泌型糖蛋白,在糖脂代谢紊乱、慢性炎症及CAS生成中起重要调控作用[4]。临床研究显示[5],超重及肥胖男性完成12周饮食调整计划后,血清ANGPTL2水平及动脉僵硬度指标均明显下调,且二者呈正相关。另有研究显示[6],在调整年龄、血脂参数等传统风险因素及降脂药治疗后,ANGPTL3仍是冠状动脉硬化性心脏病(CHD)的独立预测因子。此外也有研究提示[7],冠状动脉疾病患者外周血中ANGPTL8水平升高,且与其体重指数(BMI)、血脂及内皮功能障碍指标有关。上述研究均说明ANGPTL2、3、8与机体脂质代谢及CAS形成密切相关,推测三者可能参与AIS的发生和发展。鉴于此,本研究分析ANGPTL2、3、8在AIS患者及不同程度CAS患者中的表达水平,并探讨三者与AIS短期预后的关系,为AIS的早期防治提供参考。
1 资料与方法
1.1一般资料 选取2020年3月至2021年3月株洲市中心医院收治的157例AIS患者(AIS组),另选取同期50例非AIS,且超声检测证实颈动脉狭窄或有斑块形成的CAS患者(CAS组),纳入标准:(1)AIS组患者符合《中国急性缺血性脑卒中诊治指南2018》[8]中AIS的诊断标准:①急性起病;②局灶性神经功能缺损(单侧肢体麻木、面部麻木或口眼歪斜、语言或意识不清等);③颅脑影像学(CT/MRI/CTA/DSA等)检查明确梗死灶,排除脑出血;④实验室检查排除类卒中或其他病因(血小板及凝血指标、血糖、肝肾功能、电解质、心电图及心肌缺血标志物、氧饱和度等);(2)CAS组患者符合《颈部动脉超声多普勒实用手册》[9]中CAS的诊断标准;(3)年龄>18岁;(4)首次发病,AIS组发病至就诊时间<6 h,CAS组患者病程2周以上;(5)入院美国国立卫生研究院卒中量表(NIHSS)评分4~25分;(6)患者或家属签订知情同意书。排除标准:(1)合并出血性脑卒中或其他颅脑疾病者;(2)颅脑影像学提示梗死面积超过1/3脑中动脉供血区的大面积脑梗死者;(3)合并血液系统疾病者;(4)近期有感染性疾病史、手术史者;(5)近期接受抗凝药物治疗者;(6)合并严重心、肝、肾功能低下者。选取同期医院体检中心50例体检健康者(对照组)。AIS组中,男100例,女57例;年龄45~78岁,平均(65.10±8.15)岁;BMI 19.2~26.5 kg/m2,平均(22.60±1.83)kg/m2;吸烟史55例,饮酒史65例,合并高血压94例,合并糖尿病33例;发病至就诊时间<6 h,平均(2.39±1.10)h。CAS组中,男34例,女16例;年龄49~80岁,平均(64.95±10.11)岁;BMI 20.1~26.7 kg/m2,平均(22.23±1.85)kg/m2;吸烟史19例,饮酒史21例。对照组中,男36例,女14例;年龄50~81岁,平均(63.57±9.28)岁;BMI 19.8~26.1 kg/m2,平均(22.15±1.75)kg/m2;吸烟史16例,饮酒史19例。AIS组、CAS组及对照组的性别、年龄、BMI、吸烟史、饮酒史比较差异无统计学意义(P>0.05),具有可比性。本研究已通过株洲市中心医院医学伦理委员会审批(编号:ZZLLCB-2020023)。
1.2方法
1.2.1血清ANGPTL2、3、8水平的检测 入院后经影像学检查证实且未经过溶栓治疗AIS组、CAS组患者及对照组体检时抽取空腹静脉血8 mL,静置分层后,3 000 r/min离心10 min(半径12 cm),取上清液,采用酶联免疫吸附试验(ELISA)检测血清ANGPTL2、3、8水平,ANGPTL2、3 ELISA试剂盒购自武汉菲恩生物科技有限公司(货号:Q9UKU9、EH0598);ANGPTL8 ELISA试剂盒购自武汉艾美捷科技有限公司(货号:abx171228),按照试剂盒说明书于570 nm波长处测量吸光度值,根据标准曲线计算待测样中ANGPTL2、3、8水平。
1.2.2颈动脉超声检查 患者入院后经影像学检查证实且未经过溶栓治疗时进行超声测量颈动脉内膜中层厚度(IMT),应用彩色多普勒超声诊断仪(美国GE,型号E10,探头频率6~10 MHz),检测颈总动脉、分叉处及颈内动脉血管的纵切面,测量血管后壁内膜与外膜间“双线征”的距离,即为IMT,测量3次取均值。根据IMT进行分组:IMT在1.0 mm~<1.2 mm之间定义为IMT增厚,患者纳入IMT增厚组;1.2 mm≤IMT≤1.4 mm,局部隆起向管腔突出,但未造成管腔明显狭窄,定义为动脉斑块形成,患者纳入斑块形成组;IMT>1.4 mm者纳入动脉狭窄组[9]。
1.2.3基线资料收集 收集AIS患者的基线资料,包括性别、年龄、BMI(体重/身高2)、吸烟史、饮酒史、合并症(高血压、糖尿病)、脑梗死部位、梗死体积(根据颅脑MRI/CT图像获得)、入院NIHSS评分、发病至就诊时间;记录入院后经影像学检查证实且未经过溶栓治疗时的实验室指标,包括低密度脂蛋白-胆固醇(LDL-C),高密度脂蛋白-胆固醇(HDL-C),总胆固醇(TC)、三酰甘油(TG)、空腹血糖(FPG)、血小板计数(PLT)、白细胞计数(WBC)、血肌酐(Scr)。真空抗凝管采集外周静脉血2 mL,采用全自动血细胞分析仪及配套试剂(日本光电工业株式会社,型号:MEK-6400C)检测PLT、WBC;采集空腹静脉血10 mL,离心(转速3 000 r/min,离心半径12 cm,时间12 min)取血清,采用全自动生化分析仪(日本日立公司,型号:7600)检测LDL-C、HDL-C、TC、TG、FPG、Scr水平,LDL-C、HDL-C试剂盒购自日本协和株式会社(货号:598ADD、391ADE),TC、TG试剂盒购自瑞士罗氏诊断公司(货号:600265、603328),FPG、Scr试剂盒购自上海抚生实业有限公司(货号:FS14083、FS10726)。
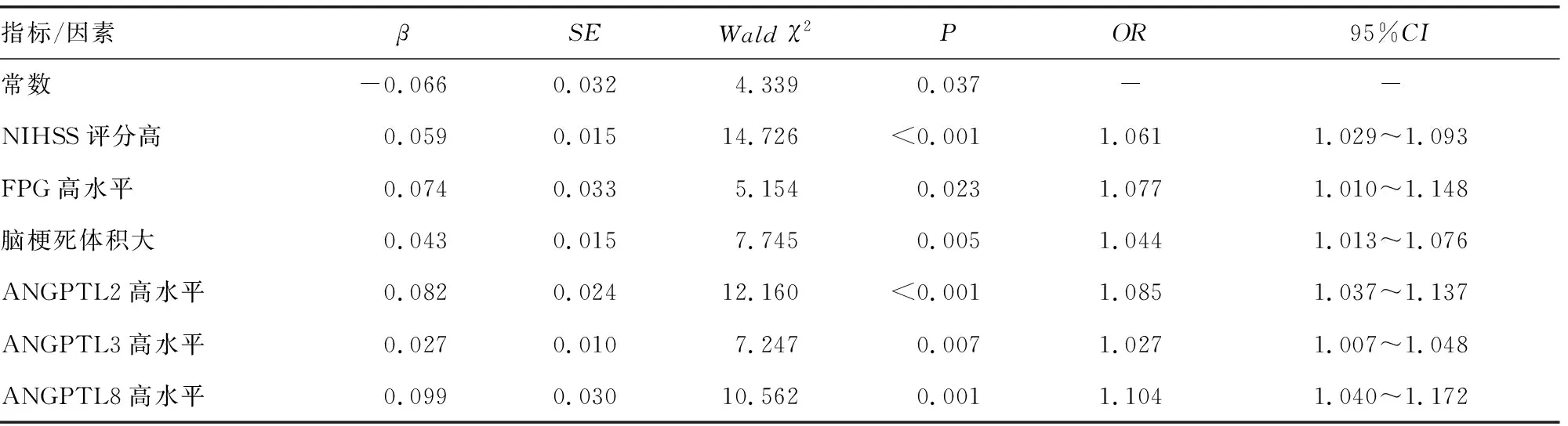
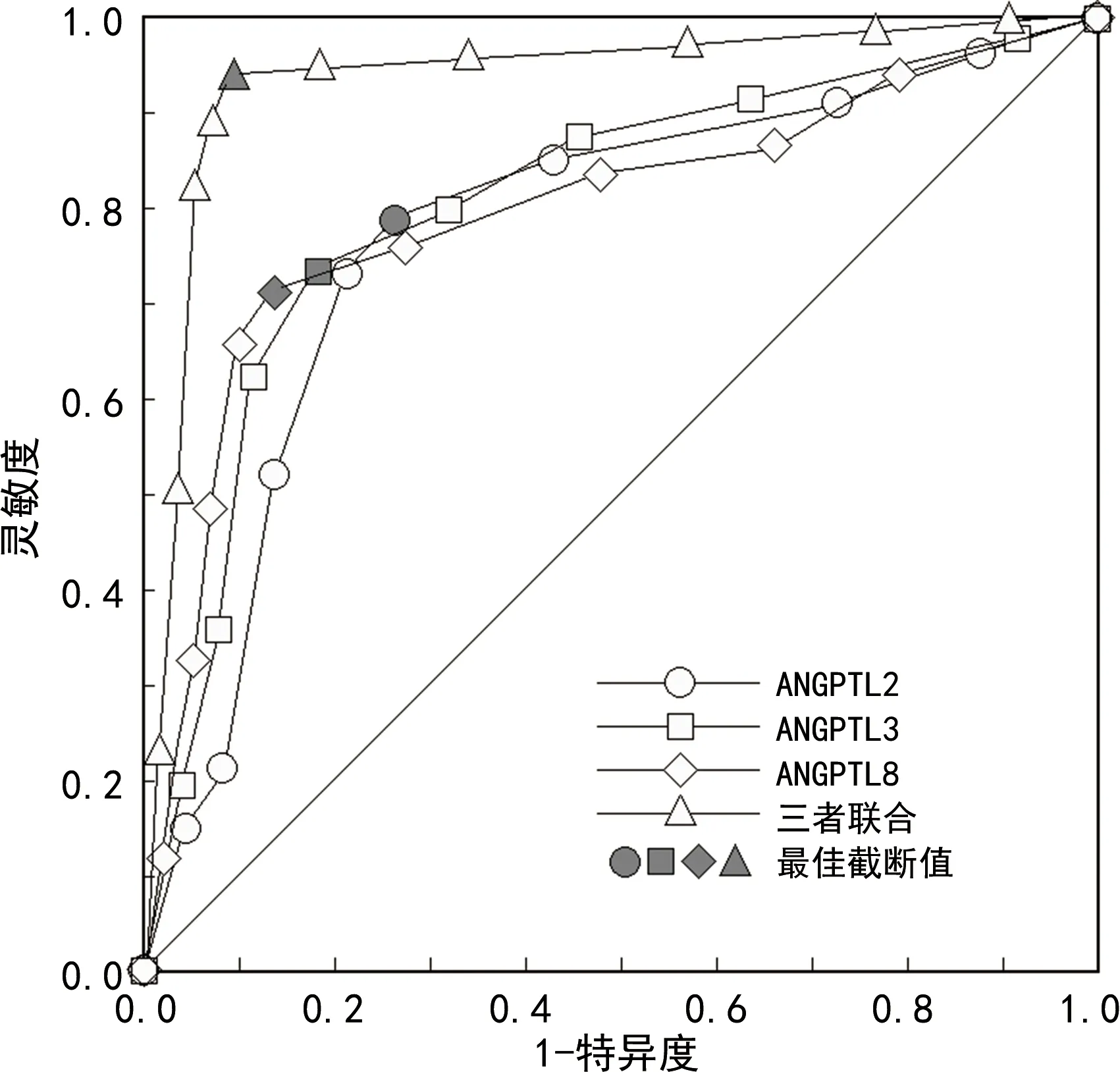
1.2.4治疗、随访及分组 入院完善常规检查,排除静脉溶栓禁忌证者,即刻进行静脉溶栓治疗,并依据指南[8]推荐方案统一纳入临床路径,包括抗血小板聚集、他汀类药物调脂、改善微循环、营养神经等,若合并高血压或糖尿病并发症则予以对症治疗。采用电话或门诊复查随访3个月,根据改良Rankin量表(mRS)[10]评分分为预后良好组(0 2.1AIS组、CAS组与对照组血清ANGPTL2、3、8水平比较 AIS组血清ANGPTL2、3、8水平均高于对照组和CAS组,且CAS组高于对照组(P<0.05)。见表1。 表1 AIS组、CAS组与对照组血清ANGPTL2、3、8水平比较 2.2不同颈动脉粥样硬化程度的AIS患者血清ANGPTL2、3、8水平比较 AIS患者中IMT增厚24例(15.29%)、斑块形成96例(61.15%)、动脉狭窄37例(23.57%)。动脉狭窄组血清ANGPTL2、3、8水平高于斑块形成组和IMT增厚组,且斑块形成组高于IMT增厚组(P<0.05)。见表2。 表2 不同颈动脉粥样硬化程度的AIS患者血清ANGPTL2、3、8水平比较 2.3不同短期预后AIS患者基线资料及血清ANGPTL2、3、8水平比较 随访3个月,AIS患者短期预后不良发生率为39.49%(62/157),预后不良组年龄、脑梗死体积、入院NIHSS评分、LDL-C、TC、FPG、Scr、ANGPTL2、3、8水平及合并糖尿病患者占比均高于预后良好组(P<0.05),两组在性别、BMI、吸烟史、饮酒史、合并高血压、脑梗死部位、发病至就诊时间、HDL-C、TG、PLT、WBC水平方面比较差异无统计学意义(P>0.05)。见表3。 表3 预后不良组与预后良好组基线资料及血清ANGPTL2、3、8水平比较或n(%)或M(P25,P75)] 2.4多因素Logistic回归分析AIS患者短期预后的影响因素 以不同短期预后患者存在差异的因素为自变量纳入多因素Logistic回归分析模型,将有无合并糖尿病赋值为“合并”=1、“未合并”=0,年龄、脑梗死体积、入院NIHSS评分、LDL-C、TC、FPG、Scr、ANGPTL2、3、8赋值为连续变量,为原值输入,以AIS患者随访3个月内有无发生预后不良作为因变量,“发生”=1、“未发生”=0。多因素Logistic回归分析显示,入院时NIHSS评分高、FPG高、脑梗死体积较大、ANGPTL2、3、8高水平均是导致AIS短期预后不良的危险因素(P<0.05)。见表4。 表4 多因素Logistic回归分析AIS患者短期预后的影响因素 2.5血清ANGPTL2、3、8对AIS短期预后不良的预测价值 血清ANGPTL2、3、8及三者联合预测AIS短期预后不良的曲线下面积(AUC)分别为0.766(95%CI:0.692~0.830)、0.786(95%CI:0.714~0.848)、0.788(95%CI:0.715~0.849)、0.949(95%CI:0.902~0.978),三者联合预测效能高于各单项检测(Z=5.194、4.220、4.158,P<0.05)。见表5、图1。 图1 血清ANGPTL2、3、8对AIS预测短期预后不良的ROC曲线 表5 血清ANGPTL2、3、8对AIS短期预后不良的预测价值 研究证实,多数AIS患者存在单侧或双侧CAS病变,当CAS斑块发展至一定程度则出现破裂、出血、急性栓塞,从而引发AIS[11]。CAS进程缓慢,其斑块形成机制尚不明确,有研究认为其可能与脂代谢紊乱、慢性炎症等有关[12]。因此,寻找反映CAS进程的可靠血清标志物对AIS的早期防治十分必要。ANGPTL是新近发现的一种分泌型糖蛋白,具有与Ang相似结构域,但不能与酪氨酸受体Tie1/2结合,表现出更多样的功能,对脂代谢、慢性炎症、CAS形成等具有多种效应[13]。ANGPTL在N端含有高度疏水性的蛋白质分泌信号的典型区域,目前已知8个成员,ANGPTL1~7是ANGPTL家族典型成员,ANGPTL8缺乏部分结构域而属于非典型成员,但ANGPTL N端结构域与其他成员有20%的一致性,因而表现出相似功能。研究报道,ANGPTL家族中ANGPTL3、8均具有调节血管生成、调节脂蛋白代谢等作用[14];此外,有报道指出,ANGPTL8与糖尿病动脉粥样硬化(AS)有关[15];ANGPTL2可调节炎症因子基因表达,与诱导机体慢性炎症有关[16]。因此,笔者推测ANGPTL2、3、8可能与CAS发生发展机制密切相关,探讨三者在AIS中的水平及对短期预后转归的预测作用至关重要。 本研究发现,AIS组血清ANGPTL2、3、8水平均高于对照组和CAS组,且ANGPTL2、3、8水平随IMT厚度增加而增加,提示ANGPTL2、3、8在AIS中异常高表达,且与CAS程度密切相关。近年来研究显示,ANGPTL多个亚型与CAS密切相关,是心血管疾病治疗中最具潜力的靶点之一[17]。SUN等[18]研究显示,冠心病心绞痛患者循环血中ANGPTL3水平异常升高,其可作为CAS的预测指标。说明ANGPTL3可能直接作用于靶血管影响CAS形成,从而参与冠心病心绞痛发作。FUKAMI等[19]通过检测412例尿毒症血液透析患者外周血中的C反应蛋白、ANGPTL2发现,心踝血管指数与C反应蛋白无关,但与ANGPTL2呈正相关。说明ANGPTL2可能是动脉血管发生AS的标志物。CALAND等[20]研究发现,抑制ANGPTL2表达可通过诱导细胞凋亡机制清除衰老的血管内皮细胞,从而促进内皮修复,缓解小鼠AS形成。提示ANGPTL2参与AS形成的机制可能与调控血管内皮细胞功能有关。JIAO等[21]同样在ApoE-/-诱导的实验性AS小鼠模型中发现,ANGPTL8过表达可促进AS发展,反之ANGPTL8低表达能够抑制AS发展。提示在促进AS形成过程中,ANGPTL8与ANGPTL2具有相似的作用。推测ANGPTL2、3、8可能通过促进CAS的形成促进AIS的发生。本研究结果也显示,ANGPTL2、3、8与CAS形成中IMT厚度增加有关,结合上述研究结果可知,三者可能通过影响血管内皮细胞功能导致CAS及其不稳定斑块形成,参与AIS的发生,提示ANGPTL2、3、8可能成为CAS相关疾病治疗的有效靶点。 本研究采用Logistic回归分析法剔除了年龄、LDL-C、TC、Scr、糖尿病等因素后发现,入院时NIHSS评分高,FPG高水平,脑梗死体积大,ANGPTL2、3、8高水平是导致AIS短期预后不良的危险因素,提示血清ANGPTL2、3、8与AIS短期预后关系密切。NIHSS评分反映神经损伤程度,入院高NIHSS评分提示患者可能已经出现不可逆神经损伤,预后较差[22]。脑梗死体积也是短期预后不良的危险因素,分析原因为AIS后需溶栓促进血管再通,以限制梗死体积进一步扩大,若血管再通前已出现大面积出血,则对预后可能造成不可挽回的损伤[23]。AIS作为应激源刺激下丘脑-肾上腺轴分泌多量肾上腺素,使机体出现应激性高血糖[24]。高血糖状态导致患者预后不良的机制复杂,高血糖可能通过加速患者脂质过氧化反应加重神经细胞毒性,高血糖可介导炎症反应,加重内皮细胞损伤,增加血脑屏障损伤和脑卒中后出血转化风险,此外,颅脑广泛性微血管内皮损伤可引起血管源性水肿,增大梗死灶面积,多种机制共同作用导致预后不佳[25]。从上述研究及本研究结果可以推测ANGPTL2、3、8可能通过调控AIS后继发性炎症反应、脂质代谢、氧化应激损伤等过程影响短期预后,但具体作用机制尚需进一步研究证实。研究显示,ANGPTL2敲低后可抑制Toll样受体4/核因子κB通路保护肾小管上皮I/R损伤[26]。说明ANGPTL2水平升高可加重脑缺血再灌注损伤及血管内皮损伤状态,从而影响神经修复,导致预后不良。多项研究证实,ANGPTL3与血脂代谢有关[27-28]。XU等[29]分析发现,ANGPTL8可作为人类癌症预后转归的新型代谢调节剂,其机制涉及脂质稳态、葡萄糖稳态及炎症反应的调节。脂质稳态、葡萄糖稳态及炎症反应在AIS短期预后转归中同样具有重要作用,推测ANGPTL3、8可能通过上述途径影响AIS短期预后[15]。本研究进一步经ROC曲线分析发现,血清ANGPTL2、3、8单独及联合预测AIS短期预后不良的AUC分别为0.766、0.786、0.788、0.949,ANGPTL2、3、8联合预测效能高于单项检测,说明联合检测血清ANGPTL2、3、8对辅助预测AIS患者短期预后转归有一定参考价值。 综上所述,AIS患者入院时NIHSS评分高,FPG高水平,脑梗死体积大,血清ANGPTL2、3、8水平是影响出院后短期预后不良的独立危险因素,且血清ANGPTL2、3、8水平与CAS程度密切相关,检测血清ANGPTL2、3、8对预测AIS患者短期预后转归有一定价值。本研究由于随访时间的限制,未分析ANGPTL2、3、8对AIS远期预后的影响,且样本量较小,在接下来的研究中会增加样本量,延长随访时间,以观察这3项指标对AIS患者远期预后的影响,为AIS临床防治提供参考。
2 结 果
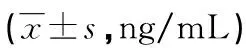
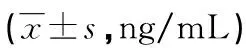
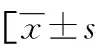

3 讨 论
