鼠尾草酸、α-倒捻子素联合不同作用机制抗生素的抗金黄色葡萄球菌作用研究
2023-08-25官莹莹李诗敏袁干军易厚琴张同科
官莹莹?李诗敏?袁干军?易厚琴?张同科

摘要:目的 探究植物源抗菌天然產物鼠尾草酸、α-倒捻子素分别与抗生素的联合应用效果,发现不同联合应用效果的抗菌组合物。方法 分别以敏感金黄色葡萄球菌ATCC25923、耐甲氧西林金黄色葡萄球菌MRSA 01为指示菌株,采用微量肉汤稀释法,测定鼠尾草酸、α-倒捻子素和不同作用机制抗生素对指示菌株的最低抑菌浓度;再采用棋盘格法,分别测定鼠尾草酸、α-倒捻子素与不同作用机制抗生素联用对测试菌株的部分抑菌浓度指数(fractional inhibitory concentration index,FICI)。结果 鼠尾草酸、α-倒捻子素联合硫酸庆大霉素对测试菌株的FICI范围分别为0.28~0.62、0.31~0.50,前者对两株测试菌株分别显示协同或无关作用,后者均显示协同作用;鼠尾草酸、α-倒捻子素分别与其他抗生素对测试菌株的FICI范围为0.52~1.12,均显示无关作用。结论 靶向细胞膜的鼠尾草酸、α-倒捻子素与作用于核糖体影响细胞膜的氨基糖苷类庆大霉素联用时,主要呈现协同的联合抗菌效果,进一步证实了课题组发现的联合用药效果的相关规律;组合物鼠尾草酸/硫酸庆大霉素对金黄色葡萄球菌的不同菌株既可显示协同,又可显示无关作用,为联合用药防细菌耐药的进一步研究打下了基础。
关键词:抗生素;联合用药;鼠尾草酸;α-倒捻子素;金黄色葡萄球菌
中图分类号:R978文献标志码:A
Antibacterial effects of carnosic acid or α-mangostin combined with various antibiotics with different mechanisms to Staphylococcus aureus
Guan Ying-ying1,2, Li Shi-min1, Yuan Gan-jun1,2, Yi Hou-qin1 and Zhang Tong-ke1
(1 Biotechnological Engineering Center for Pharmaceutical Research and Development, Jiangxi Agricultural University,
Nanchang 330045; 2 College of Bioscience and Engineering, Jiangxi Agricultural University, Nanchang 330045)
Abstract Objective To explore the combinational effects of carnosic acid and α-mangostin, originated from plant antimicrobial natural products, respectively combined with antibiotics, and to discover drug combinations with different combinational effects. Methods The minimum inhibitory concentration (MIC) of carnosic acid, α-mangostin, and antibiotics with various action mechanisms to Staphylococcus aureus ATCC25923 and methicillin-resistant S. aureus (MRSA) MRSA 01, used as indicator strains, were determined using broth microdilution method. Then, the fractional inhibitory concentration indices (FICIs) of carnosic acid or α-mangostin in combination with antibiotics with various action mechanisms were tested using checkerboard method. Results The FICIs of carnosic acid or α-mangostin in combination with gentamycin sulfate against tested strains respectively ranged from 0.28 to 0.62, and from 0.31 to 0.50. The former shows synergistic or independent effects, and the latter shows synergistic effects. Those of carnosic acid or α-mangostin in combination with other antibiotics ranged from 0.516 to 1.125, and all showed indifferent effects. Conclusion Cell membrane-targeted carnosic acid and α-mangostin in combination with gentamycin sulfate, an aminoglycoside antibiotic acting on the ribosome and affecting the cell membrane, mainly showed synergistic effects, and which further confirmed the relevant law of drug combinational effect discovered by our research group. Another, the combinations of carnosic acid and gentamicin sulfate, showing synergistic or indifferent effects on different strains of S. aureus, provide a solid foundation for further research on drug combinations to prevent bacterial resistance.
Key words Antibiotics; Drug combination; Carnosic acid; α-Mangostin; Staphylococcus aureus
近年來,多重耐药菌对各种结构类型的临床抗生素相继耐药,成为超级耐药菌,严重威胁着人类公共健康和全球经济增长,有效防细菌耐药的策略研究和临床实践迫在眉睫[1-3]。应对细菌耐药的策略和措施涉及面广且复杂[2,4-7],其中合理地联合用药不仅可有效提高抗菌药物的临床疗效,充分利用现有的抗菌药物资源减少细菌耐药几率,为研究新的抗生素赢得时间和空间[6,8-10]。
随着联合用药研究的深入,植物来源天然产物与抗生素联合应用的报道不断增加,结果显示其中某些天然产物与抗生素联合用药不仅可协同增效,有的还可逆转抗生素的抗药性、增加抗生素的敏感性[11-12],如表没食子儿茶素没食子酸酯(EGCG)等化合物[11]。本课题组在抗菌天然产物的研究实践中发现迷迭香所含的鼠尾草酸具有良好的抗耐药金黄色葡萄球菌作用,且与苯唑西林钠等β-内酰胺类抗生素联用时可产生相加或协同效果[13];同时,在植物源抗菌药物先导化合物发现的过程中注意到从山竹中分离得到的α-倒捻子素具有很强的抗金黄色葡萄球菌活性[14]。
本课题组前期发现联合用药的效果与两抗菌药物的作用机制密切相关[15],即作用于同一代谢途径不同代谢位点的抗菌药物联合应用,产生协同抗菌效果的概率较大,而非传统认为不同作用机制抗菌药物联合产生协同的可能性较大。这一发现随后得到Brochado等[16]国际学者从不同角度系统深入研究的证实。但研究中均为选用临床抗生素得出的结论,而并未考察植物天然抗菌化合物与临床抗生素的联合应用情况。因此,本文拟对植物天然抗菌产物鼠尾草酸、α-倒捻子素分别与不同作用机制的抗生素联合应用的抗金黄色葡萄球菌效果进行研究,以进一步从更广的角度证明课题组发现的联合用药效果规律的科学性和合理性,并由此期望获得合适的植物抗菌天然产物与临床抗生素的药物组合,为课题组发现的联合用药规律的进一步验证完善打下基础。
1 仪器与材料
1.1 仪器
精密电子分析天平(赛多利斯科学仪器有限公司);净化工作台(无锡易纯净化设备有限公司);96孔细胞培养板(上海依科赛生物制品有限公司);超纯水机(石家庄泰斯特仪器设备有限公司);恒温摇床(金坛市亿能实验仪器厂);生化培养箱(上海智城分析仪器制造有限公司);紫外可见分光光度计(上海佑科仪器仪表有限公司);超声波清洗机(深圳市洁康洗净电器有限公司);移液枪(大龙兴创实验仪器(北京)有限公司)。
1.2 材料
药品及试剂:鼠尾草酸(纯度99.2%):粗品(纯度70%)由海南舒普生物科技有限公司友情赠送,并经课题组参考文献方法纯化制备[13];α-倒捻子素(成都普思生物科技股份有限公司,纯度>98%);硫酸庆大霉素(上海源叶生物科技有限公司,USP级,590 u/mg);多西环素(USP级,纯度>88%~94%)和罗红霉素(USP级,>940 u/mg)(生工生物工程(上海)股份有限公司);阿扎霉素F由实验室分离制备,纯度98.2%,已广泛用于相关试实验研究;分析纯二甲基亚砜(西陇科学股份有限公司),水为超纯水。
培养基:称取酸水解酪蛋白17.5 g,可溶性淀粉1.5 g,牛肉浸膏3 g,1000 mL超纯水,用1 mol/L NaOH调节pH至7.2~7.4,分装至50 mL锥形瓶中,121℃高压灭菌20 min,得MHB培养基,置于超净工作台中冷却备用。上述MHB培养基的配制过程中添加17.0 g琼脂粉,同样操作灭菌后倒平板,即得MHA培养基。
指示菌株:金黄色葡萄球菌ATCC 25923源于美国典型培养物保藏中心;耐甲氧西林金黄色葡萄球菌MRSA 01由中山大学附属第二医院提供,已广泛用于本课题组的抗菌活性研究[13,15,17]。
2 方法
2.1 菌悬液的制备
将保存于斜面的菌株用MHA平板活化,从平板中用接种针沾取菌种,接种于20 mL MHB液体培养基中,置160 r/min的摇床上,37℃培养5~7 h,用MHB培养基稀释,得浓度为1×106 CFU/mL的菌悬液,用于测定试药的最低抑菌浓度及联合抗菌效果,菌悬液制备30 min后不可使用。
2.2 供试药液的配制
称取硫酸庆大霉素适量,分别用无菌MHB培养基配制成浓度为512 μg/mL的供试药液;称取多西环素、罗红霉素、鼠尾草酸、阿扎霉素F和α-倒捻子素适量,先用适量二甲基亚砜(DMSO)溶解,再分别用无菌MHB培养基倍半稀释制得512 μg/mL的供试药液(DMSO浓度低于5%);另外,用无菌MHB培养基配制浓度为5%的DMSO溶液,作为溶剂对照。
2.3 最低抑菌浓度(MIC)的测定
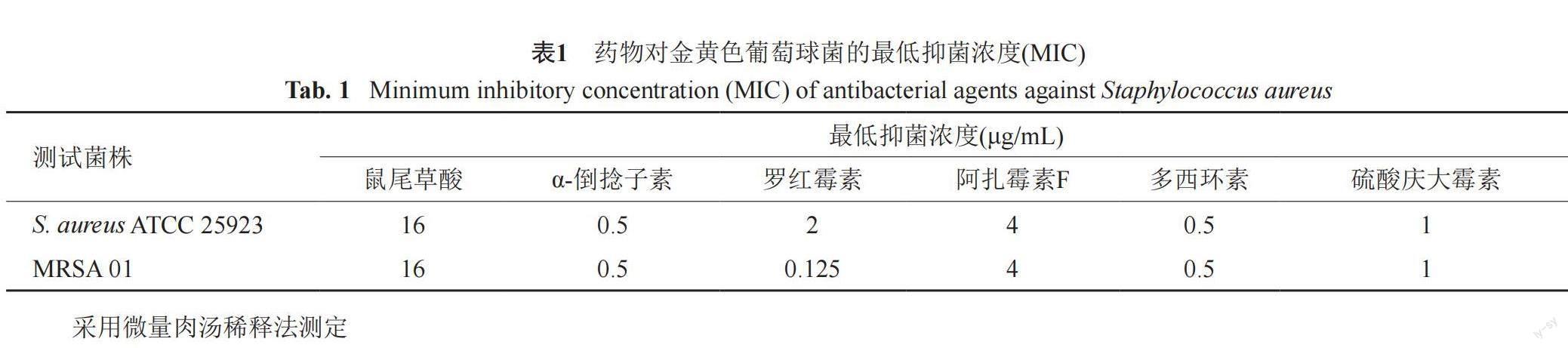
参考文献方法[15,17],设置不同药物实验组、溶剂对照组和空白对照组,采用微量肉汤稀释法进行实验。主要过程如下:在96孔板上,采用倍半稀释法,用无菌MHB培养基制得系列浓度为256、128、64、32、16、8、4、2、1、0.5、0.25和0.125 μg/mL的药液100 μL;空白对照组的每孔入100 μL无菌MHB培养基。最后,往所有操作孔中加入100 μL菌悬液(1×106 CFU/mL),盖紧96孔板,35℃恒温培养24 h后,观察结果,无肉眼可见细菌生长的最低药物浓度即为该药对测试菌株的MIC。
2.4 联合抗菌作用的测定
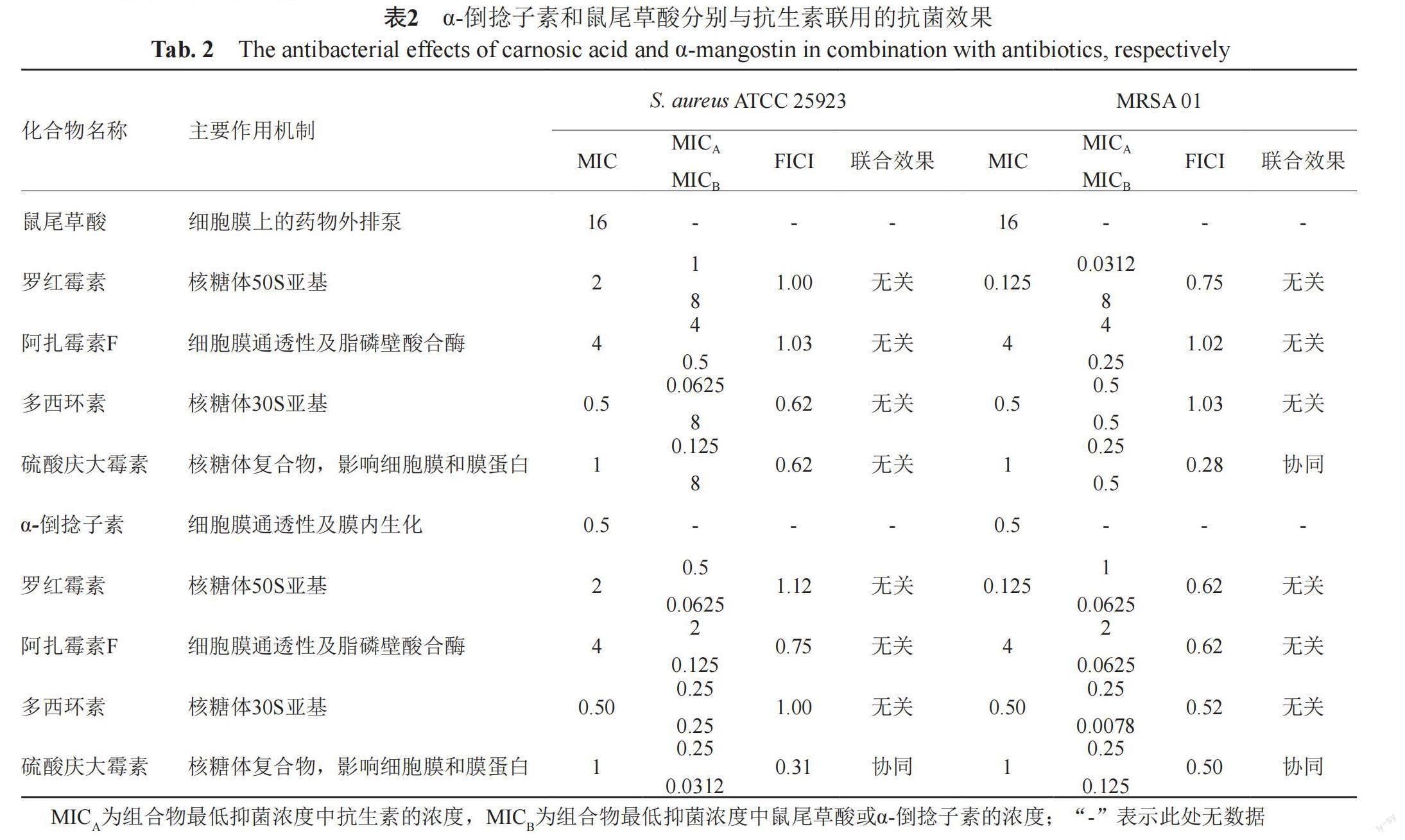
参考文献[15,17],运用棋盘格法设计试验,采用微量肉汤稀释法,测定鼠尾草酸、α-倒捻子素分别联合罗红霉素、多西环素、阿扎霉素F、硫酸庆大霉素的抗金黄色葡萄球菌效果。以鼠尾草酸与罗红霉素的联合抗菌测定为例,具体过程如下:采用倍半稀释法,根据各药物对特定金黄色葡萄球菌菌株的MIC,分别配制浓度范围为4 MIC~1/16 MIC的各测试药物溶液;然后在96孔细菌培养板上,除A行和1列的孔中分别单独加入设计浓度的鼠尾草酸和罗红霉素溶液各50 μL外,其余各孔分别加入设计浓度的鼠尾草酸和罗红霉素溶液各50 μL;然后除A行和1列的孔中加入50 μL外,其余各孔均加入100 μL稀释的指示菌菌悬液(1×106 CFU/mL),盖紧96孔板,35℃恒温培养24 h后,观察结果。无肉眼可见细菌生长的最低药物浓度即为两药对测试菌株的联合MIC,联合用药的部分抑菌浓度指数(FICI)的计算公式为:
其中,MICA联合和MICB联合为A和B联用时最低抑菌浓度中A和B的浓度;MICA单独和MICB单独即为A和B单用时各自的最低抑菌濃度;A为罗红霉素、多西环素、阿扎霉素F或硫酸庆大霉素,B为鼠尾草酸或α-倒捻子素。判断联用效果的标准为:FICI≤0.5,协同作用;0.5<FICI≤4,无关作用;FICI>4,拮抗作用。
3 结果
3.1 最低抑菌浓度(MIC)
各测试药物的MIC结果见表1,鼠尾草酸和α-倒捻子素对敏感和耐药金黄色葡萄球菌S. aureus ATCC 25923和MRSA 01均表现出较强的抗菌活性,尤其是α-倒捻子素的抑菌活性更为显著,其对敏感和耐药金黄色葡萄球菌的MIC均为0.5 μg/mL。
3.2 联合抗菌作用
运用棋盘格法设计试验,采用微量肉汤稀释法,在96孔细菌培养板上测定鼠尾草酸、α-倒捻子素分别联合罗红霉素、多西环素、阿扎霉素F、硫酸庆大霉素的抗金黄色葡萄球菌作用,结果见表2。由表可知:在测试的药物联合中硫酸庆大霉素仅与α-倒捻子素或鼠尾草酸有协同增效的效果,而且硫酸庆大霉素与鼠尾草酸只对耐药金黄色葡萄球菌具有协调增效的作用,对敏感菌S. aureus ATCC25923呈现无关的作用(FICI为0.62),其余药物的联合用药均表现为无关作用(0.62≤FICI≤1.25)。
4 讨论
随着抗菌药物抗药性形势的日益严峻,植物来源的抗菌天然产物研究不断增加,很多植物天然产物虽然抗菌效果不如临床抗生素显著,但由于它们中很多来源于人们日常的水果蔬菜和餐桌饮食,因而安全性相对较高;同时有些化合物还可增强临床抗生素的抗菌效果、逆转其抗药性等。所以,有关植物源抗菌天然产物与抗生素的联合用药研究逐渐受到重视。鼠尾草酸为从迷迭香中分离得到的食品抗氧化剂,α-倒捻子素为从水果山竹中分离得到的天然产物,两者均具有良好的安全性[18-19]。课题组对两化合物联合不同作用机制抗生素的抗菌效果进行研究,发现靶向细胞膜的鼠尾草酸和α-倒捻子素均与作用于细菌核糖体复合物、干扰蛋白质合成及影响细胞膜的庆大霉素具有较强的协同抗金黄色葡萄球菌作用,但与其它作用于细胞膜的阿扎霉素F和作用于核糖体的罗红霉素和多西环素等显示无关作用。
课题组前期发现在作用于同一代谢途径不同代谢位点的抗菌药物中发现协同抗菌药物组合的概率较大[15],而非传统认为不同作用机制抗菌药物联合产生协同的可能性较大。其结论和发现得到了Brochado等[16]学者深入证明,然而植物抗菌天然产物与抗生素联用的效果是否也与这一规律吻合有待进一步研究。因此,课题组选用报道较多的鼠尾草酸和α-倒捻子素为对象,对其联合不同作用机制的抗菌效果进行研究。尽管此两个化合物与抗生素的联合用药有一定报道,但有些报道之间结论相差较大[18,20-24],本研究结果表明:在8个组合物中仅2个组合物有协同增效的联合抗菌效果,而且仅1个组合物对所有测试菌株有协同抗菌作用。虽然其结果与某文献报道的结论稍有不同[18],但总体结论一致,并与课题组前期的研究结果共同证明上述抗生素联合应用效果规律的科学性和合理性[13]。虽然这两个植物天然产物的具体抗菌机制尚未完全阐明,但从文献报道可知[18,25]:鼠尾草酸和α-倒捻子素均可靶向细胞膜,并分别抑制药物的外排泵和损伤细胞膜。而庆大霉素通过细胞膜后则不仅可与核糖体复合物结合干扰蛋白质的合成,还可由此导致无功能异常蛋白质的产生,这些蛋白与细胞膜结合后,最终可引起细胞膜的破裂和渗透性增加。对于极性非常强、水溶性高的庆大霉素来说,跨细胞膜过程是其限速步骤。由此可以推断:鼠尾草酸或α-倒捻子素联合庆大霉素产生协同的效果,可能与其均可作用于细胞膜有关,而这种多重细胞膜损伤又促进了庆大霉素的跨膜过程,并与异常蛋白的产生和对膜的损伤形成放大效应,从而产生了协同增效的效果。所以,两者联合后涉及对膜蛋白合成、正常膜蛋白在细胞膜上的插入及膜蛋白生理功能赖以发挥的膜稳态环境这一细胞代谢过程的干扰,故在某种程度上进一步支持了课题组和Brochado等发现的联合用药效果方面的规律。
鼠尾草酸、α-倒捻子素和阿扎霉素F均可损伤金黄色葡萄球菌的细胞膜,和传统观点一样,三者具有相同的作用机制,呈现非协同效果的概率大;尽管它们损伤细胞膜的具体机制(尚不明确)可能不同,但鼠尾草酸、α-倒捻子素与阿扎霉素F作用于细胞膜的具体机制在代谢途径上有无相关性尚不能确定。同时,鼠尾草酸和α-倒捻子素还可抑制药物的外排泵,阿扎霉素F还可靶向金黄色葡萄球菌的胞外毒力因子脂磷壁酸[26],虽然两者属于不同的作用机制,但两者之间也无明显的相关性,所以鼠尾草酸、α-倒捻子素与阿扎霉素F联合不属于同一代谢途径的不同位点,呈现非协同的概率较大,这与本研究的实验结果相吻合。由此,从反面进一步支持了课题组和Brochado等发现的联合用药效果方面的规律。
不同药物对同一病原菌不同菌株的MIC不同,耐药菌株也只是针对特定结构或结构类型的药物或几类药物来说的,并非对所有药物都产生耐药。这可以解释表1中表现出来的鼠尾草酸对耐药金黄色葡萄球菌MRSA 01较敏感菌S. aureus ATCC25923更敏感。鼠尾草酸联合硫酸庆大霉素的协同抗菌试验表明:两者联合应用对其较为敏感的MRSA 01可以产生协同抑菌效果,而对S. aureus ATCC25923则表现为无关的联合抗菌效果,这一现象进一步支持了课题组前期报道的推断[15],即两药联合应用时对敏感菌株较对不敏感或耐药菌株产生协同抗菌效果的可能性更大。
文献报道显示[18],α-倒捻子素具有很强的抗金黄色葡萄球菌活性,且与多种结构类型的抗菌药物对测试革兰阳性菌显示无关的联合抗菌作用,本文研究结果与文献报道的总体相似,与多数抗生素的联合显示无关的抗菌作用。明显不同的是,本研究中α-倒捻子素与氨基糖苷类的硫酸庆大霉素联用时显示出明显的协同抗金黄色葡萄球菌作用。这可能与不同菌株对药物的敏感度及其药物联用效果的不同有关,这点在联合用药研究中比较常见[13,15]。
在抗菌药物联合应用的研究中,课题组发现无论联合用药的效果是协同、无关,还是拮抗,按照突变选择窗理论,一个药物均可通过增加其用量窄化另一个药物的突变选择窗[15];同时很多植物天然产物安全性相对较高。因此,课题组在IC2AR 2019国际学术会议上提出[27]:选择作用安全性较好的植物抗菌天然产物与抗菌药物进行联合用药,无论协同与否,最好是协同,通过增加联合用药时植物天然产物的比例和用量窄化临床抗菌药物的突变选择窗,以减少或避免抗菌药物的耐药,延缓细菌耐药的演变和发展。由此,本研究不仅获得了具有显著协同抗菌的药物组合α-倒捻子素/硫酸庆大霉素,还获得了针对不同菌株既可显示协同,又可显示无关作用的抗菌组合物鼠尾草酸/硫酸庆大霉素,从而为联合用药规律的进一步研究打下了基础。
参 考 文 献
MacLean R C, Millan A S. The evolution of antibiotic resistance[J]. Science, 2019, 365(6458): 1082-1083.
Laxminarayan R, Sridhar D, Blaser M, et al. Achieving global targets for antimicrobial resistance[J]. Science, 2016, 353(6302): 874-875.
刘昌孝. 当代抗生素发展的挑战与思考[J]. 中国抗生素杂志, 2017, 42(1): 1-12.
Tepekule B, Uecker H, Derungs I, et al. Modeling antibiotic treatment in hospitals: A systematic approach shows benefits of combination therapy over cycling, mixing, and mono-drug therapies[J]. PLOS Comput Biol, 2017, 13(9): e1005745.
Farha M A, Brown E D. Drug repurposing for antimicrobial discovery[J]. Nat Microbiol, 2019, 4: 565-577.
陳代杰. 细菌耐药性与抗生素增效剂开发[J]. 上海应用技术学院学报(自然科学版), 2016, 16(1): 1-9.
Theuretzbacher U, Piddock L J. Non-traditional antibacterial therapeutic options and challenges[J]. Cell Host Microbe, 2019, 26(1): 61-72.
Ejim L, Farha M A, Falconer S B, et al. Combinations of antibiotics and nonantibiotic drugs enhance antimicrobial efficacy[J]. Nat Chem Biol, 2011, 7: 348-350.
Fischbach M A. Combination therapies for combating antimicrobial resistance[J]. Curr Opin Microbiol, 2011, 14(5): 519-523.
Tyers M, Wright G D. Drug combinations: A strategy to extend the life of antibiotics in the 21st century[J]. Nat Rev Microbiol, 2019, 17(3), 141-155.
Zhao W, Hu Z, Okubo S, et al. Mechanism of synergy between epigallocatechin gallate and β-lactams against methicillin-resistant Staphylococcus aureus[J]. Antimicrob Agents Chemother, 2001, 45: 1737–1742.
Górniak I, Bartoszewski R, Króliczewski J. Comprehensive review of antimicrobial activities of plant flavonoids[J]. Phytochem Rev, 2019, 18: 241-272.
袁干军, 李沛波, 杨慧. 迷迭香中鼠尾草酸的抗MRSA活性研究[J]. 中国现代应用药学, 2012, 29(7): 571-574.
Zou H, Koh J, Li J, et al. Design and synthesis of amphiphilic xanthone-based, membrane-targeting antimicrobials with improved membrane selectivity[J]. J Med Chem, 2013, 56: 2359-2373.
Xu X, Xu L, Yuan G, et al. Synergistic combination of two antimicrobial agents closing each other's mutant selection windows to prevent antimicrobial resistance[J]. Sci Rep, 2018, 8(1): 7237-7243.
Brochado A R, Telzerow A, Bobonis J, et al. Species-specific activity of antibacterial drug combinations[J]. Nature, 2018, 559(7713): 259-263.
吳雪娇, 徐莉, 李沛波. 阿扎霉素F衍生物及联合维生素K3抗耐甲氧西林金黄色葡萄球菌研究[J]. 中国抗生素杂志, 2016, 41(8): 584-589.
Song M, Liu Y, Li T, et al. Plant natural flavonoids against multidrug resistant pathogens[J]. Adv Sci, 2021: 2100749.
马征, 胡春生, 杨智, 等. 鼠尾草酸的遗传毒性研究[J]. 药物评价研究, 2015, 38(6): 640-647.
Vázquez N M, Fiorilli G, Guido P A C, et al. Carnosic acid acts synergistically with gentamicin in killing methicillin-resistant Staphylococcus aureus clinical isolates[J]. Phytomedicine, 2016, 23(12): 1337-1343.
Moreno S, Ojeda Sana A M, Gaya M, et al. Rosemary compounds as nutraceutical health products[M]//Food Additives, 1st ed, El-Samragy Y, Ed, IntechOpen Science: Rijeka, Croatia, 2012: 157-174.
Sakagami Y, Iinuma M, Piyasena K G N P, et al. Antibacterial activity of a-mangostin against vancomycin resistant Enterococci (VRE) and synergism with antibiotics[J]. Phytomedicine, 2005, 12(3): 203-208.
Meah M S, Lertcanawanichakul M, Pedpradab P, et al. Synergistic effect on anti-methicillin-resistant Staphylococcus aureus among combinations of α-mangostin-rich extract, lawsone methyl ether and ampicillin[J]. Lett Appl Microbiol, 2020, 71(5): 510-519.
Ahmad M I, Keach J E, Behl T, et al. Synergistic effect of α-mangostin on antibacterial activity of tetracycline, erythromycin, and clindamycin against acne involved bacteria[J]. Chin Herb Med, 2019, 11(4): 412-416.
Ojeda-Sana A M, Repetto V, Moreno S. Carnosic acid is an efflux pumps modulator by dissipation of the membrane potential in Enterococcus faecalis and Staphylococcus aureus[J]. World J Microbiol Biotechnol, 2013, 29: 137-144.
Yuan G, Xu L, Xu X, et al. Azalomycin F5a, a polyhydroxy macrolide binding to the polar head of phospholipid and targeting to lipoteichoic acid to kill methicillin-resistant Staphylococcus aureus[J]. Biomed Pharmacother, 2019, 109: 1940-1950.
Yuan G, Li P, Qin H, et al. Opinions and regularity conclusions on drug combination to prevent resistance[J]. J Integrated Omics, 2019, 9(2): 6.
