2012—2021年间血流感染病原菌分布及耐药性分析
2023-08-25王盼别甜敏金文平王华兵蒋雯
王盼?别甜敏?金文平?王华兵?蒋雯
摘要:目的 探讨武汉市第三医院血流感染病原菌的分布及耐药性变迁,为合理使用抗菌药物提供依据。方法 收集武汉市第三医院2012年1月至2021年12月血流感染患者临床资料、菌株分布和体外药敏数据。结果 共收集患者2091例,社区获得性60.8%(1272/2091),医院获得性39.2%(819/2091)。分离菌株2262株,主要分布:烧伤科482株(21.3%)、重症监护室353株(15.6%)和肾内科225株(9.9%)。分离的菌株中革兰阴性菌1174株(51.9%),革兰阴性菌分离率由2012年38.6%升至2021年54.7%,居前3位的分别是大肠埃希菌(568株,25.1%)、肺炎克雷伯菌(170株,7.52%)和铜绿假单胞菌(152株,6.72%);革兰阳性菌1088株(48.1%),居前3位的分别是凝固酶阴性葡萄球菌(556株,24.5%)、金黄色葡萄球菌(339株,14.9%)和肠球菌属(93株,4.11%)。2012—2016年与2017—2021年相比,大肠埃希菌对氨苄西林的耐药率由81.1%上升至82.6%,对头孢唑林的耐药率由57.2%上升至64.5%,对环丙沙星耐药率由41.8%下降至38.7%,对哌拉西林/他唑巴坦、阿米卡星、亚胺培南耐药率均<5%。肺炎克雷伯菌对头孢吡肟耐药率由4.8%升至22.6%,对哌拉西林/他唑巴坦耐药率由3.2%升至12.3%,对亚胺培南耐药率由0升至8.5%。铜绿假单胞菌对环丙沙星耐药率由64.3%下降至44.1%,对亚胺培南耐药率由65.5%下降至61.8%。鲍曼不动杆菌对头孢哌酮/舒巴坦耐药率为81.5%,对多黏菌素耐药率为2.9%,对亚胺培南耐药率由82.8%下降至73.5%。耐甲氧西林金黄色葡萄球菌(MRSA)分离率53.1%(180/339),耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)分离率64.3%(358/556),金黄色葡萄球菌对苯唑西林耐药率由58.1%下降至43.6%,凝固酶阴性葡萄球菌对苯唑西林耐药率由81.8%下降至57.4%。结论 武汉市第三医院血流感染病原体构成中革兰阴性菌呈增长趋势;大肠埃希菌、肺炎克雷伯菌对常用药物的耐药性增加;葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌对常用药物的耐药率呈轻度下降趋势,但耐药形势依然严峻。
关键词:血流感染;病原菌;耐药率变迁;革兰阴性菌;革兰阳性菌
中图分类号:R378文献标志碼:A
Distribution and drug resistance analysis of pathogenic bacteria in bloodstream infection from 2012 to 2021
Wang Pan, Bie Tian-min, Jin Wen-ping, Wang Hua-bing, and Jiang Wen
(Wuhan Third Hospital, Wuhan 430060)
Abstract Objective To analyze the distribution and drug resistance of pathogens of bloodstream infection in our medical institution, and to offer evidence for the rational use of antibiotics. Methods The clinical data, strain distribution, and antimicrobial susceptibility data of patients with bloodstream infections in our hospital from January 2012 to December 2021 were collected. Results Data of 2091 patients were collected, with the community acquired 60.8% (1,272/2,091) and hospital acquired 39.2% (819/2,091). There were 2,262 positive strains in blood culture, including 482 strains (21.3%) in the burn department, 353 strains (15.6%) in the intensive care unit, and 225 strains (9.9%) in the nephrology department, among which 1,174 strains (51.9%) were Gram-negative bacteria. The isolation rate of Gram-negative bacteria increased from 38.6% to 54.7% from 2012 to 2021. The top three were Escherichia coli (568 strains, 25.1%), Klebsiella pneumoniae (170 strains, 7.52%), and Pseudomonas aeruginosa (152 strains, 6.72%). There were 1,088 Gram-positive strains (48.1%), including 556 Coagulase-negative Staphylococcus (24.5%), 339 Staphylococcus aureus (14.9%) and 93 enterococcus (4.11%) in the top three. Compared with 2017-2021, the resistance rates of Escherichia coli to ampicillin and cefazolin increased from 81.1% and 57.2% to 82.6% and 64.5%, ciprofloxacin decreased from 41.8% to 38.7%, and piperacillin/trizobactam, amikacin and imipenem were all < 5%. The drug resistance rates of Klebsiella pneumoniae to cefepime, piperacillin/tazobactam, and imipenem increased from 4.8%, 3.2%, and 0 to 22.6%, 12.3%, and 8.5%. The resistance rates of P. aeruginosa to ciprofloxacin and imipenem decreased from 64.3% and 65.5% to 44.1% and 61.8%. The resistance rates of Acinetobacter baumannii to cefoperazone/sulbactam and polymyxin were 81.5% and 2.9%, while imipenem decreased from 82.8% to 73.5%. The isolation rate of methicillin-resistant Staphylococcus aureus (MRSA) and methicillin-resistant Coagulase-negative Staphylococcus (MRCNS) was 53.1% (18/339) and 64.3% (358/556), respectively. The drug resistance rates of Staphylococcus aureus and Coagulase-negative Staphylococcus to oxacillin decreased from 58.1% and 81.8% to 43.6% and 57.4%. Conclusion The drug resistance of Pseudomonas aeruginosa and Acinetobacter baumannii is imminence to all of us, however, our statistics show that the drug resistance rate is decreasing.
Key words Bloodstream infection; Bacterial pathogens; Drug resistance rate; Gram-negative bacteria; Gram-positive bacteria
随着侵入性操作、免疫抑制剂、抗生素的广泛使用,以及人口老年化,增加了血流感染(bloodstream infection, BSI)的发生风险[1-2]。北美每年约57.5~67.7万人次出现BSI,欧洲每年约有120万人次BSI,是北美及欧洲排名前7位的死因之一[3]。年龄、糖尿病是BSI的高危因素,有研究表明[4],65~74岁、75~84岁和≥85岁人群的BSI发病率分别为3.75‰、6.79‰和10.47‰。而糖尿病患者感染风险是非糖尿病患者2倍多,美国每年将近100万糖尿病患者并发感染,治疗花费高达480亿美元[5]。2020年中国细菌耐药性监测网(CHINET) [6]报告血液标本占比15.0%,革兰阴性菌分离率为51.4%,较2012年的44.0%升高,前5位革兰阴性菌分别是大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌和阴沟肠杆菌,其中对亚胺培南耐药的肺炎克雷伯菌、鲍曼不动杆菌2012年分别为10.0%和61.6%,2020年上升至23.2%和72.9%。由于BSI的微生物学特征在不同地区、医院和科室之间存在差异,早期获得病原学依据困难以及耐药菌的增加,使得患者病死率和致残率升高。因此,临床医师必须熟知其医疗区域所特有的BSI流行病学特征,以指导抗菌药物合理应用。本研究对武汉市第三医院2012年1月至2021年12月BSI患者的病原学资料及临床资料进行回顾性分析,总结病原菌的分布及耐药性变迁,为合理使用抗菌药物提供依据。
1 研究对象和方法
1.1 研究對象
收集武汉市第三医院2012年1月—2021年12月住院期间BSI患者血培养结果,病例纳入标准:①BSI诊断标准参照《血流感染实验诊断与临床诊治》[7]。②若为凝固酶阴性葡萄球菌,纳入双瓶阳性或至少两次阳性的标本;③对于同一患者相同治疗周期相同菌株,仅入选第一次。排除标准:血培养污染及真菌的病例。
1.2 统计方法
采用Whonet 5.6及SPSS 22.0软件进行统计分析,符合正态分布的计量资料以(均数±标准差)(x±s),不符合正态分布的计量资料以M (P25, P75)表示;计数资料以百分比表示,组间比较采用χ2检验和Fisher精确检验;P<0.05为差异有统计学意义。
2 结果
2.1 一般资料及科室分布
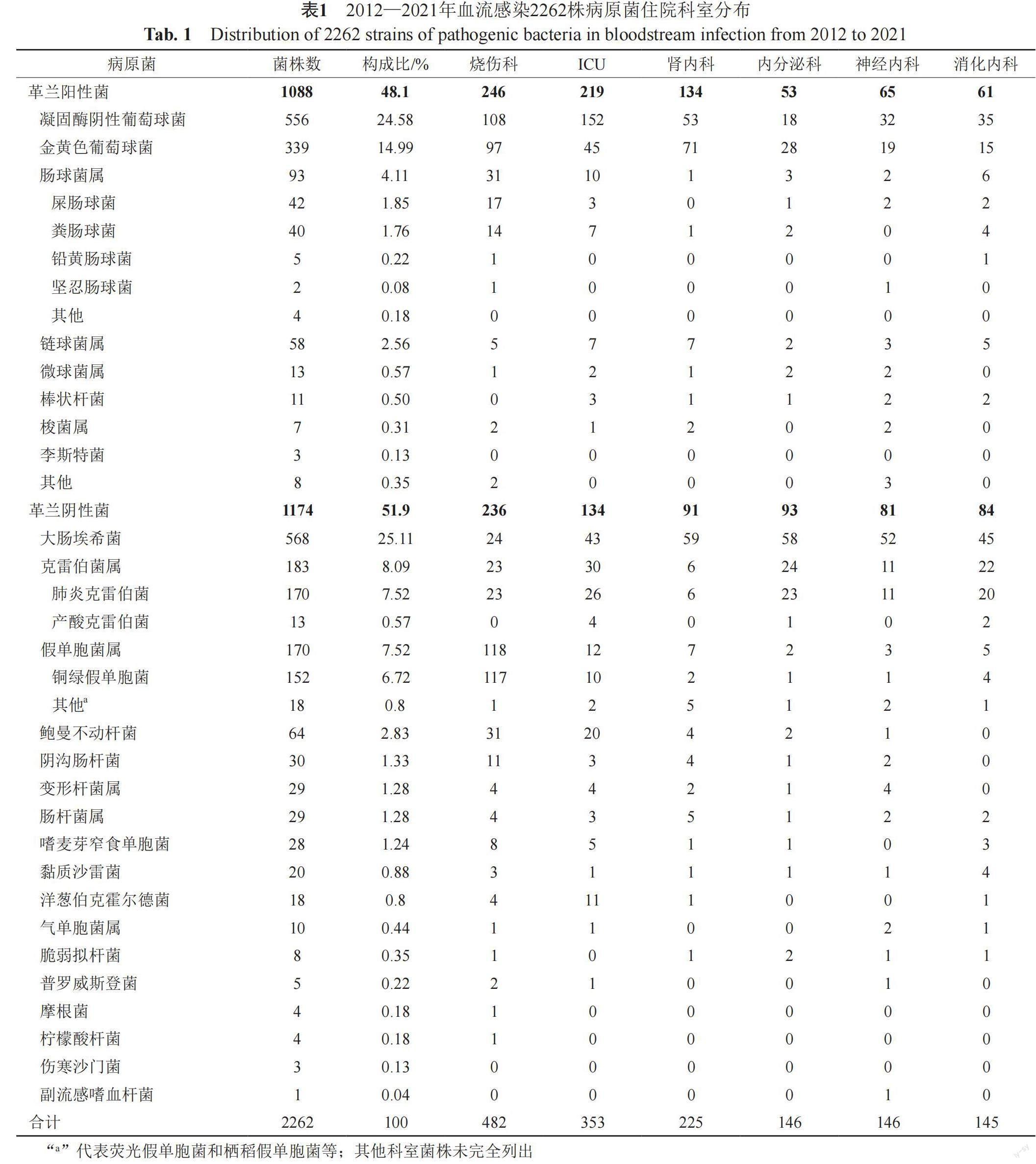
共收集BSI患者2091例,分离菌株2262株,社区获得性BSI 60.8%(1272),医院获得性BSI 39.2%(819);其中混合感染133例,烧伤科58例、重症监护室(ICU)19例混合感染。<18岁110例,男性65例,女性45例,年龄1(1, 3)岁;年龄≥18岁1981例,年龄68(54, 81)岁,男性1120例(56.5%),女性861例(43.5%)。患者主要分布于烧伤科21.31%(482/2262)、重症监护室15.60%(353/2262)、肾内科9.94%(225/2262)。大部分科室革兰阴性菌分离率高于阳性菌,并且以大肠埃希菌为主,烧伤科革兰阴性菌与阳性菌占比相近,ICU及肾内科阳性菌占比较高,详见表1。
2.2 BSI病原菌的构成及耐药率变迁
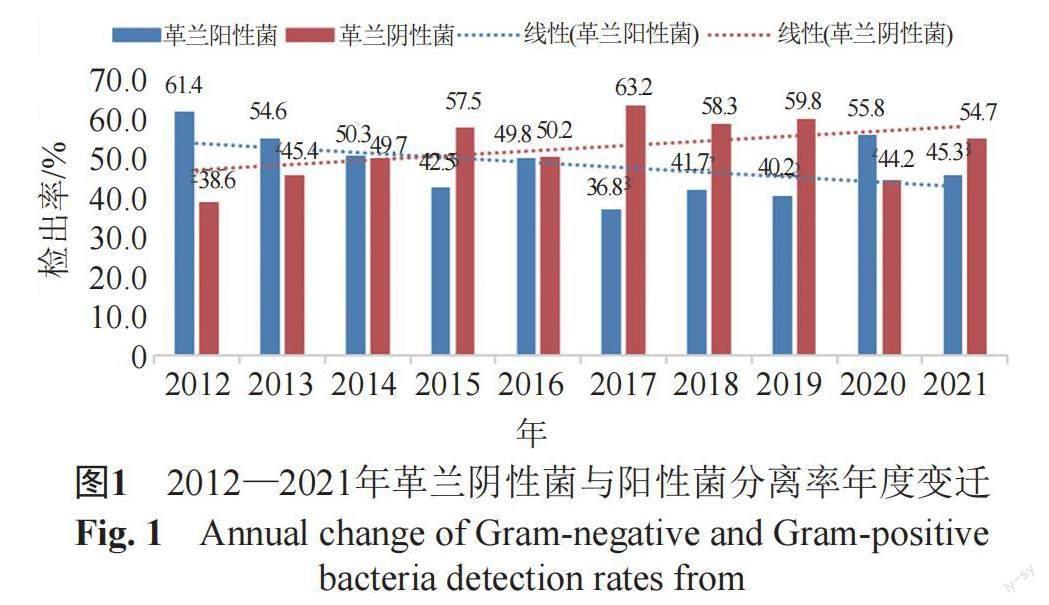
2262株病原菌中革兰阴性菌51.9%(1174/2262),革兰阳性菌48.1%(1088/2262),2012年到2021年革兰阴性菌分离率由38.6%升高至54.7%,见图1。
2.3 主要菌株对常见抗菌药物耐药率
2.3.1 主要革兰阴性菌耐药率分析
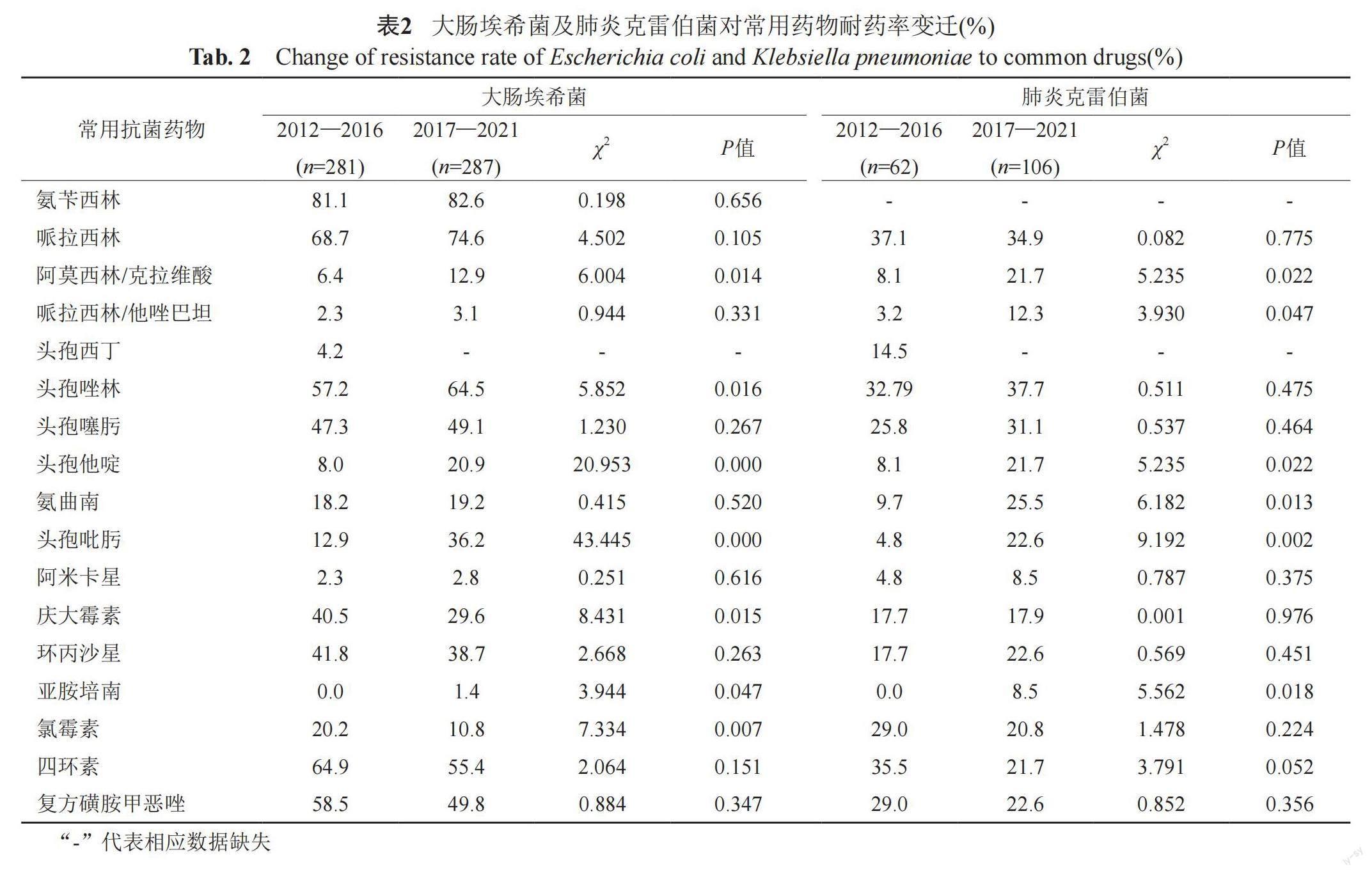
大肠埃希菌对碳青霉烯类、头霉素类及哌拉西林/他唑巴坦耐药率<5%,与2012—2016年相比,2017—2021年大肠埃希菌对氨苄西林、头孢唑林、哌拉西林/他唑巴坦、阿米卡星、亚胺培南耐药率由81.1%、57.2%、2.3%、2.3%和0上升至82.6%、64.5%、3.1%、2.8%和1.4%,见表2。肺炎克雷伯菌对常见药物耐药率<40%,阿米卡星、亚胺培南耐药率<10%,亚胺培南、哌拉西林/他唑巴坦、头孢他啶耐药率由0、3.2%、8.1%上升至8.5%、12.3%和21.7%,青霉素类、氨基糖苷类和喹诺酮类耐药率无显著变化,见表2。
铜绿假单胞菌对常用药物耐药率>60%,仅美罗培南、环丙沙星在近5年的耐药率分别48.5%和44.1%;环丙沙星耐药率由64.3%下降至44.1%(P=0.013),阿米卡星、亚胺培南耐药率由75.0%、65.5%下降至60.3%、61.8%,无显著差异。鲍曼不动杆菌对多黏菌素耐药率低,余药物耐药率均>70%,见表3。
2.3.2 主要革兰阳性菌耐药率分析
2012—2021年间MRSA分离率53.1%(180/339),MRCNS分离率64.3%(358/556)。葡萄球菌对青霉素、红霉素耐药率大于70%,金黄色葡萄球菌、凝固酶阴性葡萄球菌对苯唑西林耐药率由58.1%、81.8%下降至43.6%、57.4%。粪肠球及屎肠球对氨苄西林耐药率分别为7.1%、82.1%,未发现万古霉素耐药株,见表4~5。
3 讨论
根据WHO报告,感染是全球十大致死性疾病之一,而BSI是临床常见的危重症感染。芬兰报告2004—2018年17万余例BSI患者,发病率由1.50‰增长至3.1‰,病死率13%[8]。CHINET报告2011—2020年BSI中革兰阴性菌分离率由38.1%上升至51.4%[6,9]。国际性SENTRY监测显示BSI中革兰阴性菌分离率呈上升趋势,1997—2000年、2013—2016年分别为33.5%和43.4%。本文纳入2012—2021年BSI,革兰阴性菌分离率由38.6%上升至54.7%,可见BSI的流行病学特征正在发生变化[10]。本研究中大肠埃希菌和肺炎克雷伯菌是引起BSI最常见的革兰阴性菌,凝固酶阴性葡萄球菌、金黄色葡萄球菌是最常见革兰阳性菌,与2020年BRICS报告[11]相似,而SENTRY[10]指出金黄色葡萄球菌及肠球菌为常见革兰阳性菌,其次是表皮葡萄球菌。国内外差异可能与SENTRY将凝固酶阴性葡萄球菌详细区分至菌种,以及SENTRY为1997—2016年数据。李晓光报道[12]发热门诊BSI链球菌属分离率8.4%,本次研究对象为住院患者未纳入门急诊病例,其中社区获得性BSI 60.8%,结果显示链球菌属分离率2.56%。
2020年BRICS报道大肠埃希菌对头孢唑林、哌拉西林/他唑巴坦和碳青霉烯类耐药率分别为58.2%、7.1%和2.3%[11]。本研究与其相近。本研究显示大肠埃希菌各药物耐药率呈上升趋势,对阿莫西林/克拉维酸、头孢唑林、头孢他啶、头孢吡肟、亚胺培南耐药率明显升高,ESBLs(包括TEM、SHV、CTX-M)的产生可水解第一、第二、第三代头孢菌素,AmpC酶可导致β-内酰胺酶抑制剂复合制剂、第四代头孢菌素的耐药,而碳青霉烯酶(常见KPC-2型)是肠杆菌科碳青霉烯耐药主要原因。本研究结果还表明,革兰阴性菌中肺炎克雷伯菌检出率仅次于大肠埃希菌,与王娜等[13]报导相近。肺炎克雷伯菌对亚胺培南耐药率<10%,低于BRICS[11]碳青霉烯耐药率16.1%,原因可能与BRICS为2020年数据,而本研究为10年平均耐药率。肠杆菌科耐药率的升高与产ESBLs、AmpC酶和碳青霉烯酶在世界范围内的流行密切相关。目前β-内酰胺酶抑制剂复合制剂、碳青霉烯类、阿米卡星的耐药率较低,对于病情较重的患者可经验性选择前两种药物治疗,而阿米卡星通常作为联合药物治疗耐药菌。
本研究中铜绿假单胞菌及鲍曼不动杆菌分离率为6.72%和2.83%,高于2020年全国水平3.9%和2.4%[11]。多中心研究显示,大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌和鲍曼不动杆菌是医院获得性BSI最常见病原体[14]。本研究烧伤患者BSI革兰阴性菌中铜绿假单胞占49.6%(117/236)、鲍曼不动杆菌13.1%(31/236),与中国多中心[15]及Weber[16]报道的烧伤患者常见革兰阴性菌病原体相同。不恰当的抗菌药物治疗在烧伤患者中应用非常普遍,加上皮肤免疫屏障的破坏、大面积开放性伤口、长时间暴露于医院环境、吸入性损伤,反复侵入性操作增加院内感染的风险,增加耐药菌的产生[16-17]。2020年BRICS[11]显示铜绿假单胞菌对亚胺培南、环丙沙星、阿米卡星耐药率为23.3%、12.5%和2.5%,鲍曼不动杆菌上述药物耐药率分别为60.0%、58.8%和48.8%,本研究各药物耐药率均高于全国平均水平,仅多黏菌素具有较好的抗菌活性。目前铜绿假单胞菌及鲍曼不动杆菌抗感染治疗方案均推荐联合用药,对于泛耐药菌选择MIC值较小者联合应用[18]。根据本次体外药敏实验结果,烧伤患者感染铜绿假单胞菌,可选择多黏菌素为基础联合哌拉西林/他唑巴坦、环丙沙星或碳青霉烯类;鲍曼不动杆菌感染可选择多黏菌素为基础联合替加环素、碳青霉烯类或舒巴坦制剂,同时新药的开发显得尤为重要。
西班牙一项队列研究[19]显示葡萄球菌在社区获得性、卫生保健相关和医院获得性BSI分离率分别为7.5%、15.1%和27.9%,葡萄球菌属是医院获得性BSI重要病原体。本研究中,ICU、肾内科、烧伤科葡萄球菌分离率居前,与动静脉置管、皮肤黏膜广泛破坏及侵入性操作相关。ICU患者革兰阳性菌占62.0%,与南京中大医院报道[20]的ICU患者BSI革兰阳性菌28.2%存在差异,原因可能与后者纳入了真菌感染、区域性差异、患者分布以及时期不同相关。文献报道[15,17]烧伤患者7%会发生感染,其中33%发生不止一次的院内感染,而BSI是创面感染之外最常见的感染形式;住院早期感染多为葡萄球菌,后期多为革兰阴性菌,这也能解释武汉市第三医院MRSA(53.1%)明显高于BRICS(27.6%)[11]。美国肾脏病学会[21]指出80%透析患者初始使用导管透析,21%的患者在1年后仍然使用导管透析。导管透析主要并发症之一是BSI,较血管通路透析相关BSI高8倍[22],主要病原体为葡萄球菌。研究显示革兰阳性菌中肠球菌分离率仅次于葡萄球菌,屎肠球菌整体耐药率高于粪肠球菌,对青霉素、氨苄西林更为突出,對万古霉素均较为敏感。与此同时,北京301医院也报道[23]肠球菌BSI,屎肠球菌和粪肠球菌对氨苄西林耐药率分别为89%和9%。MRSA和MRCNS分离率下降,非发酵菌耐药率呈下降趋势,可能与抗感染药物的合理应用、细菌耐药监测和感染控制策略的实施相关,但是不能完全解释其他耐药病原菌的变化趋势。综上所述,BSI流行病学特征正发生着变化,大肠埃希菌在BSI中仍然占据重要地位。武汉市第三医院葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌耐药率明显高于国内平均水平,与本院为烧伤重点专科医院,患者是多重耐药菌感染的高危人群,且多为外地转诊有关,致使本院病原菌分布及耐药性较其他地区存在一定差异。BSI经验性抗感染可选择β-内酰胺酶抑制剂复合物覆盖大肠埃希菌及肺炎克雷伯菌,重症感染可选择碳青霉烯类。对于烧伤患者感染时需警惕MRSA及多重耐药铜绿假单胞菌,ICU、肾内科经验性治疗需考虑葡萄球菌,同时积极完善病原学检查,根据药敏优化治疗方案。总之,抗菌药物选择要充分考虑当地流行病学、病原菌谱、患者免疫状况和基础疾病等情况,及时并合理应用抗菌药物,对改善患者预后以及减少耐药株的产生具有重要意义。
本文不足之处在于非发酵菌体外敏感性实验中缺乏替加环素及多黏菌素药敏结果,未追溯BSI原发部位及患者基础疾病情况,对实际结果会有所影响,但也能在一定范围内指导临床用药。
参 考 文 献
Hepper H J, Sieber C, Walger P, et al. Infections in the elderly[J]. Crit Care Clin, 2013, 29(3): 757-774.
Zhao S, Wu Y, Dai Z, et al. Risk factors for antibiotic resistance and mortality in patients with bloodstream infection of Escherichia coli[J]. Eur J Clin Microbiol Infect Dis, 2022, 41(5): 713-721.
Goto M, Al-Hasan M N. Overall burden of bloodstream infection and nosocomial bloodstream infection in North America and Europe[J]. Clin Microbiol Infect, 2013, 19(6): 501-509.
Laupland K B, Pasquill K, Steele L, et al.Burden of bloodstream infection in older persons: A population-based study[J]. BMC Geriatr, 2021, 21(1): 31.
Korbel L, Spencer J D. Diabetes mellitus and infection: An evaluation of hospital utilization and management costs in the United States[J]. J Diabet Complicat, 2015, 29(2): 192-195.
全國细菌耐药监测网. 2020年CHINET中国细菌耐药监测[J]. 中国感染控制杂志, 2021, 21(4): 377-387.
周庭银, 倪语星, 王明贵.血流感染实验诊断与临床诊治[M]. 血流感染实验诊断与临床诊治, 2014.
Kontula K S K, Skogberg K, Ollgren J, et al. Population-based study of bloodstream infection incidence and mortality rates, finland, 2004—2018[J]. Emerg Infect Dis, 2021, 27(10): 2560-2569.
李光辉, 朱德妹, 汪复, 等. 2011年中国CHINET血培养临床分离菌的分布及耐药性[J]. 中国感染与化疗杂志, 2013, 13(4): 241-247.
Diekema D J, Hsueh P R, Mendes R E,et al. The microbiology of bloodstream infection: 20-year trends from the SENTRY antimicrobial surveillance program[J]. Antimicrob Agents Chemother, 2019, 63(7): e00355-19.
陈云波, 嵇金如, 应超群, 等. 2020年全国血流感染细菌耐药监测(BRICS)报告[J]. 中华临床感染病杂志, 2021, 14(6): 413-426
李晓光, 胥婕, 姚贝. 发热门诊血流感染154例病原学分析[J]. 中国感染与化疗杂志, 2016, 16(2): 123-128.
王娜, 张珍珍, 张伟东. 2012—2019年某医院血流感染病原菌变迁及耐药性分析[J]. 中国抗生素杂志, 2021, 46(1): 62-67.
Tian L, Sun Z, Zhang Z. Antimicrobial resistance of pathogens causing nosocomial bloodstream infection in Hubei province, China, from 2014 to 2016: a multicenter retrospective study[J]. BMC Public Health, 2018, 18(1): 1121.
Li L, Dai J X, Xu L, et al. Antimicrobial resistance and pathogen distribution in hospitalized burn patients: A multicenter study in Southeast China[J]. Medicine (Baltimore), 2018, 97(34): e11977.
Corcione S, Pensa A, Castiglione A, et al. Epidemiology, prevalence and risk factors for infections in burn patients: Results from a regional burn centres analysis[J]. J Chemother, 2021, 33(1): 62-66.
Van Duin D, Strassle P D, Dibiase L M, et al. Timeline of health care-associated infections and pathogens after burn injuries[J]. Am J Infect Control, 2016, 44(12): 1511-1516.
王明贵. 广泛耐药革兰阴性菌感染的实验诊断、抗菌治疗及医院感染控制: 中国专家共识[J]. 中国感染与化疗杂志, 2017, 17(1): 82-93.
Pérez-Crespo P M M, Lanz-García J F, Bravo-Ferrer J, et al. Revisiting the epidemiology of bloodstream infections and healthcare-associated episodes:results from a multicentre prospective cohort in Spain (PRO-BAC Study)[J]. Int J Antimicrob Agents. 2021, 58(1): 106352.
Xie J, Li S, Xue M, et al. Early- and late-onset bloodstream infections in the intensive care Unit: A retrospective 5-year study of patients at a university hospital in China[J]. J Infect Dis, 2020, 221(Suppl 2): S184-S192.
Saran R, Robinson B, Abbott K C, et al. US renal data system 2018 annual data report: Epidemiology of kidney disease in the United States[J]. Am J Kidney Dis, 2019, 73(3): A7-A8.
Nguyen D B, Shugart A, Lines C, et al. National healthcare safety network (NHSN) dialysis event surveillance report for 2014[J]. Clin J Am Soc Nephrol, 2017, 12(7): 1139-1146.
Zhang Y, Du M, Chang Y, et al. Incidence, clinical characteristics,and outcomes of nosocomial Enterococcus spp. bloodstream infections in a tertiary-care hospital in Beijing, China: A four-year retrospective study[J]. Antimicrob Resist Infect Control, 2017, 6: 73.
