高黏液型肺炎克雷伯菌毒力基因及分子流行病学研究
2023-08-25刘淑敏杜艳毕建蝶
刘淑敏?杜艳?毕建蝶


摘要:目的 分析临床分离的高黏液型肺炎克雷伯菌(hypermucoviscous Klebsiella pneumoniae,HMKP)的耐药性、毒力基因及其分子流行病学特征,为有效防治高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae,HVKP)的克隆传播提供依据。方法 通过拉丝试验收集非重复HMKP菌株。采用PCR检测毒力基因、荚膜血清型及进行多位点序列分型(MLST)。分别比较K1型和K2型菌株毒力基因携带模式的差异,以及毒力基因rmpA或rmpA2阳性组与阴性组毒力基因的携带情况。结果 共收集HMKP菌株42株,标本来源以痰液为主(88.10%),主要的疾病分布为肿瘤(26.19%)、呼吸系统疾病(21.43%)、脑部疾病(21.43%)。荚膜血清型以K1(28.57%)和K2(33.33%)型为主,85.71%的菌株携带高毒力基因rmpA/rmpA2和iucA/iutA。MLST以ST23(21.43%)、ST86 (19.05%)最常见。K1型和K2型有不同的毒力基因携带模式,K1型携带的毒力基因数多于K2型。rmpA或rmpA2阳性组的毒力基因rmpA2或 rmpA、iucA 、iutA 携带率高于其阴性组(P<0.05)。结论 本院HMKP以K1、K2荚膜血清型为主,ST型主要为ST23、ST86,85.71%的菌株为携带高毒力基因rmpA/rmpA2和iucA/iutA的HVKP。
关键词:高黏液型肺炎克雷伯菌;毒力基因;分子流行特征
中圖分类号:R978.1文献标志码:A
Study on the virulence gene and molecular epidemiology
of hypermucoviscous Klebsiella pneumoniae
Liu Shu-min, Du Yan, and Bi Jian-die
(Department of Clinical Laboratory, the First Affiliated Hospital of Kunming Medical University,
Yunnan Key Laboratory of Laboratory Medicine, Yunnan Province Clinical Research Center for Laboratory Medicine, Kunming 650032)
Abstract Objective To analyze the drug resistance, virulence gene and molecular epidemiological characteristics of clinically isolated hypermucoviscous Klebsiella pneumoniae (HMKP), so as to provide experimental basis for effective prevention and treatment of clonal transmission of hypervirulent Klebsiella pneumoniae (HVKP). Methods Non-repetitive HMKP strains were collected by string test. Virulence gene, capsular serotype and multilocus sequence typing (MLST) were detected by PCR. The virulence gene carrying patterns of K1 and K2 strains were compared, and the virulence genes of rmpA or rmpA2 positive group were compared with those of negative group. Results A total of 42 HMKP strains were collected. The samples were mainly from sputum (88.10%). The main diseases were tumors (26.19%), respiratory diseases (21.43%) and brain diseases (21.43%). The main capsular serotypes were K1 (28.57%) and K2 (33.33%), and 85.71% of the strains carried hypervirulent genes of rmpA/rmpA2 and iucA/iutA. The most common MLST were ST23 (21.43%) and ST86 (19.05%). K1 and K2 had different virulence gene carrying patterns, K1 carried more virulence genes than K2. The carrying rate of virulence genes rmpA2 or rmpA, iucA, iutA in rmpA or rmpA2 positive group was significantly higher than that in its negative group. Conclusion The main capsular serotypes of HMKP in our hospital are K1 and K2, and the main ST types are ST23 and ST86. And 85.71% of strains are HVKP carrying hypervirulent genes rmpA/rmpA2 and iucA/iutA .
Key words Hypermucoviscous Klebsiella pneumoniae; Virulence gene; Molecular prevalence characteristics
高黏液型肺炎克雷伯菌(hypermucoviscous Klebsiella pneumoniae,HMKP)是由经典肺炎克雷伯菌进化来的,在琼脂平板上生长的菌落出现高黏液表型[1]。HMKP具有较厚的荚膜来抵抗免疫细胞的吞噬和抗菌肽、补体及血清的杀伤作用[2-3]。高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae,HVKP)与各种侵袭性感染密切相关,且携带多种毒力基因,致病力强,死亡率高[4]。研究显示:大部分HVKP具有高黏液表型和高毒力性,而约51%[5]到98%[6]的HMKP因具有高毒力性可判定为HVKP。并非所有的HMKP都为高毒力,也并非所有HVKP都具有高黏液表型,HVKP与HMKP既紧密联系又相互区别[7]。目前临床缺乏统一的标准来快速鉴定所有的HVKP菌株,使用高黏液表型预测HVKP虽然存在缺陷,但对临床及时治疗HVKP感染仍具有重要意义。本研究对临床收集的HMKP进行荚膜血清型、毒力基因、多位点序列分型(multilocus sequence typing,MLST)等分析,为完善HVKP生物学信息及明确其代表性生物学标志物,提供分子流行病学依据。
1 材料与方法
1.1 主要仪器与试剂
MALDI-TOF MS质谱仪和Vitek-2 Compact全自动微生物鉴定仪(法国Bio-Merieux公司)、Genesy 96T基因扩增热循环仪(西安天隆科技有限公司)、DYY-6C双稳定时电泳仪(北京六一生物科技有限公司)、Image Quant LAS500超灵敏化学发光成像仪(美国GE Healthcare公司)、哥伦比亚血琼脂平板(郑州安图生物工程股份有限公司)、细菌基因组DNA提取试剂盒(北京天根生化科技有限公司)、2×Taq PCR MasterMix(北京博迈德生物公司)、DL2000 DNAMarker(Takara公司)、引物合成(安徽通用生物有限公司)。
1.2 菌株来源
收集昆明医科大学第一附属医院2018年2月—2020年12月临床标本中分离的42株非重复HMKP菌株,所有菌株经质谱仪鉴定。HMKP通过拉丝实验筛选,用接种环轻触培养基上单个菌落后向外拉,能够形成≥5 mm的黏液丝判断为拉丝试验阳性[4],重复3次确认。
1.3 临床信息收集
所有菌株携带者的临床信息利用LIS系统回顾性分析,包括标本类型、年龄、性别、入住科室、住院时間、侵入性操作和临床诊断等临床信息。
1.4 药敏试验
VITEK-2 全自动细菌鉴定药敏仪测定哌拉西林、阿莫西林/克拉维酸、头孢唑林、头孢他啶、头孢吡肟、头孢曲松、氨曲南、美罗培南、亚胺培南、厄他培南、阿米卡星、庆大霉素、环丙沙星、左氧氟沙星、四环素和复方磺胺甲恶唑16种常用抗菌药物的药敏结果,药敏结果判读依据2020年CLSI M100 S30文件进行。
1.5 PCR检测常见荚膜血清型及毒力基因携带情况
荚膜血清型主要包括:K1、 K2、K2、K5、 K20、K57型,毒力基因主要包括:magA、rmpA、rmpA2、iucA、iutA、iroN、entB、ybtS、kfu、fimH、mrkD、ureA、wabG、alls,使用基因组试剂盒进行菌株DNA提取,PCR反应采用25 μL反应体系:基因组DNA模板1 μL;Taq Master Mix 12.5 μL;ddH2O 9.5 μL;上下游引物各1 μL。引物序列及PCR反应条件参照文献[7]进行,1.5%琼脂糖凝胶电泳PCR产物,阳性产物送至北京擎科生物科技有限公司昆明分公司测序,测序结果于NCBI网站(http://www. Ncbi.nlm.nih.gov/BLAST/)进行BLAST比对。
1.6 MLST
参照文献[8]对肺炎克雷伯菌的7个管家基因(rpoB、gapA、mdh、pgi、phoE、infB和tonB)进行PCR扩增,产物电泳及测序确认参照1.5,测序结果于MLST网站(pastrur.fr/klebsiella/klebsiella.html)进行比对,得到ST分型。
2 结果
2.1 菌株分布情况
42株HMKP科室分布如下:胸外科(10/42,23.81%)、EICU(10/42,23.81%)、呼吸内科(5/42,11.90%)、神经内科(3/42,7.14%),其他科室均呈散在分布。标本来源以痰液为主(37/42,88.10%),其次是血(2/42,4.76%)和分泌物(2/42,4.76%),最后是咽拭子(1/42,2.38%)。主要的疾病分布如下:肿瘤(11/42,26.19%)、呼吸系统疾病(9/42,21.43%)、脑部疾病(9/42,21.43%)。
2.2 药敏结果分析
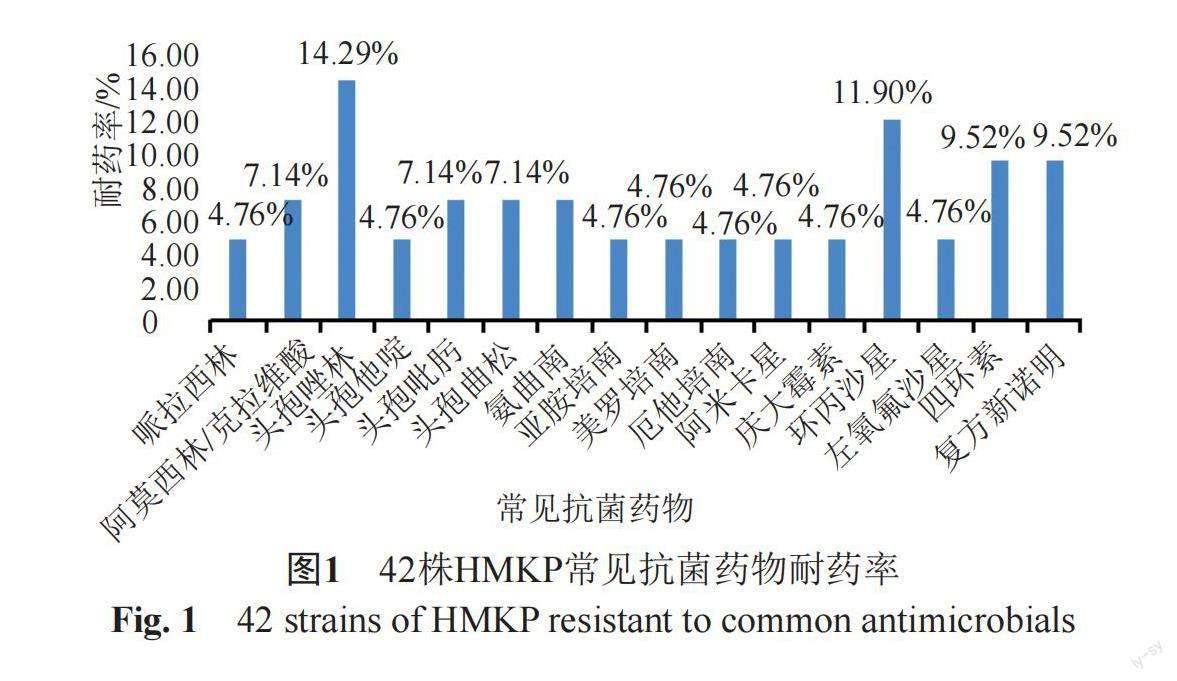
药敏结果显示本研究的42株HMKP对16种常用抗菌药物均处于较低的耐药水平,如图1所示。其中对碳青霉烯类抗生素(亚胺培南、美罗培南、厄他培南)耐药的2株HMKP对其他的13种抗菌药物均耐药。
2.3 荚膜血清型分布
42株HMKP中,荚膜血清型以K1和K2型为主,K1型12株,占28.57%,K2型14株,占33.33%,两者共占61.90%。未检出K20和K54型菌株,见图2。
2.4 毒力基因分布情况
42株HMKP中,毒力基因magA(28.57%)、iroN(9.52%)、kfu(42.86%)、alls(26.19%)携带率较低,其他毒力基因携带率均在70%以上,且高毒力基因rmpA/rmpA2和iucA/iutA的携带率高达85.71%。见图3。在K1型和K2型菌株的毒力基因组合模式中,12株K1型菌株包含4 种模式,以magA+rmpA+rmpA2+iucA+iutA+entB+ybtS+kfu+fimH+mrkD+ureA+wabG+alls为主(9/12,75%);而14株K2型菌株包含5种模式,以rmpA+rmpA2+iucA+iutA+entB+ybtS+fimH+mrkD+ureA+wabG为主(7/14,50%),见表1。此外,毒力基因alls和magA仅在K1型菌株中检出。
2.5 rmpA或rmpA2阳性组与阴性组比较
在42株菌中,rmpA阳性组的毒力基因rmpA2、iucA 、iutA携带率高于其阴性组(P<0.05),rmpA2阳性组的毒力基因rmpA、iucA和iutA携带率高于其阴性组(P<0.05) ,见表2。
2.6 多位点序列分型分布情况
结果显示42株HMKP经MLST分为20个ST型,见表3。其中以ST23(9/42,21.43%)、ST86(8/42,19.05%)最常见,其他ST型分布较散。
3 讨论
本研究中HMKP主要分离自患有肿瘤、呼吸系统和脑部疾病患者,与安徽地区研究结果较相似[9],此外大部分患者均进行过手术、呼吸机、气管插管等侵入性操作,可能造成局部免疫力薄弱而更易诱发感染[3,10]。药敏结果显示42株HMKP对临床常用抗生素耐药率较低,出现的两株碳青霉烯类耐药的HMKP应引起重视,以免造成高耐药合并高毒力肺炎克雷伯菌的局部暴发流行。
根据细菌表层一种有抗原性的荚膜多糖可将肺炎克雷伯菌分成78种以上荚膜血清型[11]。本研究42株HMKP中,荚膜血清型以K1和K2型为主,与以往研究[11]结果一致。HVKP最常见的荚膜血清型是K1,其次是K2,K5和K57[12-13],但不能完全依赖荚膜类型来判断本研究K1和K2型HMKP为高毒力菌株[12]。
研究[14]提出HVKP生物学标志可能是荚膜血清型与毒力因子的组合,通过对比分析发现:本研究12株K1型HMKP中,有9株是magA+rmpA+rmpA2+iucA+iutA+entB+ybtS+kfu+fimH+mrkD+ureA+wabG+alls毒力因子组合,携带了绝大部分毒力基因,而在14株K2型HMKP中有7株是rmpA+rmpA2+iucA+iutA+entB+ybtS+fimH+mrkD+ureA+wabG毒力因子组合,整体来看K2型携带的毒力基因数少于K1型,这可能是K1型肺炎克雷伯菌具有更强的侵袭力的原因。
HVKP最具特征性的毒力因子由毒力质粒编码,包括气杆菌素铁载体生物合成基因iucABCD-iutA、黏液表型调节因子rmpA、rmpA2[15],当rmpA/rmpA2合并iucA/iutA阳性可判定为HVKP[16]。本研究中有85.71% HMKP菌株携带高毒力基因rmpA/rmpA2和iucA/iutA,可预测为HVKP,提示本研究大部分HMKP具有較高毒力。rmpA2和rmpA功能相似,调控荚膜大量合成,导致高黏液表型,与菌株毒力密切相关[17-18]。本研究HMKP菌株rmpA2和rmpA携带率较高,同样证实了rmpA2和rmpA与菌株高黏液表型相关。此外研究表明铁载体的产生可能与高黏液表型协同作用[19],本研究在rmpA或rmpA2阳性组与阴性组比较时发现,rmpA或rmpA2阳性组的毒力基因 rmpA2或rmpA、iucA 、iutA携带率高于其阴性组,提示在HMKP中气杆菌素铁载体的产生可能与黏液表型调节因子rmpA和rmpA2相关。
本研究42株HMKP共检出20个ST分型,以ST23、ST86 最常见,其他ST分型相对分散,结果与以往研究相近[11,20]。提示本院HMKP分子流行特征分布广泛,出现较多的变异型。应引起临床密切关注。
综上所述,本院HMKP以K1、K2荚膜血清型为主,ST序列分型主要为ST23、ST86,85.71%的菌株为携带高毒力基因rmpA/rmpA2和iucA/iutA的HVKP。建议实验室结合HMKP的荚膜血清型、毒力基因、MLST和高黏液表型判断是否为HVKP。
参 考 文 献
Catalán-Nájera J C, Garza-Ramos U, Barrios-Camacho H. Hypervirulence and hypermucoviscosity: Two different but complementary Klebsiella spp. phenotypes[J]. Virulence, 2017, 8(7): 1111-1123.
Xu Q, Yang X, Chan E W C, et al. The hypermucoviscosity of hypervirulent K. pneumoniae confers the ability to evade neutrophil-mediate d phagocytosis[J]. Virulence, 2021, 12(1): 2050-2059.
Paczosa M K, Mecsas J. Klebsiella pneumoniae: Going on the offense with a strong defense[J]. Microbiol Mol Biol Rev, 2016, 80(3): 629-661.
Choby J E, Howard-Anderson J, Weiss D S. Hypervirulent Klebsiella pneumoniae-clinical and molecular perspectives [J]. J Intern Med, 2020, 287(3): 283-300.
Lin Y C, Lu M C, Tang H L, et al. Assessment of hypermucoviscosity as a virulence factor for experimental Klebsiella pneumoniae infections: Comparative virulence analysis with hypermucoviscosity-negative strain [J]. BMC Microbiol, 2011, 11( 50): 1-8.
Fang C T, Chuang Y P, Shun C T, et al. A novel virulence gene in Klebsiella pneumoniae strains causing primary liver abscess and septic meta static complications [J]. J Exp Med, 2004, 199(5): 697-705.
Zhan L, Wang S, Guo Y, et al. Outbreak by Hypermucoviscous Klebsiella pneumoniae ST11 isolates with carbapenem resistance in a tertiary hospital in China [J]. Front Cell Infect Microbiol, 2017, 7( 182): 1-9.
李煥芹. NDM-1阳性耐碳青霉烯类肺炎克雷伯菌临床感染特征、MLST分型和毒力特征分析[D]. 昆明: 昆明医科大学, 2020.
孙凯莉, 刘周, 刘艳艳, 等. 安徽地区高黏液表型肺炎克雷伯菌分子流行病学研究[J]. 安徽医科大学学报, 2021, 56(1): 121-124.
Li J, Ren J, Wang W, et al. Risk factors and clinical outcomes of hypervirulent Klebsiella pneumoniae induced bloodstream infections[J]. Eur J Clin Microbiol Infect Dis, 2018, 37(4): 679-689.
郑璐, 康海全, 赵树龙, 等. 高黏型肺炎克雷伯菌分子流行病学特点[J]. 中华医院感染学杂志, 2020, 30(4): 481-486.
Holt K E, Wertheim H, Zadoks R N, et al. Genomic analysis of diversity, population structure, virulence, and antimicrobial resistance in Klebsiella pneumoniae, an urgent threat to public health[J]. Proc Natl Acad Sci U S A, 2015, 112(27): E3574-E3581.
Lee I R, Molton J S, Wyres K L, et al. Differential host susceptibility and bacterial virulence factors driving Klebsiella liver abscess in an ethnically diverse population[J]. Sci Rep, 2016, 6: 1-12.
唐敏. 高毒力肺炎克雷伯菌生物标志的鉴定研究及基因组学分析[D]. 泸州: 西南医科大学, 2019.
Russo T A, Marr C M. Hypervirulent Klebsiella pneumoniae[J]. Clin Microbiol Rev, 2019, 32(3): e00001-19.
Russo T A, Olson R, Fang C T, et al. Identification of biomarkers for differentiation of hypervirulent Klebsiella pneumoniae from classical K. pneumoniae[J]. J Clin Microbiol, 2018, 56(9): e00776-18.
Palacios M, Miner T A, Frederick D R, et al. Identification of two regulators of virulence that are conserved in Klebsiella pneumoniae classical and hypervirulent strains[J]. mBio, 2018, 9(4): e01443-18.
Walker K A, Miner T A, Palacios M, et al. A Klebsiella pneumoniae regulatory mutant has reduced capsule expression but retains hypermucoviscosity[J]. mBio, 2019, 10(2): e00089-19.
Lan P, Yan R, Lu Y, et al. Genetic diversity of siderophores and hypermucoviscosity phenotype in Klebsiella pneumoniae[J]. Microb Pathog, 2021; 158: 105014.
Guo Y, Wang S, Zhan L, et al. Microbiological and clinical characteristics of hypermucoviscous Klebsiella pneumoniae isolates associated with invasive infections in China[J]. Front Cell Infect Microbiol, 2017, 7: 24.
