基于碳点内滤效应快速检测鲜牛奶中碱性磷酸酶活性的荧光分析方法的构建
2023-08-25贾宝珠何镇熹黄心洳邱芷靖郭琳苑袁钰佩王碧蔓
贾宝珠,何镇熹,黄心洳,邱芷靖,郭琳苑,袁钰佩,王碧蔓,罗 林,
(1.广东第二师范学院生物与食品工程学院,广东广州 510303;2.广东省食品质量安全重点实验室,华南农业大学食品学院,广东广州 510642)
磷酸酶是能催化正磷酸酯化合物水解的一类水解酶,包括碱性磷酸酶(Alkaline phosphatase,ALP)和酸性磷酸酶(Acid phosphatase)两类[1]。ALP 由两个相似的单体组成,含有五个半胱氨酸残基,两个锌原子和一个镁原子[2],是一种在碱性条件下,可以催化各种含磷酸酯键的化合物(包括核酸、蛋白质和生物碱)水解脱磷酸的酶。ALP 可以由乳腺细胞自然产生,广泛存在于生牛乳中,是牛奶中的主要内源酶之一。巴氏杀菌是一种相对温和的热杀菌方式,既能杀灭牛奶中天然存在的致病菌,又能最大限度地保留鲜牛奶中的营养物质和风味物质[3]。营养丰富的牛奶为致病菌的生长提供了条件,副结核分枝杆菌(Mycobacterium avium subspecies paratuberculosis)是牛奶中最耐热的细菌,而鲜牛奶中ALP 吸附在乳脂肪球膜上[4],比副结核分枝杆菌更耐热,通常将牛奶中ALP 活性是否低于350 mU/L 作为判定巴氏杀菌是否彻底的标准[5]。因此,ALP 活性的检测对鲜牛奶的质量控制具有重要意义。
当前,检测ALP 活性的分析方法可大致分为比色法[6]、化学发光法[7-8]、荧光法[9-10]以及电化学分析法[11]四类。然而,只有比色法、化学发光法、荧光法被公认为巴氏杀菌验证的有效方法。其中,比色法通常是以磷酸苯二钠或酚酞磷酸盐等为底物,在ALP的催化作用下底物脱去磷酸基团,形成苯酚、无机磷酸盐和硝基酚或酚酞[12],通过所释放的酚类物质吸光值测定ALP 的活性,但比色法存在抗干扰能力弱、检测限高等缺点[13]。荧光法检测巴氏杀菌乳中ALP主要是通过ALP 催化4-甲基伞形酮磷酸酯、α-萘酚磷酸酯等底物生成强荧光物质,通过测定生成物的荧光强度计算酶活力[14]。荧光法虽然灵敏度更高、操作简便、检测时间短,但是商业化的荧光底物价格昂贵检测成本高,并且所产生的荧光物质抗光漂白能力差,荧光稳定性不足[15]。荧光碳点(Carbon dots,CDs)作为一种新型荧光纳米材料具有比传统有机染料更为优异的光稳定性,制备成本低、生物兼容性好[16]。近些年,采用荧光内滤效应(Inner filter effect,IFE)[17]、光诱导电子转移[18]、荧光共振能量转移[19]或其他非辐射荧光猝灭策略构建基于碳点为探针的荧光传感器吸引了国内外众多研究者的关注。IFE 是光谱分析中光吸收剂吸收荧光团的激发光或发射光而产生的一种非辐照能量传递模型。由于吸光度的变化转化为指数变化的荧光强度变化,基于IFE 的荧光传感器与分光光度法相比,具有更高的灵敏度[20]。同时,由于IFE 传感器不需要对荧光团表面修饰或在受体和荧光团之间建立任何共价连接,为探针的制备中提供了相当大的灵活性和便利性[21]。然而,目前尚未见IFE 传感器用于牛奶中ALP 检测的报道。
鉴于此,本研究采用水热法,以乙二胺(Ethylenediamine,EDA)为氮源和邻苯二酚为碳源制备了发绿色荧光的氮掺杂碳点(Nitrogen-carbon dots,N-CDs),利用ALP 能催化并水解对硝基苯磷酸二钠(PNPP)生成对硝基苯酚(PNP),由于PNP 的吸收光谱与NCDs 的激发光谱刚好重合,PNP 可作为光吸收剂,通过IFE 竞争性与N-CDs 吸收激发光,从而导致N-CDs的猝灭建立一种可快速、高灵敏检测鲜牛中ALP 活性的荧光分析方法(图1 所示),对检测体系中的PNPP 浓度、缓冲液pH、酶促反应时间进行优化,并对该分析方法的抗干扰性能、准确度以及可靠性进行评价。该研究首次构建基于碳点内滤效应检测鲜牛奶中ALP 的荧光分析方法,既具有荧光分析法的高灵敏度同时克服传统荧光底物荧光稳定性不足的劣势。
1 材料与方法
1.1 材料与仪器
碱性磷酸酶(10 U/mg)、溶菌酶(2000 U/mg)、乳糖、维生素C、维生素A、维生素B1、对硝基苯磷酸二钠 上海源叶生物科技有限公司;CaCl2、FeCl2、NaCl、KCl 天津市大茂化学试剂厂;对硝基苯酚天津西恩思生化科技有限公司;乙二胺 上海阿拉丁生化科技股份有限公司;邻苯二胺 上海易恩化学技术有限公司;Tris 健阳生物科技有限公司;盐酸天津市大茂化学试剂厂;鲜牛奶样品 购于华南农业大学校内超市。
聚四氟乙烯高压反应釜 南京瑞尼克科技有限公司;Tecnai-12 高分辨透射电子显微镜 荷兰FEI;Unique R10 超纯水净化仪 厦门锐思捷水纯化技术有限公司;Evolution 300 紫外-可见分光光度计、ESCALAB 250Xi X 射线电子能谱仪、Sorvall ST 8R 高速冷冻离心机 美国Thermo Fisher Scientific公司;VERTEX 70 型傅立叶变换红外光谱仪 德国Bruker 公司;SpectraMax-i3x 多功能微孔板检测平台 美国Molecular Devices 公司;DHG-9038A 电热恒温鼓风干燥箱 上海精宏实验设备有限公司;ZNCL-G 智能磁力搅拌器 巩义市予华仪器有限责任公司;MS 3 basic 漩涡混匀振荡器 德国IKA;FE28-StandardpH 酸度计 德国梅特勒-托利多仪器有限公司;KQ-300DE 数控超声波清洗器 昆山市仪器有限公司;SSW-600-2S 电热恒温水浴锅 上海博讯实业有限公司;ME 104 电子分析天平 德国梅特勒—托利多仪器有限公司;10 kDa 超滤离心管Millipore。
1.2 实验方法
1.2.1 N-CDs 的合成与表征
1.2.1.1 N-CDs 的制备 参照文献[22]的方法,具体合成步骤如下:将300 μL 乙二胺和25 mL 0.1 mol/L邻苯二酚用超声波混合(25 kHz,5 min,25 ℃),然后转移到50 mL 聚四氟乙烯高压釜中,在180 ℃下加热12 h,得到的深棕色混合物,用20 mL 一级水稀释,在12000 r/min 离心10 min,去除沉淀物,然后收集上清液,通过透析袋 (MWCO:1000 Da) 在超纯水中透析48 h,将所制备的N-CDs 保存在4 ℃下。
1.2.1.2 透射电镜(TEM)表征 取10 μL N-CDs 溶液滴于镀有碳膜的铜网(300 目)表面,室温干燥后,于FEI 透射电子显微镜下进行表征。
1.2.1.3 荧光光谱测试(UV-Vis) 使用SpectraMaxi3x 多功能微孔板检测平台的荧光检测模式进行NCDs 最佳荧光激发光谱与发射光谱的测量,测试温度为25 ℃。
1.2.1.4 X 射线光电子能谱测试(XPS) 将N-CDs溶液冻干后的粉末用研钵研细,称量100 mg 样品于ESCALAB 250Xi X 射线光电子能谱仪,进行表征。
1.2.1.5 红外光谱测试(FT-IR) 使用VERTEX 70型傅立叶变换红外光谱仪对样品进行测试(波数范围:0~4000 cm-1)。
1.2.2 荧光分析方法可行性验证
1.2.2.1 ALP 催化猝灭N-CDs 效果 设置酶标板中只加PNPP(2 mmol/L),只加ALP(20 U/L)和同时加PNPP 及ALP 三种分组,每个分组三组平行重复实验,检测加入相同浓度N-CDs 后(10 mg/L)的荧光强度。
1.2.2.2 对硝基苯酚(PNP)对N-CDs 的猝灭效果配制浓度为0、10、20、40、60、80、100、150 和200 μmol/L 的PNP 溶液。将N-CDs 和不同浓度PNP 各50 μL 加入到黑色酶标板中,用SpectraMaxi3x 多功能微孔板检测平台测定在412 nm 激发下,518 nm 处荧光发射强度。
1.2.2.3 PNPP 与PNP 紫外-可见吸收光谱与N-CDs 荧光激发光谱与发射光谱重合情况考查 采用Evolution 300 紫外-可见分光光度计对PNPP 与PNP 进行紫外-可见吸收光谱进行扫描,测试使用的石英池的光径为1 cm,测试温度为25 ℃。并将其与N-CDs 的荧光激发光谱与发射光谱进行比较。
1.2.3 荧光分析方法的优化
1.2.3.1 反应体系pH 的优化 配制pH 为8.0、8.5、9.0、9.5、10.0、10.5 的20 mmol/L Tris-HCl 缓冲溶液。用对应pH 缓冲液溶解配制2 mmol/L 的PNPP和50 U/L 的ALP,分别添加50 μL PNPP 和50 μL ALP 到酶标板中,再添加50 μL 对应pH 缓冲液,充分振荡后在37 ℃的恒温水浴锅中反应20 min,反应后加入50 μL N-CDs,然后用多功能微孔板检测平台的荧光分析模块,测定在412 nm 激发下,518 nm处荧光发射强度。同时,用等体积对应pH 的Tris-HCl 缓冲溶液代替ALP 作为空白对照,所有组做三组平行实验。按照式1 计算不同pH 缓冲液反应体系荧光强度的抑制率,探讨实验最佳的反应pH。
式中:F0和Fn分别代表空白组与存在ALP 时体系的荧光值。
1.2.3.2 反应时间的优化 用最适pH Tris-HCl 缓冲液溶配制2 mmol/L 的PNPP 和50 U/L 的ALP,分别添加50 μL PNPP 和50 μL ALP 到酶标板中,充分振荡后在37 ℃的恒温水浴锅中反应,分别在反应10、20、30、40、50、60、70 和80 min 时加入50 μL N-CDs,用多功能微孔板检测平台的荧光分析模块,在412 nm 激发下,测定518 nm 处荧光发射强度。设置不加ALP 的组作为空白对照,所有组做三组平行实验。计算不同反应时间体系荧光强度的抑制率,选取抑制率趋于稳定的时间点确定最佳反应时间。
1.2.3.3 PNPP 浓度的优化 采用最适pH Tris-HCl缓冲液配制浓度为0、0.2、0.4、0.8、1.0、2.0 和4.0 mmol/L 的PNPP 溶液。分别添加50 μL PNPP和50 μL ALP(50 U/L)到酶标孔中,充分振荡后在37 ℃的恒温水浴锅中反应50 min,随后加入50 μL N-CDs。设置不加ALP 的组作为空白对照,所有组做三组平行实验。然后用多功能微孔板检测平台的荧光分析模块,在412 nm 激发下,测定518 nm 处荧光发射强度,并按式(1)计算缓冲液反应体系荧光强度的抑制率,选取抑制率最高的浓度点确定为最佳PNPP 浓度。
1.2.4 荧光分析方法的选择性 考察样品中潜在的干扰物:Ca2+、Fe2+、Na+、K+、维生素C、维生素A、维生素B1、溶菌酶、乳糖对检测体系荧光强度的影响。首先,用Tris-HCl 缓冲溶液(pH10.0)配制浓度均为1 mmol/L 上述干扰物的溶液,以及50 U/L 的ALP 溶液。接着将50 μL PNPP 溶液(1 mmol/L)分别与50 μL 的不同干扰物及ALP 溶液混合,充分振荡后在37 ℃的恒温水浴锅中反应50 min,反应后加入50 μL N-CDs。设置不加ALP 的组作为空白对照,所有组做三组平行实验。然后用多功能微孔板检测平台的荧光分析模块,在412 nm 激发下,测定518 nm 处荧光发射强度。按式(1)计算检测体系荧光强度抑制率。公式中F0、Fn分别代表空白荧光值、各物质的荧光值。
1.2.5 碱性磷酸酶的检测
1.2.5.1 建立ALP 的标准曲线 配制0、0.01、0.0125、0.025、0.5、0.1、0.15、0.25、0.5、0.8、1.0、1.25、2.5、5.0、10、15、25、50、80、100 U/L 活性梯度的ALP溶液。分别添加50 μL PNPP(1 mmol/L)和50 μL不同活性ALP 到酶标孔中,充分振荡后在37 ℃的恒温水浴锅中反应50 min,反应后加入50 μL NCDs。设置不加酶组作为空白对照,所有组做三组平行实验。然后用多功能微孔板检测平台的荧光分析模块,在412 nm 激发下,测定518 nm 处荧光发射强度,并按式2 计算反应体系的相对荧光强度,并以其为纵坐标值,ALP 活性浓度为横坐标值构建定量检测ALP 活性的标准曲线。
式中,F0和F1分别代表空白组与各浓度ALP时体系的荧光值。
1.2.5.2 样品前处理及加标回收实验 样品用天润和鲜之外两种品牌的鲜牛奶。将10 kDa 超滤离心管用超纯水润洗并预冷10 min,加入样品后在4 ℃、4000 r/min 条件下超滤离心30 min[23],将超滤后的牛奶样品用pH10 的Tris-HCl 缓冲液以1:25 的比例进行稀释处理,即可得到待测牛奶试样。取部分待测牛奶试样在水浴锅中以95 ℃,加热5 min,灭活牛奶中的ALP,即可得空白牛奶试样,此时ALP 的含量在10 mU/L 以下。采取标准加入法,对巴氏灭菌鲜牛奶进行加标回收实验。选取2.5、5、10 U/L 三个活性浓度水平,对两种品牌鲜牛奶样品进行添加,再用荧光分析方法进行测定,采用式(3)计算加标回收率。
式中,K0、K1、K2分别代表的是空白测定值、加标量、加标试样测定值。
1.3 数据处理
使用2016 版Excel 和Nano measurer1.2 软件对数据进行统计分析,使用Origin 2017 软件绘制图。使用SPSS Statistic 21 软件分析数据,数据均表示为平均值,通过单因素方差分析评估所有数据的差异,当方差分析中的P值表明统计学意义时,通过Tukey 检验评估差异,P<0.05 的值被认为是统计学上显著的。
2 结果与分析
2.1 N-CDs 的合成与表征
本研究以EDA 和邻苯二酚为原料,通过反应合成发绿色荧光的N-CDs。图2A 显示出N-CDs 呈准球形,分散性好,呈颗粒状,通过使用Nano measurer软件对大约100 个N-CDs 纳米颗粒进行统计分析,平均粒径在2.3 nm。图2B 显示N-CDs 的最佳激发波长在412 nm,在此激发波长下,在518 nm 处有一个很强的发射峰,与以往文献报道相符[22]。N-CDs的X 射线光电子能谱(图2C)在284.5、399.9 及531.5 eV 显示三个特征峰,分别对应C1s、N1s、O1s的信号,表明N-CDs 主要有C、N、O 三种元素组成[24];傅里叶红外光谱(FT-IR)显示,3435 cm-1与1580 cm-1处的峰分别属于N-H 的伸缩振动与弯曲振动,1400 cm-1与1740 cm-1处的峰分别归属于C-N 与C-O 的伸缩振动,3208 cm-1处的峰属于-OH 的伸缩振动[25],宽的羟基吸收带表明N-CDs 表面上存在多个羟基结构,赋予CDs 更高的极性和亲水性[17,22,24](图2D 所示)。上述表征结果与以往报道N-CDs 具有好的一致性,N-CDs 合成成功。
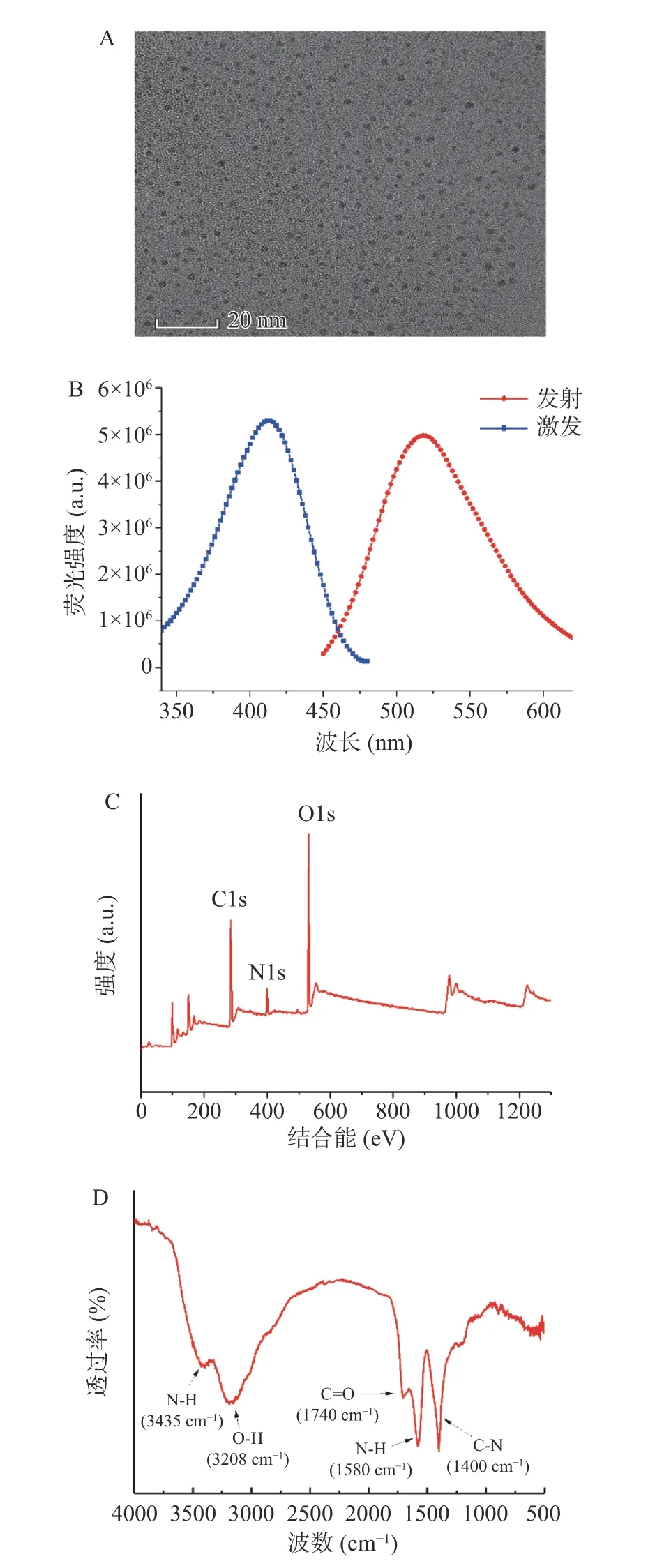
图2 N-CDs 的表征图Fig.2 Characterization of N-CDs
2.2 方法可行性验证
为验证荧光分析方法的可行性,本研究分别考察了ALP 及PNPP 单独存在时对N-CDs 荧光强度的影响。由图3A 所示,分别将ALP 与PNPP 加入N-CDs 溶液,N-CDs 的荧光强度基本不受影响;而当ALP 与PNPP 同时加入N-CDs 溶液,N-CDs 的荧光强度显著降低。由于ALP 催化PNPP 水解生成PNP[24],N-CDs 荧光猝灭很大可能是由PNP 引起的。因此,本研究考察不同浓度PNP 存在时N-CDs 荧光强度的变化。如图3B 所示,随着PNP 浓度从0 上升至200 μmol/L,N-CDs 的荧光强度不断被猝灭。通过比较PNPP、PNP 的紫外-可见吸收光谱与N-CDs的荧光激发与荧光发射光谱可知,PNP 的吸收光谱与N-CDs 的激发光谱刚好重叠,而PNPP 吸收光谱与N-CDs 的激发光谱及发射光谱均基本没有重叠(图4 所示)。因此,PNP 可作为光吸收剂,通过IFE竞争性与N-CDs 吸收激发光,从而导致CDs 的猝灭[17,20]。以上结果表明该荧光分析方法用于ALP 检测原理上是可行的。
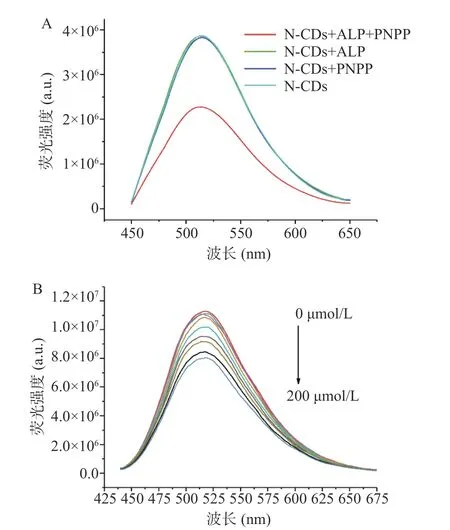
图3 荧光分析方法可行性验证Fig.3 Verification the feasibility of the fluorescence assay for ALP
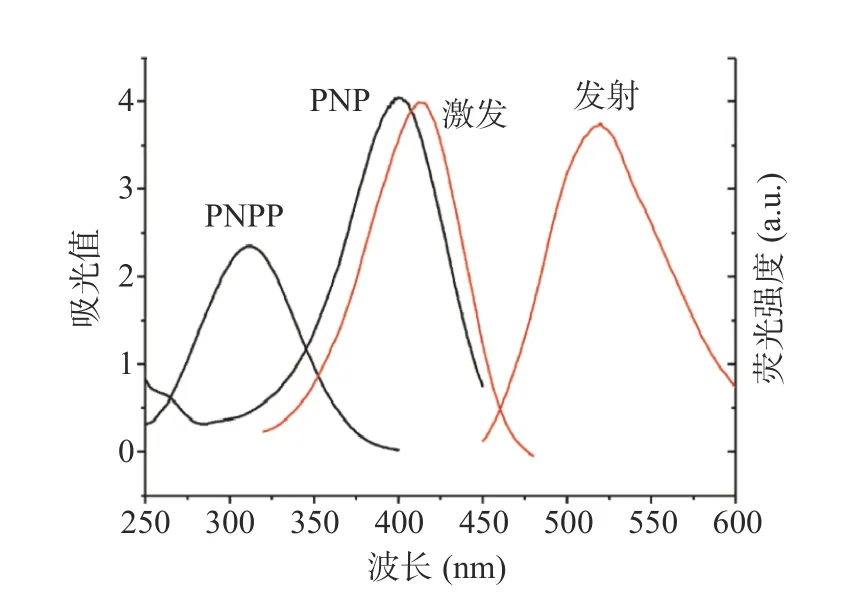
图4 PNPP 与PNP 的紫外-可见吸收光谱及N-CDs 的激发与发射荧光光谱比较Fig.4 Comparison between the UV-vis adsorption spectrum of PNPP and PNP and excitation and emission fluorescence spectra of N-CDs
2.3 荧光分析方法的优化
2.3.1 反应pH 的优化 为探究反应体系的pH 对方法检测性能的影响,测定了以pH 在8.0~10.5 的Tris-HCl 分别作为体系的缓冲液,用多功能微孔板检测平台测定各个pH 缓冲体系下,无ALP 存在下以及ALP 浓度为50 U/L 的荧光强度,计算各个pH缓冲体系下的荧光强度抑制率。可以看到反应体系pH 在8.0~10.0 范围内,抑制率随pH 升高而升高,且在pH10.0 时达到最大值(如图5 所示)。当pH 升高至10.5 时,抑制率呈下降趋势。所以反应体系最佳pH 为10.0。马金虎等[26]的研究发现,草鱼肝胰脏ALP 催化PNPP 水解反应的最适pH 为10.33。余同等[27]的研究表明,牛小肠ALP 催化PNPP 水解反应的最适pH 为9.7,pH 小于6.5 和大于11.5 均不稳定。由此可知,本研究优化得到反应体系最优pH 与ALP 最适作用pH 相近。
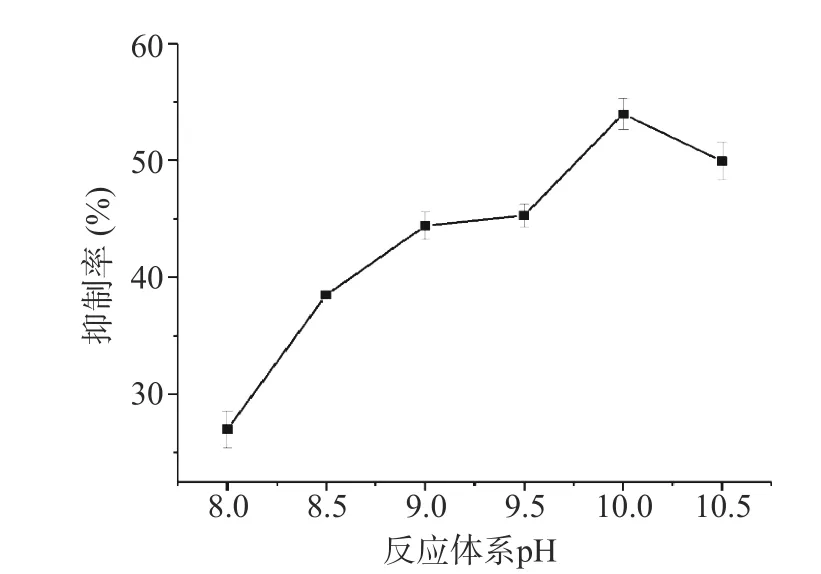
图5 pH 对检测体系响应灵敏度的影响Fig.5 Effect of pH on the sensitivity of the assay
2.3.2 反应时间的优化 为探究反应体系的反应时间对检测体系灵敏度的影响,考察了pH10 缓冲体系下,不同反应时间(10~80 min),ALP 浓度为50 U/L时所引起荧光强度抑制率。图6 显示,反应时间在10~50 min 范围内,抑制率呈明显上升趋势,在50 min时已达到60%左右,而当反应时间继续增加80 min,抑制率仅提升至70%左右,综合考虑检测时间成本,选取50 min 作为最佳反应时间。
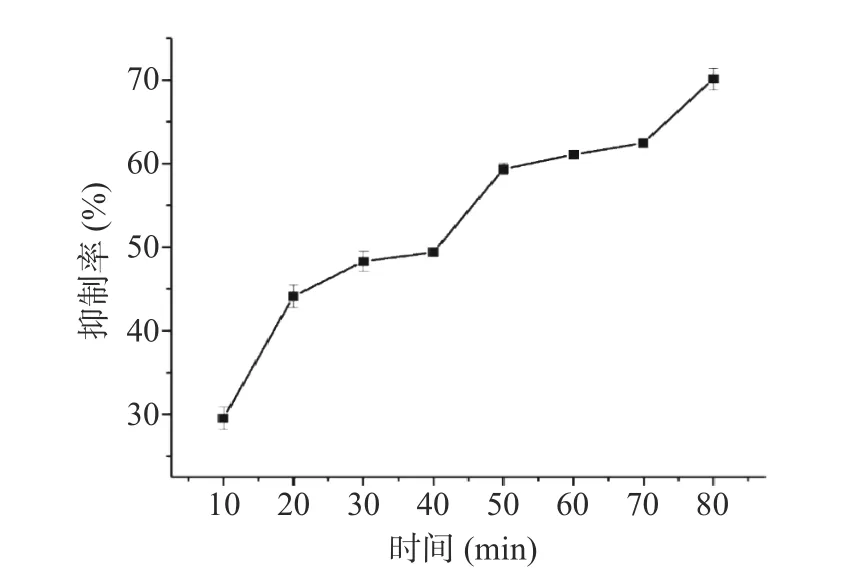
图6 反应时间对检测灵敏度的影响Fig.6 Effect of reaction time on the sensitivity of the assay
2.3.3 PNPP 浓度的优化 为探究反应体系的PNPP浓度对检测灵敏度的影响,考察了pH10 缓冲体系下,反应时间50 min,不同PNPP 浓度(0~4 mmol/L)下,ALP 浓度为50 U/L 时所引起体系荧光强度的抑制率。由图7 可以看出,PNPP 浓度在0~1 mmol/L范围内,抑制率呈显著上升(P<0.05),在1 mmol/L时已达到较高水平,而当PNPP 浓度继续增加,抑制率几乎无增加,达到平衡(P>0.05)。综合考虑试剂成本与检测灵敏度,选取1 mmol/L 作为PNPP 的最佳工作浓度。
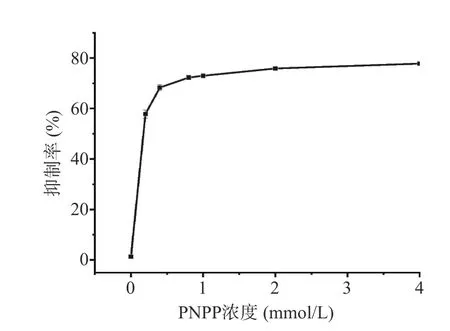
图7 PNPP 浓度对检测灵敏度的影响Fig.7 Effect of PNPP concentration on the sensitivity of the assay
2.4 荧光分析法的选择性
本研究考察了牛奶样品中可能存在金属离子(Na+、K+、Ca2+、Fe2+)、维生素(维生素C、维生素B1、维生素A)、乳糖、溶菌酶对检测干扰。从图8 可以看出,该荧光分析方法仅对ALP 产生明显的荧光响应,而对1 mmol/L 的各种潜在干扰物产生的响应微弱可以忽略不计,表明该荧光分析方法选择性好,用于ALP 活性检测具有高的可靠性。
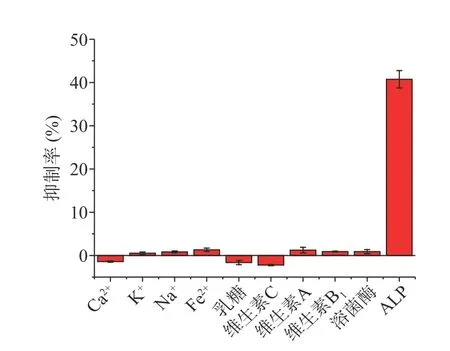
图8 荧光分析方法对ALP 检测的选择性Fig.8 The selectivity of this fluorescence assay for the detection of ALP
2.5 鲜牛奶样品中ALP 的检测
在最佳条件下,用荧光光谱仪测定不同ALP 活性浓度(0~100 U/L)所引起的体系荧光强度变化值。由图9 可知,随着ALP 活性浓度的提高,体系荧光强度逐渐下降,并且当ALP 活性浓度在0.01~25 U/L的范围,体系相对荧光强度F0-F1与ALP 活性浓度呈现良好的线性关系,线性回归方程为:Y=15397.05X+70344.46,决定系数R2为0.995(其中Y 表示体系相对荧光强度(F0-F1),X 表示ALP 的浓度),定量限为0.003 U/L (S/N=10),检测限达到0.001 U/L(S/N=3)。相比于前期报道的乳制品中ALP 的检测方法(表1),该荧光分析法具有更宽的线性范围及更高的灵敏度。
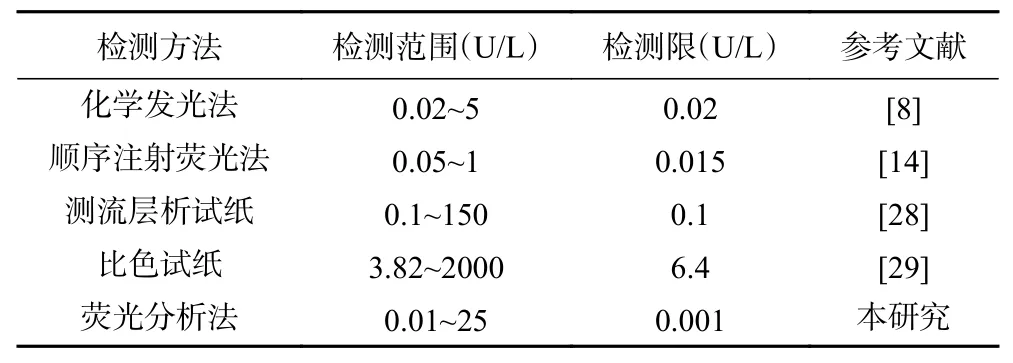
表1 乳制品中ALP 检测方法的对比Table 1 Comparison of methods for detecting ALP in milk products
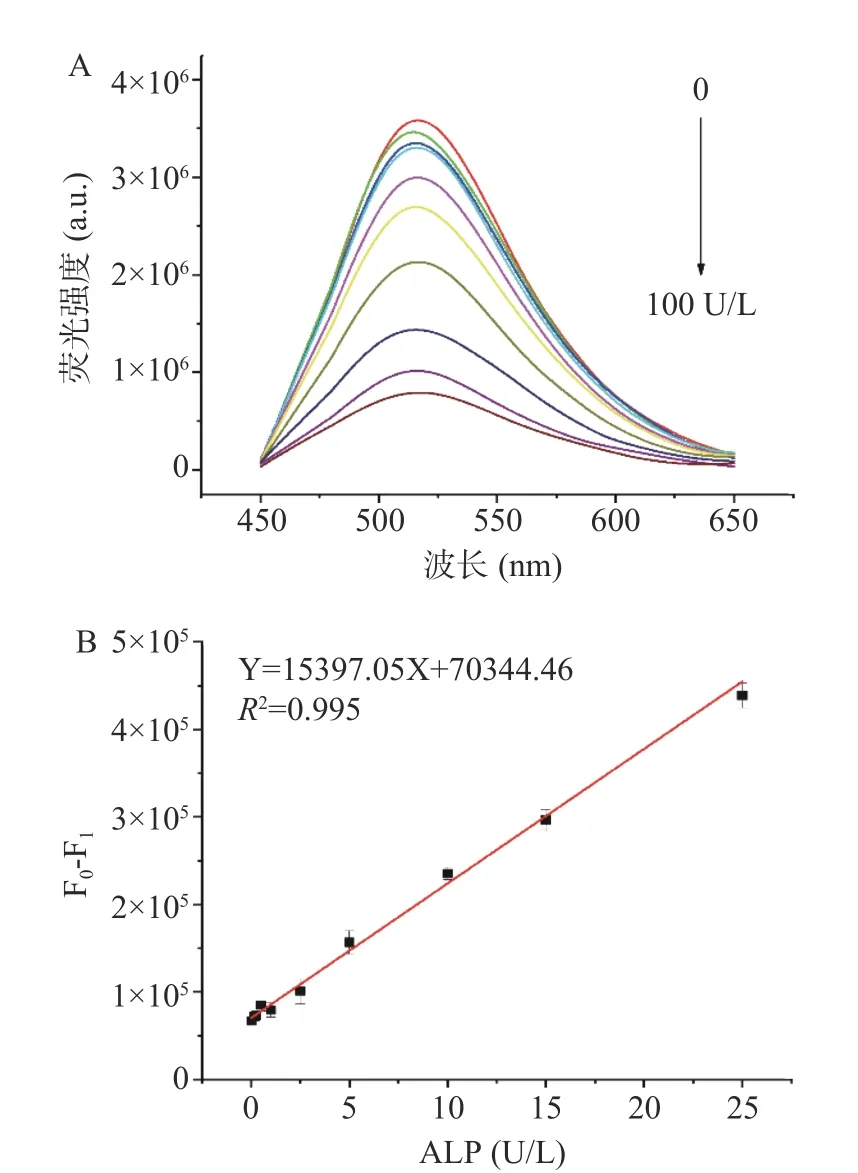
图9 不同浓度ALP 存在下体系荧光强度的变化(A)和ALP 测定的标准曲线(B)Fig.9 Fluorescence emission spectra of assay system in the presence of various concentration of ALP (A) and the calibration curve of the fluorescence assay for ALP activity determination (B)
为了验证方法的准确性,本研究选取市售两种品牌的鲜牛奶进行添加回收实验。由表2 可知,品牌1 鲜牛奶样品的添加回收率在100.9%~107.2%之间;品牌2 样品的添加回收率在100.1%~106.9%范围内。两种品牌鲜牛奶样品的添加回收率都在80%~120%之间,变异系数都在14.3%以下,表明该荧光分析方法具有较好的准确性可以用于鲜牛奶中ALP 活性的检测。
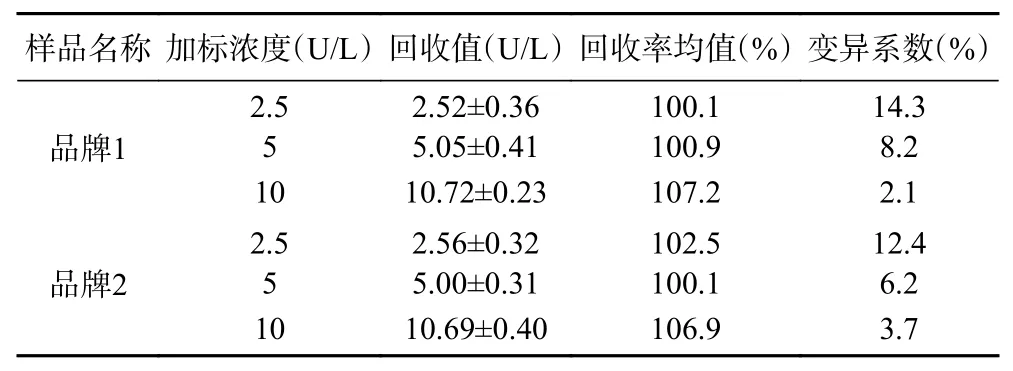
表2 鲜牛奶样品中ALP 的添加回收实验结果Table 2 Experimental results of recovery of ALP in fresh milk
3 结论
本研究以一种绿色荧光的N-CDs 作为荧光探针构建的荧光分析方法对ALP 具有很好的灵敏度、选择性与抗干扰能力。以检测体系的PNPP 浓度,工作缓冲液pH,反应时间为单因素,优化得到ALP 的最佳检测条件为pH10.0,PNPP 浓度为1 mmol/L,酶促反应时间为50 min。最优条件下,该方法对ALP的检测限达到0.001 U/L,并且牛奶样品中潜在的干扰物均不对检测产生明显影响。实际样品添加回收实验表明,该方法回收率高(100.1%~107.2%),可准确测定巴氏杀菌奶中ALP。由于荧光碳点具有合成简单、成本低廉、低毒或无毒性以及相对于有机荧光染料的更强的抗光漂白能力及荧光稳定性,该方法不但具有荧光分析的高灵敏度,同时弥补传统荧光分析法荧光信号稳定性差抗干扰不足的缺陷。虽然该方法操作简单便利,但还是依赖荧光光谱仪这类实验室专业的设备进行信号读取,不利于现场快速检测,下一步可以在本研究的基础上,开发配套荧光便携检测装置,以满足对全链条牛奶产品中ALP 实时检测的需求。总之,本研究构建的鲜牛中ALP 检测荧光分析方法具有快速、操作简便、灵敏度高、成本低等优势,为牛奶中ALP 的荧光快速检测提供一种新思路。
